草酸法提取柠檬果胶工艺优化及品质评价
2023-03-21邹严俊杰周米亚
郑 茜 邹严俊杰 周米亚 任 旭
(1. 重庆食品工业研究所有限公司,重庆 400042;2. 重庆师范大学生命科学学院,重庆 401331;3. 西南大学食品科学学院,重庆 400715)
柠檬为芸香科柑橘属,是一种常见的热带水果,是世界上第三大柑橘品种[1]。中国柠檬年产量达231万t,约占全球总产量的13.4%[2],主要以四川安岳、重庆潼南柠檬为代表,现多品种开发、深加工拓展的趋势,具有较大的市场开发价值[3]。加工过程中柠檬皮渣残渣率可达30%~50%[4],而柠檬皮渣干基中果胶含量达30%[5-6]。因此,提取柠檬皮渣中的果胶能较大程度地提高生产效益和产业附加值。
酸法是工业中被广泛应用的果胶提取方法。目前,商品果胶通常采用盐酸、硝酸、硫酸等无机酸提取。不同种类酸提取的柑橘果胶得率差异显著,其中磷酸的得率(10.82%)最低,硫酸的得率(11.97%)次之,硝酸的得率(12.65%)稍大,但其果胶颜色较暗黄。有机酸也可以用于柑橘果胶的提取,柠檬酸的得率(14.83%)甚至高于盐酸的(13.98%)[7]。对于可可皮等非柑橘来源的果胶,采用柠檬酸提取的得率为7.62%,甲酯化度为37.76%,显著高于盐酸法的提取率(5.25%)及甲酯化度(10.24%)[8]。草酸作为有机酸中的一种强酸,可以电离出氢离子作用于果皮,使得果皮中水不溶性的果胶转变为水溶性果胶溶解出来;同时,草酸还可以电离出草酸根离子作用于体系中的金属离子,使得草酸根离子和金属离子产生螯合作用,促进果胶的提取[9-10]。Peng等[11]对比了不同有机酸(柠檬酸、草酸、乙酸和酒石酸)对黄果果胶的提取效果,其中草酸的得率最高为16.86%,其他酸的得率为7.40%~14.35%。
柠檬果胶的分子量较大,同型聚半乳糖醛酸区较长,理论上具有更好的凝胶性能。为提高柠檬果胶提取率的同时保持其凝胶性能,研究拟采用草酸法提取(OAE)柠檬皮渣中的果胶,考察料液比、pH、提取温度及提取时间对柠檬果胶提取率的影响,分析所提取柠檬果胶的纯度和酯化度,并与市售高酯果胶(HMP-1和HMP-2)的凝胶性能进行对比,旨在为柠檬果胶的草酸法提取工艺的发展提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
柠檬皮渣:新鲜的尤力克柠檬,将新鲜柠檬皮渣水煮后烘干、粉碎并过筛(100目),重庆高标食品有限公司;
高酯柠檬果胶:采用硝酸提取(NAE),重庆檬泰生物科技有限公司;
HMP-1:APA104,山东烟台安德利果胶股份有限公司;
HMP-2:RS 461,丹尼斯克(中国)有限公司;
草酸:分析纯,广东光华科技股份有限公司;
无水乙醇、氢氧化钠、酚酞:分析纯,成都市科隆化学品有限公司;
盐酸:分析纯,重庆万盛川东化工有限公司;
柠檬酸、柠檬酸钠:分析纯,广东翁江化学试剂有限公司;
氯化钙:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
流变仪:DHR-2型,美国TA仪器有限公司;
电子分析天平:AE224型,上海舜宇恒平科学仪器有限公司;
超纯水仪:ATSutoc-1810型,重庆安特生环保设备有限公司;
磁力加热恒温搅拌器:C-MAGHS10S25型,艾卡(广州)仪器设备有限公司;
增力电动搅拌器:DJ1C-300型,北京润恒奥仪器仪表设备有限公司;
恒温水浴锅:BL-3CB型,重庆永恒实验仪器厂;
精密pH计:FE28型,梅特勒—托利多仪器(上海)有限公司;
高速冷冻离心机:TGL-16型,四川蜀科仪器有限公司;
电热恒温鼓风干燥箱:DGG9140型,上海森信实验仪器有限公司;
多功能粉碎机:YB-250A型,永康市速锋工贸有限公司。
1.2 方法
1.2.1 草酸法提取果胶工艺条件优化 参照黄莹星[3]的方法并修改。称取5 g柠檬皮渣粉末,按一定料液比[1∶10,1∶20,1∶30,1∶40,1∶50 (g/mL)]加入去离子水,用草酸调节pH至1.6,1.8,2.0,2.2,2.4,在一定提取温度(75,80,85,90,95 ℃)的恒温水浴锅中加热搅拌30,45,50,55,60 min提取柠檬果胶。6 000 r/min离心15 min,收集上清液,残渣用50 mL去离子水洗涤后再次离心取上清液,合并,用200目滤布过滤。上清液冷却至室温,加入1.5倍无水乙醇醇沉30 min,收集沉淀并用相同方法进行2次沉淀。6 000 r/min离心15 min,沉淀物于60 ℃烘干,称量,并计算提取率。
1.2.2 果胶得率测定 参照Zahra等[12]的方法,按式(1)计算果胶提取率。
(1)
式中:
R——果胶的提取率,%;
m1——果胶的质量,g;
m2——柠檬皮渣粉末的质量,g。
1.2.3 果胶纯度与酯化度测定 根据GB 25533—2010测定总半乳糖醛酸含量和酯化度,并分别按式(2)、式(3)计算总半乳糖醛酸含量和酯化度。
(2)
(3)
式中:
X2——总半乳糖醛酸含量,%;
X3——酯化度,%;
V1——初始滴定度,mL;
V2——皂化滴定度,mL;
m3——G3砂芯漏斗的质量,mg;
m4——干燥后G3砂芯漏斗的质量,mg。
1.2.4 流变学分析
(1) 静态流变性测定:参照Cho等[13]的方法并修改。将0.25 g果胶溶于50 mL去离子水中配成质量浓度为0.5%的果胶溶液,60 ℃水浴搅拌至果胶完全溶解,加去离子水定容至50 mL,用流变仪进行剪切变稀黏度测定。仪器参数:平板直径60 mm,温度25 ℃,剪切速率0.1~100 s-1,测试间隙500 μm,调整间隙50 μm,平衡时间60 s,flow ramp测试模式。
(2) 钙敏性测定:参照李梦等[14-15]的方法并修改。将0.5 g果胶溶于50 mL pH为3.5的柠檬酸—柠檬酸钠缓冲液(0.1 mol/L)中配成质量浓度为2%的果胶溶液,待果胶完全溶解后,加入0.1% CaCl2,60 ℃水浴搅拌至果胶完全溶解,加去离子水定容至50 mL,超声去除果胶凝胶中的气泡,4 ℃保存12 h,用流变仪进行动态黏弹性测定。测试条件:小振幅频率扫描,平板直径40 mm,测试间隙500 μm,调整间隙50 μm,平衡时间60 s,频率0.01~100 Hz,温度25 ℃,应变1%,Oscillation Frequency测试模式。
(3) 温敏性测定:参照刘贺等[16]的方法并修改。将0.5 g果胶溶于50 mL去离子水中配成质量浓度为1%的果胶溶液,待果胶完全溶解后,加入0.04 g CaCl2,60 ℃水浴搅拌至果胶完全溶解,加去离子水定容至50 mL,用流变仪进行变温测试。测试条件:小振幅变温测试,平板直径40 mm,测试间隙500 μm,调整间隙50 μm,频率1 Hz,初始温度80 ℃,终止温度4 ℃,降温速率5 ℃/min,应变0.5%,Oscillation Temperature Ramp测试模式。
1.2.5 数据统计与分析 所有试验重复3次,使用Excel 2022处理数据;使用Origin 2021软件绘图。
2 结果与分析
2.1 草酸法提取工艺优化
2.1.1 单因素试验 由图1(a)可知,由于较大的料液比会增大果胶与乙醇溶液的接触面积,因此在醇沉过程中果胶的扩散频率会加快,果胶提取率升高。但当料液比>1∶20 (g/mL)时,过多的乙醇溶液会导致较多的杂质溶出,果胶纯化受到影响,因此果胶提取率不高[17]。故以料液比1∶10,1∶20,1∶30 (g/mL)作为正交试验中较优的3个水平。
由图1(b)可知,当pH为1.6~2.0时,果胶提取率随pH的增大而升高,pH降低时,氢离子浓度增加,柠檬皮中的原果胶通过水解作用变成水溶性果胶,电离出草酸根离子,与原料组织中的金属离子螯合,因此更加有利于果胶的溶出。但强酸可促使水溶性果胶剥落和裂解,因此当pH值持续减小时,果胶提取率也随之降低;当pH为2.0~2.4时,由于较弱的酸性条件会导致果胶溶出效果变差,从而使得果胶提取率下降[18-19]。故以pH 1.8,2.0,2.2作为正交试验中较优的3个水平。
由图1(c)可知,当提取温度为90 ℃时,柠檬果胶提取率最高。这可能是因为随着提取温度的升高,植物体中固体的溶解度和扩散率会增加,从而提高提取率。此外,提取温度升高可能会破坏果胶中的酯键和氢键,因此更加有利于提取。但是过高的提取温度会引起热降解,导致果胶的结构和稳定性被破坏,使得果胶提取率降低[20-21]。故将提取温度85,90,95 ℃作为正交试验中较优的3个水平。
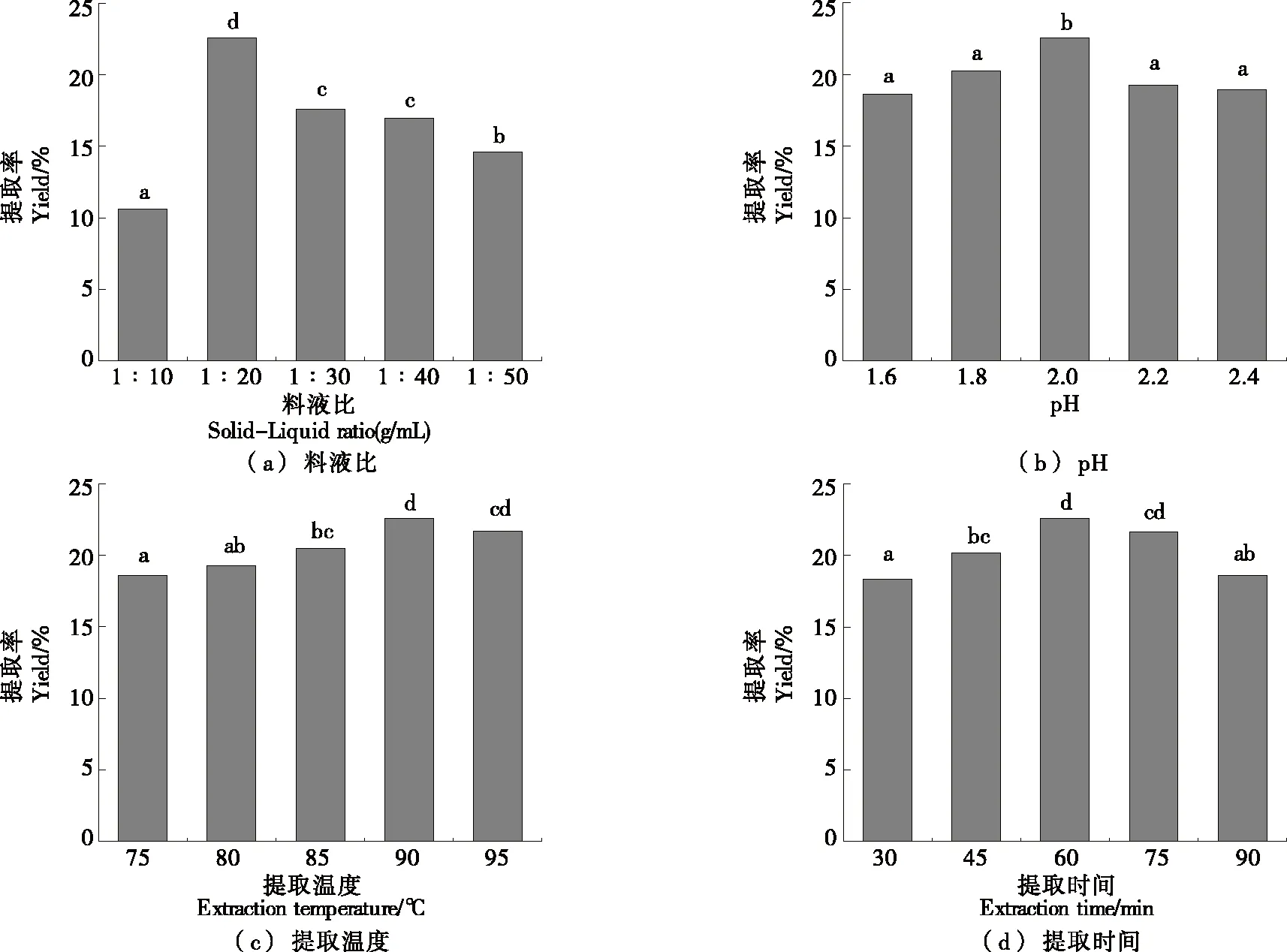
字母不同表示差异显著(P<0.05)
由图1(d)可知,适当地延长提取时间能使果胶最大限度地从植物细胞壁上洗脱,水溶性果胶转化更充分,因此提取率升高,当提取时间为60 min时提取率最高。但过长的提取时间会使得果胶结构被解聚和脱脂,且杂质溶出增多,导致提取率下降[22-23]。故将提取时间45,60,75 min作为正交试验中较优的3个水平。
2.1.2 正交试验 在单因素试验的基础上,以料液比、pH、提取温度及提取时间为影响因子,以提取率为评价指标,进行四因素三水平的正交试验。正交试验因素水平见表1,试验设计与结果见表2。
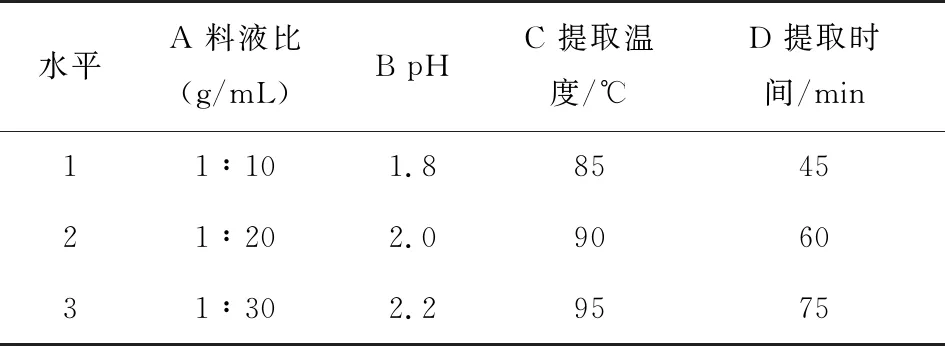
表1 草酸法提取柠檬果胶的因素水平表
由表2可知,各因素对柠檬果胶提取率的影响顺序依次为A>C>D>B,最优组合为A2C3D3B3,即料液比为1∶20 (g/mL)、提取温度为95 ℃、提取时间为75 min、pH为2.2。以此条件进行3次验证实验,测得柠檬果胶提取率为22.83%,高于正交试验中的所有组合,因此该组合为最优工艺条件。
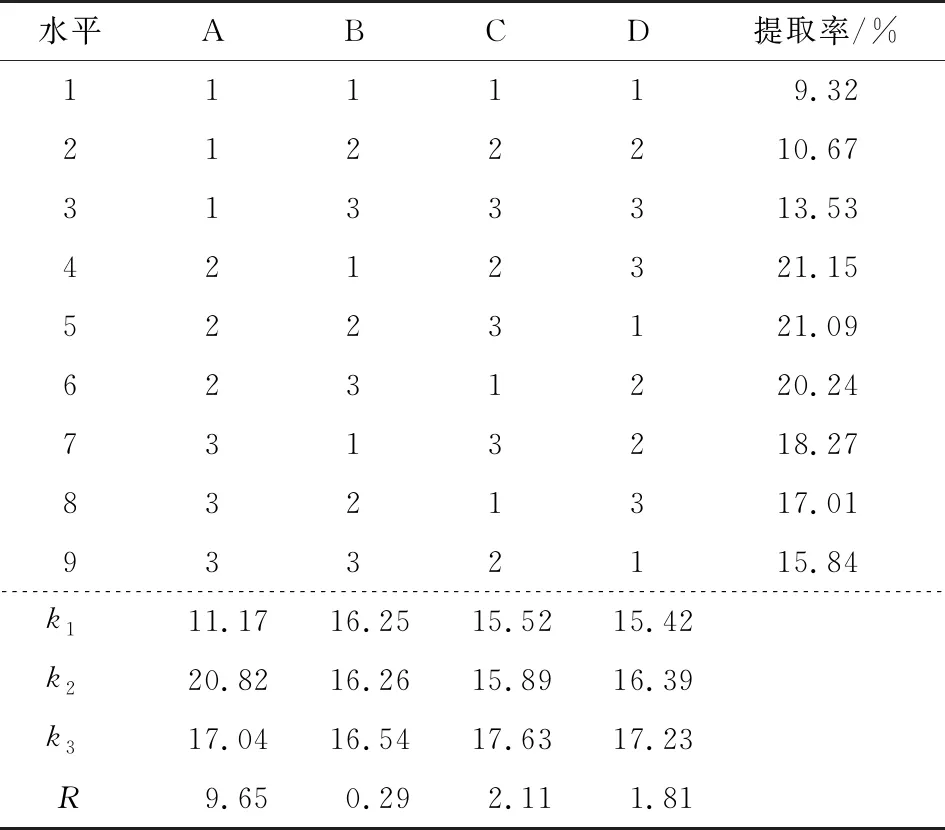
表2 草酸法提取柠檬果胶工艺优化正交试验设计与结果
2.2 果胶纯度与酯化度
由表3可知,草酸法提取果胶的总半乳糖醛酸含量为76.06%,符合GB 25533—2010中的要求(≥65%)。酯化度>50%的果胶为高酯果胶,酯化度<50%的果胶为低酯果胶[14],试验所测的果胶为高酯果胶,且草酸法提取果胶的纯度和酯化度均高于NAE果胶,具有较好的品质。
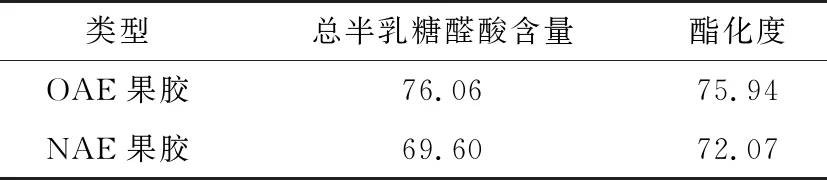
表3 柠檬果胶的理化指标
2.3 果胶凝胶特性
2.3.1 静态流变性 由图2可知,OAE柠檬果胶的黏度高于市售HMP-1和HMP-2。3种不同来源的果胶均表现出了良好的流变特性,且随着剪切速率的增加表现黏度降低,呈剪切变稀行为。这可能是由于高剪切速率下果胶分子链缠结数量减少,分子间空隙加大,胶体的黏度减弱[24-26]。综上,草酸法提取的柠檬果胶具有成为增稠剂的性质。
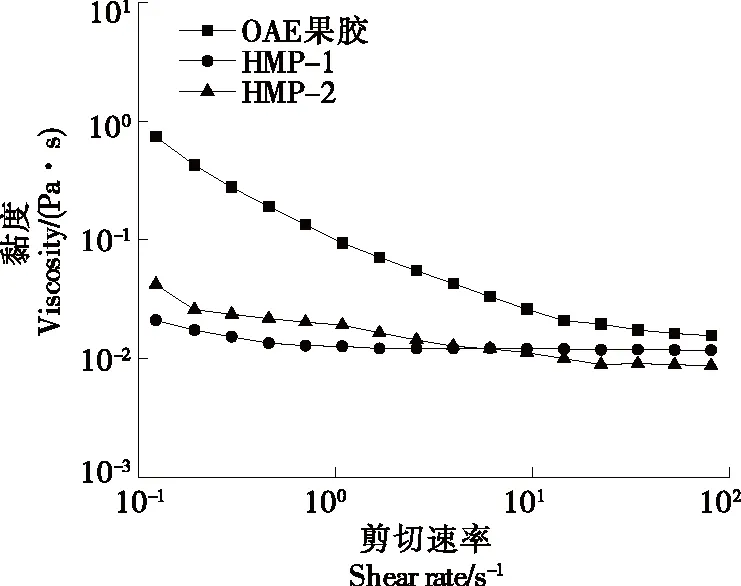
图2 果胶的静态剪切变化曲线Figure 2 Statics shear curve of pectin
2.3.2 钙敏性 由图3可知,3种果胶黏弹性即钙敏性大小为HMP-2>柠檬果胶>HMP-1。这可能是因为HMP-2具有更多的侧链,可以更加稳定钙离子与羧基的相互作用。添加钙离子后,所有果胶样品黏弹性上升且G′占主导地位,是由于钙离子被用作羧基间的桥梁,并与果胶链形成了“蛋盒”模型,因此增强了果胶的网络结构,此外“蛋盒”的连接区域也有助于增强果胶的弹性[26-27]。
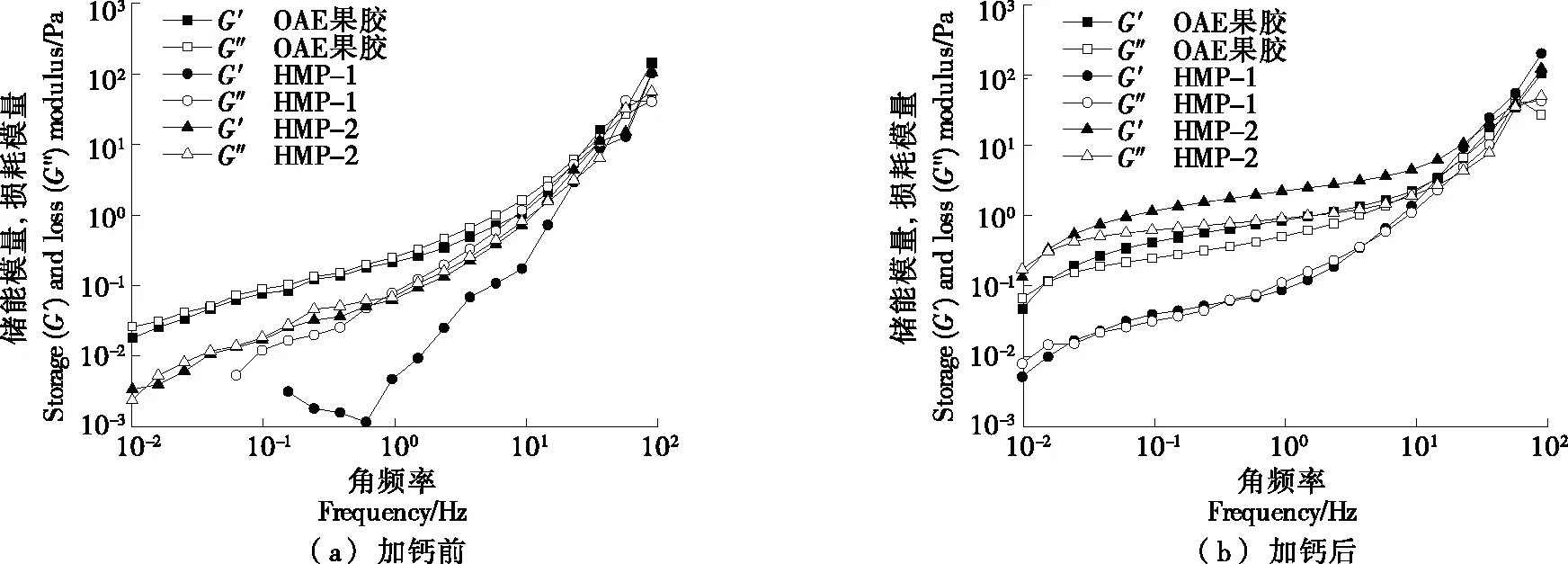
图3 加钙前后果胶的储能模量和损耗模量的变化曲线Figure 3 Change curve of storage modulus and loss modulus of pectin before and after adding calcium
2.3.3 温敏性 冷却过程中,G′与G″的交叉点被称为凝胶点,对应的温度被称为凝胶温度。由图4可知,柠檬果胶和HMP-2的凝胶温度分别为76.55,67.98 ℃。但HMP-1呈现的结果与其他两种果胶不同,即使在非常高的温度下,也未观察到交叉点,可能是由于HMP-1过高的酯化度导致其快速凝胶化[28-29]。综上,草酸法提取的柠檬果胶具有作为胶凝剂的特性。
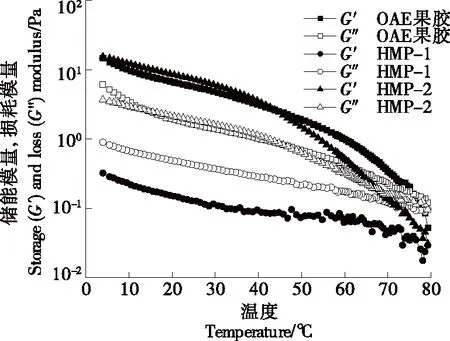
图4 冷却过程中不同果胶的储能模量和损耗模量的变化曲线
3 结论
采用草酸法提取柠檬皮渣中的果胶,筛选出了最适的提取条件,并与市售高酯果胶的凝胶性能进行了对比。结果表明:草酸法提取柠檬果胶的最佳工艺条件为料液比1∶20 (g/mL)、pH 2.2、提取温度95 ℃、提取时间75 min,该条件下柠檬果胶粗提物得率为22.83%。草酸法提取柠檬果胶中总半乳糖醛酸含量为76.06%,酯化度为75.94%,为高酯果胶;该果胶的黏度高于两种市售高酯果胶、钙敏性介于HMP-1与HMP-2之间、温敏性与HMP-2相似,且钙离子环境下可在76.55 ℃时发生溶胶—凝胶转变。草酸法提取的柠檬果胶拥有良好的流变性能和凝胶性能,具备作为酸性乳饮料中稳定剂的潜力。草酸法提取柠檬果胶与酸性乳饮料的适配性未在试验中体现,后续需继续开展草酸法提取柠檬果胶在酸性乳饮料中的稳定机制研究,根据酸性乳饮料的流变性、脱水收缩率、稳定时间等验证所提果胶的功能特性。
