坛紫菜多酚工艺优化及降血糖和抗氧化活性研究
2023-03-21陈晓晨杜希萍周莉鹃李志朋杨远帆
陈晓晨 杜希萍,2,3,4 周莉鹃 伍 菱,2,3,4 李志朋,2,3,4 杨远帆,2,3,4
(1. 集美大学海洋食品与生物工程学院,福建 厦门 361021;2. 福建省食品微生物与酶工程重点实验室,福建 厦门 361021;3. 厦门市食品与生物工程技术研究中心,福建 厦门 361021;4. 厦门南方海洋研究中心海藻资源化利用与深加工重点实验室,福建 厦门 361021)
坛紫菜(Porphyrahaitanensis)属红藻类红毛菜科,是中国重要的大型经济海藻,广泛种植于福建、浙江和广东等沿海城市,年产量占全国70%以上[1-2]。坛紫菜的产量较大、生长周期较长,具有“分茬”采收的特点,首次采收的紫菜称作“头水坛紫菜”,之后依次称作二水、三水坛紫菜等。据报道[3],不同海域和不同采收期的坛紫菜在蛋白质、脂肪、灰分等营养物质方面均存在一定的差异,头水坛紫菜的营养价值最高,口感最好,售价也最高[4]。随着采收期的延长,坛紫菜的营养价值降低,口感变差,商业价值降低,常被养殖户遗弃,造成环境污染和资源浪费[5]。因此,对采收后期坛紫菜的应用和开发受到国内广大研究者的关注[6]。
坛紫菜多酚具有抗氧化、抑菌、降血糖和抗肿瘤等多种活性功能[7]。α-葡萄糖苷酶是一种位于小肠黏膜上的水解酶,能够将二糖转化成能被小肠吸收的单糖,从而引发餐后血糖升高。研究表明,多酚可以通过抑制α-葡萄糖苷酶的活性[8-9],延迟碳水化合物的分解和葡萄糖的吸收,从而有效调节糖尿病患者餐后血糖的浓度[10]。除此之外,多酚类化合物还可以通过清除自由基发挥降血糖作用,通过抑制机体的氧化反应,让自由基维持在稳定状态,保护机体免受氧化损伤[10]。目前,不同采收期坛紫菜多酚对α-葡萄糖苷酶的抑制活性、抗氧化作用的研究尚未见报道。
研究拟以坛紫菜为原料,采用超声波辅助法提取坛紫菜多酚,研究乙醇体积分数、超声时间、液料比3个因素对多酚提取的影响,结合响应面法优化坛紫菜多酚的提取工艺条件,进一步研究不同采收期坛紫菜的多酚含量及对α-葡萄糖苷酶活性的抑制作用和抗氧化作用,以期为不同采收期坛紫菜在天然降血糖食品及抗氧化剂领域的高值化利用提供参考依据。
1 材料与方法
1.1 材料与试剂
坛紫菜干制品(头水、二水、三水和四水):市售;
α-葡萄糖苷酶、4-硝基苯-α-D-葡萄糖苷(p-NPG):美国Sigma公司;
没食子酸、无水乙醇、福林酚、2,2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS):国药集团化学试剂有限公司;
2,2’-偶氮二异丁基咪二盐酸盐(AAPH)、水溶性维生素E(Trolox)、荧光素钠、1,1-二苯基-2-三硝基苯肼(DPPH):上海源叶生物科技有限公司;
无水碳酸钠:西陇化工股份有限公司。
1.2 仪器与设备
高速万能粉碎机:JP-500C型,郑州科丰仪器设备有限公司;
电子天平:EL104型,梅特勒托利多科技(中国)有限公司;
高频率数控超声波清洗器:KQ5200DE型,昆山市超声仪器有限公司;
高速冷冻离心机:5810R型,艾本德中国有限公司;
循环水式多用真空泵:SHB-Ⅲ型,郑州长城科工贸有限公司;
旋转蒸发器:RE-52AA型,上海亚荣生化仪器厂;
微孔板恒温振荡器:TS200型,杭州瑞诚仪器有限公司;
微孔板分光光度计:Epoch2T型,美国伯腾仪器有限公司。
1.3 试验方法
1.3.1 坛紫菜多酚提取 将坛紫菜用粉碎机粉碎,过60目筛,干燥避光保存备用。准确称取1 g坛紫菜粉末,按一定液料比加入一定体积分数的乙醇溶液,在超声功率800 W条件下提取一段时间,8 000 r/min离心20 min,上清液即为坛紫菜多酚提取液,提取3次。低压真空浓缩除去乙醇溶剂,浓缩液冷冻干燥,得到坛紫菜多酚样品,-20 ℃贮藏备用。
1.3.2 单因素试验 按照1.3.1的提取方法,以液料比[V乙醇溶液∶m坛紫菜分别为30∶1,40∶1,50∶1,60∶1,70∶1 (mL/g)]、乙醇体积分数(40%,50%,60%,70%,80%)、超声时间(30,40,50,60,70 min)为考察因素,以多酚含量为指标,探索最适的坛紫菜多酚提取条件。
1.3.3 响应面试验 在单因素试验的基础上,根据Box-Behnken中心组合试验设计原理,设计三因素三水平的响应面分析方法,优化超声波辅助提取坛紫菜多酚的工艺参数。
1.3.4 坛紫菜多酚含量测定 采用Folin法[7],根据标准曲线回归方程和式(1)计算坛紫菜的多酚含量(以没食子酸计)。
(1)
式中:
c——多酚的质量浓度,μg/mL;
V——提取液体积,mL;
m——样品质量,g;
y——坛紫菜中的多酚含量,mg/g。
1.3.5 多酚对α-葡萄糖苷酶的抑制作用
(1) 制备紫菜多酚样品:根据响应面优化得到的最佳提取条件,制备大量不同采收期的坛紫菜多酚提取液,低压真空浓缩除去乙醇溶剂,浓缩液冷冻干燥,得到坛紫菜多酚样品,-20 ℃贮藏备用。
(2) 多酚对α-葡萄糖苷酶抑制活性测定:将不同采收期的坛紫菜多酚样品用超纯水分别稀释成不同质量浓度(25,50,100,200 mg/mL)的样品溶液。参考Qi等[11]的方法并略作修改。向96孔板中分别加入20 μL样品,20 μL 2 U/mL的α-葡萄糖苷酶溶液和112 μL的磷酸缓冲溶液(pH 6.8),孵育后加入20 μL 2.5 mmol/Lp-NPG,再次孵育后加入80 μL 0.2 mol/L的Na2CO3溶液终止反应。按式(2)计算α-葡萄糖苷酶的抑制率。
(2)
式中:
I——α-葡萄糖苷酶的抑制率,%;
A1——试验组(α-葡萄糖苷酶+样品)所测得的吸光值;
A2——试验对照组(磷酸缓冲溶液+样品)所测得的吸光值;
A3——空白组(α-葡萄糖苷酶+水)所测得的吸光值;
A4——空白对照组(磷酸缓冲溶液+水)所测得的吸光值。
1.3.6 多酚的抗氧化活性测定
(1) DPPH自由基清除能力:参考屠万倩等[12]的方法。将冻干所得的不同采收期的坛紫菜多酚样品用超纯水分别稀释成不同质量浓度(0.025,0.050,0.125,0.250,0.500,1.000,2.000,3.000 mg/mL)的样品溶液。按式(3)计算DPPH自由基的清除率。
(3)
式中:
CDPPH——DPPH自由基清除率,%;
Ax——试验组(DPPH溶液+样品)所测得的吸光值;
A1——试验对照组(无水乙醇+样品)所测得的吸光值;
A0——空白组(DPPH溶液+水)所测得的吸光值。
(2) ABTS+自由基清除能力:参考Shen等[13]的方法。将冻干所得的不同采收期的坛紫菜多酚样品用超纯水分别稀释成不同质量浓度(0.025,0.050,0.125,0.250,0.500,1.000,2.000,3.000 mg/mL)的样品溶液。按式(4)计算ABTS+自由基的清除率:
(4)
式中:
CABTS+——ABTS+自由基清除率,%;
Ax——试验组(ABTS+溶液+样品)所测得的吸光值;
A0——空白组(ABTS+溶液+水)所测得的吸光值。
(3) 氧自由基吸收能力(ORAC):参考何丽芳等[14]和陈雪[15]的方法,样品对氧自由基的吸收能力以Trolox当量表示(μmol Trolox/g)。
2 结果与分析
2.1 液料比对坛紫菜多酚提取的影响
由图1可知,随着液料比(V乙醇溶液∶m坛紫菜)的增加,多酚含量呈上升趋势,在液料比为50∶1 (mL/g)时多酚含量达到最大,显著高于其他液料比(P<0.05),含量为4.507 mg/g。液料比超过50∶1 (mL/g)后,多酚含量逐渐下降。结果表明,当液料比为50∶1 (mL/g)时,坛紫菜样品已完全溶解。过低或过高的液料比都会导致坛紫菜的多酚含量下降[16]。因此,选择液料比40∶1,50∶1和60∶1 (mL/g)为响应面设计的3个水平。

小写字母不同表示差异显著(P<0.05)
2.2 乙醇体积分数对坛紫菜多酚提取的影响
由图2可知,多酚含量在乙醇体积分数为60%时达到最大,显著高于其他乙醇体积分数的(P<0.05),含量为3.960 mg/g。当乙醇体积分数超过60%后,多酚含量显著下降(P<0.05),当乙醇体积分数为90%时,多酚含量仅为0.873 mg/g。造成这种现象的原因是在低浓度乙醇和水环境中,溶剂很容易进入细胞,而高浓度的乙醇会导致蛋白质变性,减少多酚的溶解,从而影响多酚提取含量[17]。因此,选择乙醇体积分数50%,60%,70%为响应面设计的3个水平。
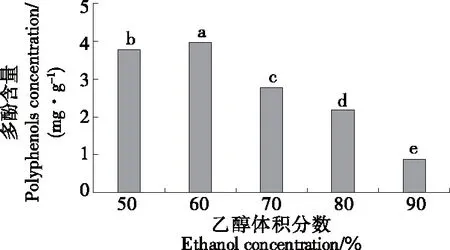
小写字母不同表示差异显著(P<0.05)
2.3 超声时间对坛紫菜多酚提取的影响
由图3可知,超声时间为50 min时,坛紫菜的多酚含量最大,为4.415 mg/g,显著高于其他时间提取的(P<0.05),超声时间超过50 min后,多酚含量显著下降(P<0.05),可能由于提取时间过长,对多酚造成了一定程度的氧化损伤,从而导致多酚含量降低[18]。因此,选择超声时间40,50,60 min为响应面设计的3个水平。
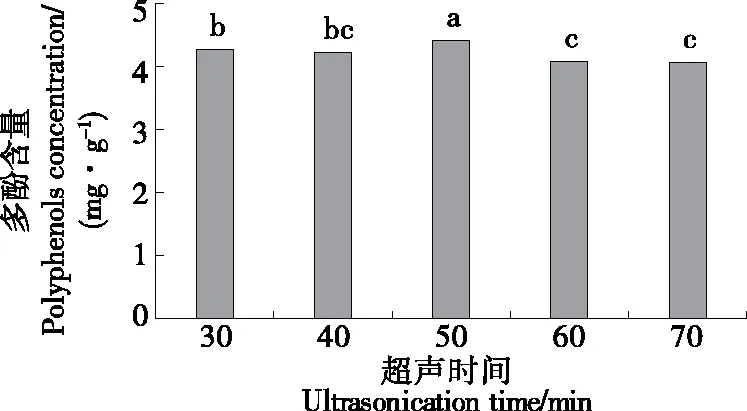
小写字母不同表示差异显著(P<0.05)
2.4 响应面优化试验
根据单因素试验结果(表1),以多酚含量为响应值,进行响应面设计(表2),采用Design-Expert 10软件对试验结果进行多元回归拟合,得到多酚含量对液料比、乙醇体积分数和超声时间的二次多项回归模型:
Y=-15.632 0+0.304 6A+0.418 7B+0.040 6C-0.000 7AB+0.000 3AC+0.001 7BC-0.002 8A2-0.004 2B2-0.001 5C2。
(5)
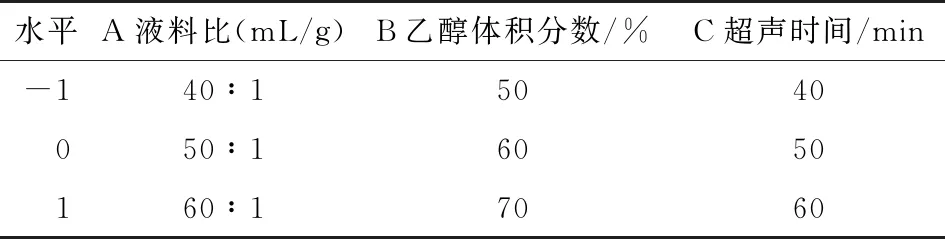
表1 Box-Behnken试验设计因素与水平
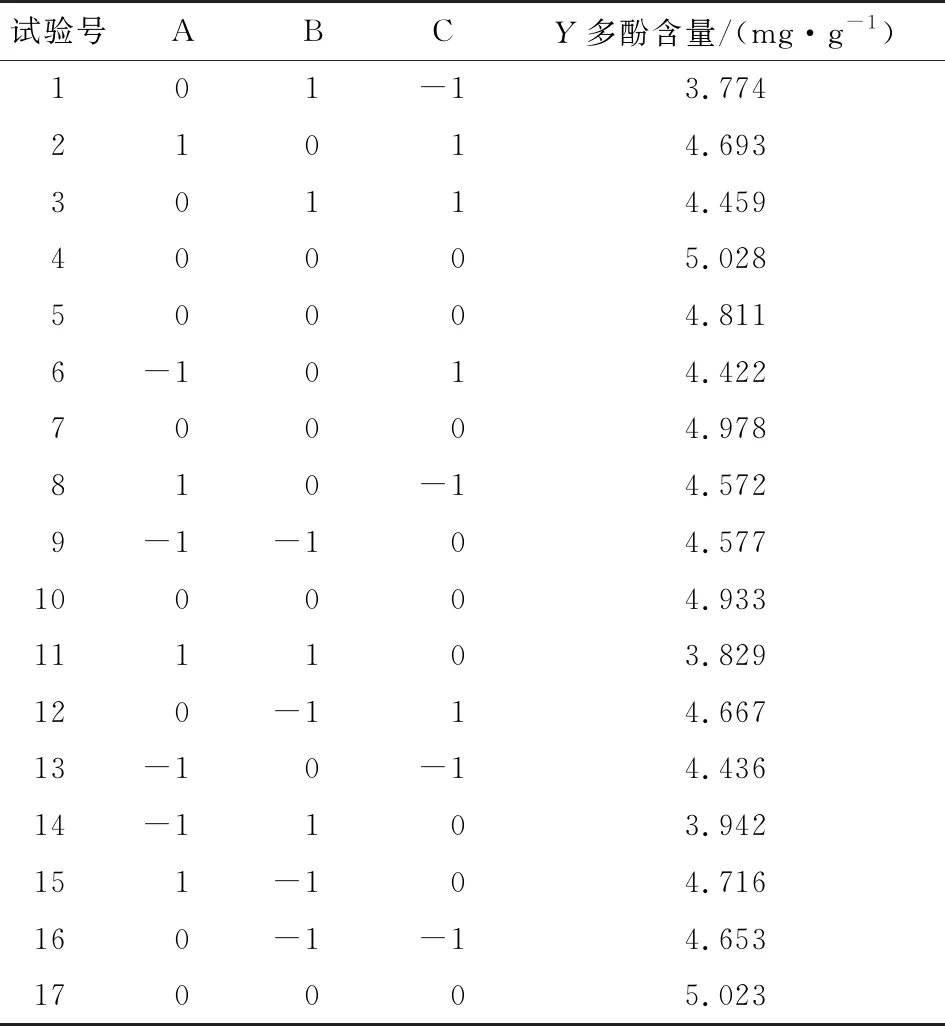
表2 响应面设计及结果
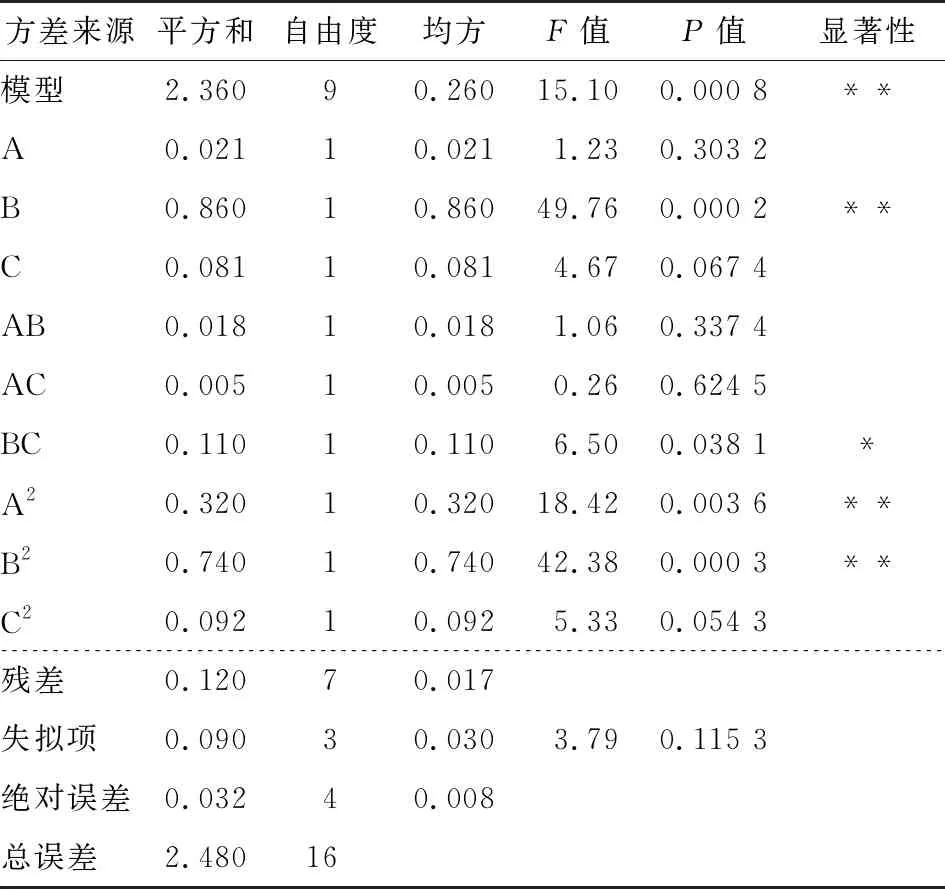
表3 回归模型方差分析
通过对图4~图6中曲面的坡度和等高线的疏密进行分析可知,试验中各因素之间的交互作用对坛紫菜多酚含量影响的顺序为:BC>AB>AC,与方差分析的结果一致。
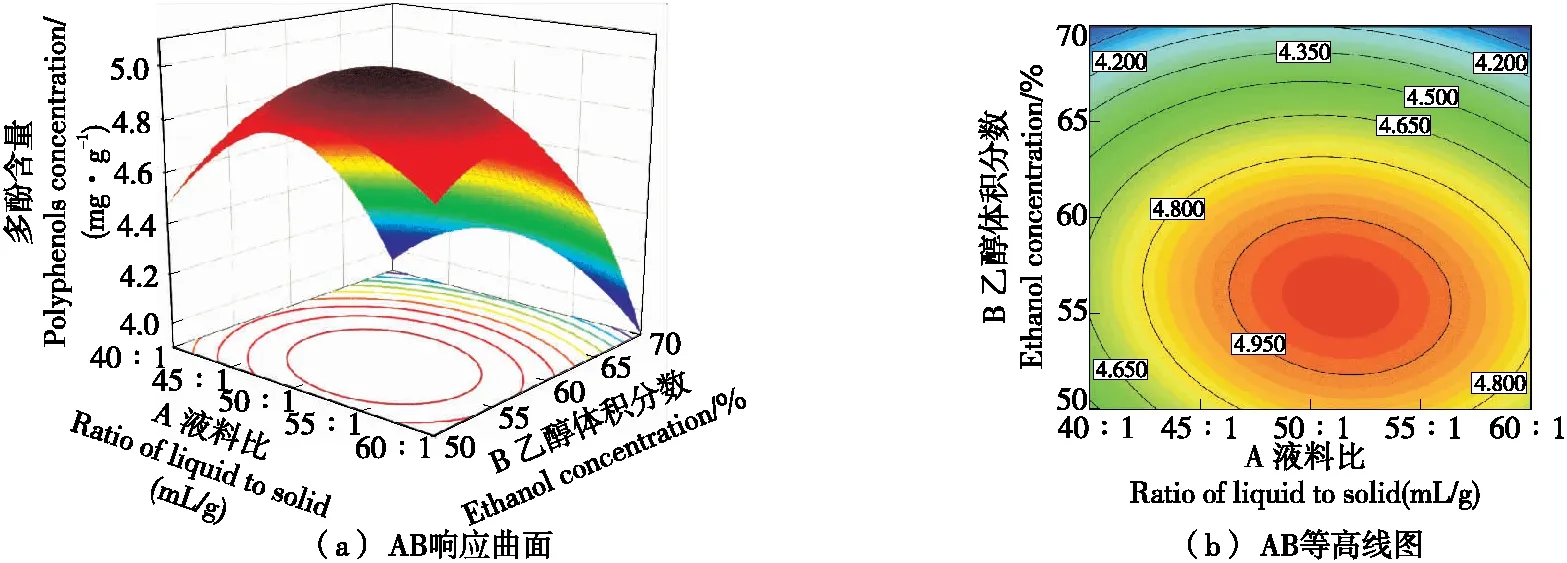
图4 AB交互作用Figure 4 AB interaction
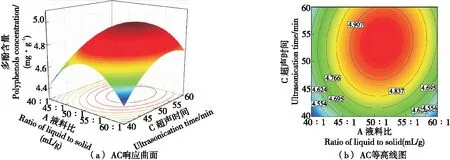
图5 AC交互作用Figure 5 AC interaction

图6 BC交互作用Figure 6 BC interaction
2.5 反应条件的优化及模型验证
运用Design-Expert 10软件分析得到坛紫菜多酚提取的最佳工艺条件为:液料比(V乙醇溶液∶m坛紫菜)51∶1 (mL/g),乙醇体积分数56%,超声时间51 min,在该条件下,提取的坛紫菜多酚含量为5.027 mg/g。考虑仪器设备及试验便利,设定最佳工艺条件为液料比(V乙醇溶液∶m坛紫菜)50∶1 (mL/g),乙醇体积分数56%,超声时间50 min,进行3次平行实验验证,结果测得坛紫菜的多酚含量为(5.203±0.057) mg/g,与预测结果接近,说明该模型的准确度较高,模型真实有效。
2.6 不同采收期坛紫菜的多酚含量
由图7可知,随着采收期的增加,坛紫菜中的多酚含量呈上升趋势。四水坛紫菜中的多酚含量最高,为6.19 mg/g;其次是头水坛紫菜与三水坛紫菜,多酚含量分别为5.89 mg/g和5.82 mg/g;二水坛紫菜的多酚含量最低,为5.30 mg/g,显著低于其他采收期。钟明杰等[20]报道通过微波辅助提取的坛紫菜多酚含量为4.40~4.77 mg/g,陈洪彬等[7]研究发现坛紫菜的多酚含量为6.10~6.85 mg/g,与此试验所测定的多酚含量相比略有差异,可能是由于坛紫菜的生长海域不同导致营养成分有所不同,多酚含量有所差异[20]。综上,四水坛紫菜多酚含量最高,可选用四水坛紫菜提取多酚,促进四水坛紫菜的高值化利用。
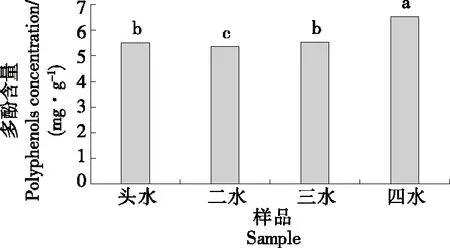
小写字母不同表示差异显著(P<0.05)
2.7 坛紫菜多酚对α-葡萄糖苷酶的抑制作用
由图8可知,坛紫菜多酚提取物对α-葡萄糖苷酶的活性具有明显的抑制作用,且呈浓度依赖性,随着多酚质量浓度的增大,其抑制作用不断增强。当多酚质量浓度为100 mg/mL时,坛紫菜多酚对α-葡萄糖苷酶的抑制活性均达到70%以上。不同采收期的坛紫菜多酚对α-葡萄糖苷酶活性的抑制作用存在一定的差异,四水坛紫菜多酚的抑制活性最高,当多酚质量浓度为100 mg/mL时,抑制率为(88.84±0.80)%,显著高于其他采收期(P<0.05);其次是三水坛紫菜多酚,抑制率为(86.75±0.34)%;头水和二水坛紫菜多酚的抑制率差异不显著(P>0.05),分别为(75.81±0.35)%和(75.50±0.30)%。
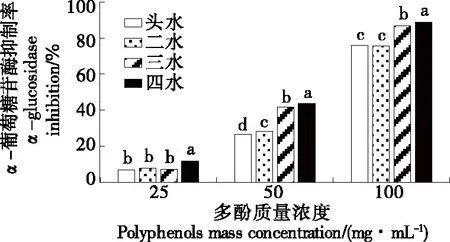
小写字母不同表示不同采收期差异显著(P<0.05)
2.8 坛紫菜多酚的抗氧化能力
2.8.1 DPPH自由基的清除能力 由图9可知,坛紫菜多酚对DPPH自由基具有较强的清除能力,随着多酚质量浓度的增加,DPPH自由基清除率呈整体上升趋势。当多酚质量浓度为0~1 mg/mL时,4个采收期坛紫菜多酚对DPPH自由基的清除率呈快速上升趋势;质量浓度为2 mg/mL时,清除率略微下降;质量浓度在3 mg/mL时,清除率为42.58%~58.79%;当质量浓度>3 mg/mL时,清除率趋于稳定。四水坛紫菜多酚对DPPH自由基的清除率显著高于其他采收期(P<0.05)。
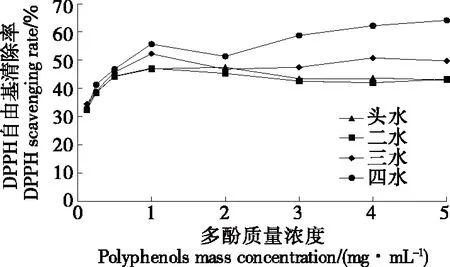
图9 不同采收期坛紫菜多酚对DPPH自由基的清除能力
2.8.2 ABTS+自由基的清除能力 由图10可知,随着多酚质量浓度的增加,坛紫菜多酚对ABTS+自由基的清除能力呈上升趋势,当多酚质量浓度为5 mg/mL时,各采收期坛紫菜多酚的ABTS+自由基清除率达到最大,与董玉婷等[21]的研究结果基本一致。
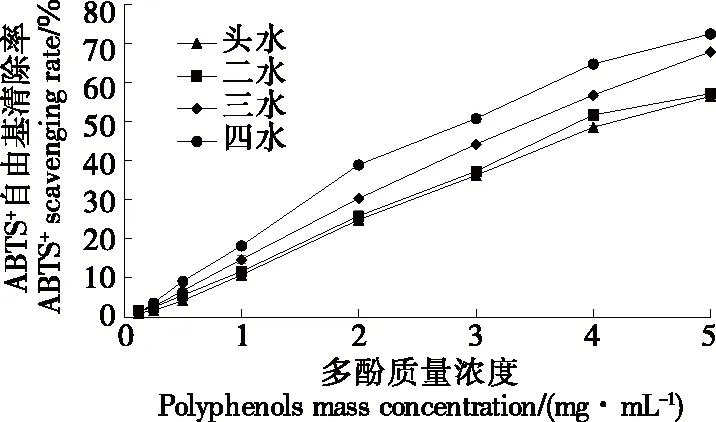
图10 不同采收期坛紫菜多酚对ABTS+自由基的清除能力
2.8.3 氧自由基吸收能力 由图11可知,随采收期的增加,ORAC值呈上升趋势,四水坛紫菜多酚的ORAC值显著高于其他采收期(P<0.05),为(35.86±2.12) μmol TE/g,其次是三水坛紫菜多酚,为(29.79±0.76) μmol TE/g,头水坛紫菜多酚和二水坛紫菜多酚的ORAC值最低且无显著性差异(P>0.05),综上,四水坛紫菜多酚的抗氧化能力强于其他采收期坛紫菜多酚。

小写字母不同表示差异显著(P<0.05)
3 结论
采用Box-Behnken响应面法优化确定了坛紫菜多酚的提取工艺,最优的工艺条件为:液料比(V乙醇溶液∶m坛紫菜)51∶1 (mL/g),乙醇体积分数56%,超声时间51 min。在此条件下,提取的多酚含量为5.027 mg/g。在此工艺下提取的不同采收期的坛紫菜多酚,坛紫菜多酚含量不同,其中四水坛紫菜的多酚含量显著高于其他采收期;坛紫菜多酚对α-葡萄糖苷酶的活性具有较强的抑制作用,其中四水坛紫菜多酚对α-葡萄糖苷酶的抑制作用最强,并且其抗氧化能力也最强。因此,四水坛紫菜是开发天然降血糖食品和抗氧化剂的优良食源。后续将鉴定坛紫菜多酚中具有抑制α-葡萄糖苷酶活性的物质并研究其在人体肠道中的吸收和转化。
