珍珠贝水解肽的制备、氨基酸组成及抗炎活性
2023-03-21沈金鹏王珂雯黄潘钿陈冰冰李应坤王湘华苗建银林碧敏
沈金鹏 王珂雯 黄潘钿 陈冰冰 夏 珍 李应坤 王湘华 曹 庸 苗建银 林碧敏
(1. 华南农业大学食品学院广东省功能食品活性物重点实验室,广东 广州 510642;2. 北海黑珍珠海洋生物科技有限公司,广西 北海 536000;3. 华南农业大学基础实验与实践训练中心,广东 广州 510642)
炎症是机体免疫系统对创伤、微生物病原体感染或化学刺激引起的组织损伤和感染而做出的一种保护性生理防御机制[1]。巨噬细胞是动物机体内最重要的免疫细胞,也是机体防御反应的重要组成部分,当机体受到外界因素刺激时,活化的巨噬细胞能通过MAPK和NF-κB等通路释放多种炎症细胞因子发挥免疫调节作用,包括促炎介质,如一氧化氮(NO)以及促炎细胞因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)等[2],这些炎症因子在诱发多种炎症性疾病的过程中发挥着关键作用。炎症免疫反应的失调会导致促炎介质和细胞因子的过度积累,可能诱发机体功能性障碍以及多种急性、慢性疾病,如动脉粥样硬化、癌症、类风湿性关节炎、急性肠胃炎和过敏等。因此,抑制活化巨噬细胞中的促炎介质和细胞因子有助于炎症性疾病的治疗[3-4]。近年来,抑制炎症细胞因子的合成或活性已成为炎症治疗的主流,促炎细胞因子抑制剂可作为抗炎药的候选药物[5]。最常用的治疗药物是类固醇、非类固醇抗炎药和单克隆抗体[6],但其中许多药物都伴有不良副作用,如降低组织的可修复性和损伤胃肠黏膜,且炎症相关疾病发病率的增加促使人们寻找具有抗炎特性的天然化合物。在炎症反应中发现的几种内源性多肽,如血管活性肠肽(VIP)、α-促黑素细胞激素(αMSH)和肾上腺髓质素等已成为抗炎剂,可用于炎症和自身免疫疾病的新疗法[5,7-8],且几种合成肽和天然肽,如鲟鱼肉水解肽[9]、牡蛎水解肽[10]、鸡肉蛋白水解肽[11]等已被证实可通过抑制炎症细胞因子的产生或表达信号转导途径,来防止过度的炎症反应。
马氏珠母贝(Pinctadamartensii)又称合浦珠母贝,是中国沿海地区珍珠养殖的主要品种之一[12]。马氏珠母贝肉营养成分丰富,富含多种功效氨基酸和活性肽,具有抗氧化、抗衰老、抗疲劳等药理作用[13]。然而取珠后的新鲜贝肉仅作为动物饲料,原料附加值较低,有待深入研究和高值化开发利用[14]。
研究利用蛋白酶对马氏珠母贝肉进行酶解,探究酶解制备活性肽的最优工艺参数和条件,并利用小鼠巨噬细胞RAW264.7抗炎评价模型对珍珠贝水解肽进行活性评价,以期为马氏珠母贝肉生物活性成分的高值化利用提供理论依据,为马氏珠母贝肉抗炎活性肽的开发提供技术参数。
1 材料与方法
1.1 材料与试剂
马氏珠母贝肉:北海黑珍珠海洋生物科技有限公司;
中性蛋白酶(10 万U/g)、胰蛋白酶(25万 U/g)、碱性蛋白酶(20万 U/g)和木瓜蛋白酶(20万 U/g):食品级,南宁庞博生物工程有限公司;
三硝基苯磺酸(TNBS):分析纯,成都化夏化学试剂有限公司;
噻唑蓝(MTT):分析纯,上海麦克林生物化学公司;
脂多糖(LPS)、二甲基亚砜(DMSO):生化试剂,美国Sigma公司;
DMEM培养基、胎牛血清(FBS):生化试剂,赛默飞世尔科技公司;
小鼠巨噬细胞RAW264.7:中科院上海细胞所;
其余试剂均为国产分析纯。
1.2 仪器与设备
数显恒温水浴锅:HH-4型,金坛市华城海龙实验仪器厂;
多管架自动平衡离心机:L530型,湖南湘仪实验室仪器开发有限公司;
电子天平:AL104型,梅特勒—托利多仪器(上海)有限公司;
pH计:PHS-3CW型,赛多利斯科学仪器(北京)有限公司;
多功能酶标仪:Enspire2300型,美国PerkinElmer公司;
微量振荡器:MH-2型,海门其林贝尔仪器制造有限公司;
真空冷冻干燥机:FD-1型,海门市其林贝尔仪器制造有限公司;
全自动氨基酸分析仪:S-433D型,赛卡姆(北京)科学仪器有限公司。
1.3 方法
1.3.1 马氏珠母贝肉酶解物的制备 马氏珠母贝肉洗净沥干,打碎成贝肉匀浆,置于-20 ℃冷冻保存。试验时解冻,称取一定量贝肉匀浆,按料液比1∶1 (g/mL)加入一级水,用0.1 mol/L NaOH调节溶液pH值至最适pH值,按酶底比0.3%加入蛋白酶,在恒温水浴锅中酶解3 h,酶解过程中每30 min搅拌混匀酶解液,90 ℃水浴灭酶10 min,冷却至室温,4 000 r/min离心10 min,取上清液测定水解度。将上清液置于-20 ℃冻结后,进行冷冻干燥,得到珍珠贝水解肽冻干粉,于-20 ℃冻藏备用。
1.3.2 酶解工艺优化
(1) 最适酶的筛选:各蛋白酶最适条件见表1,在各种蛋白酶最适条件下按1.3.1进行酶解。
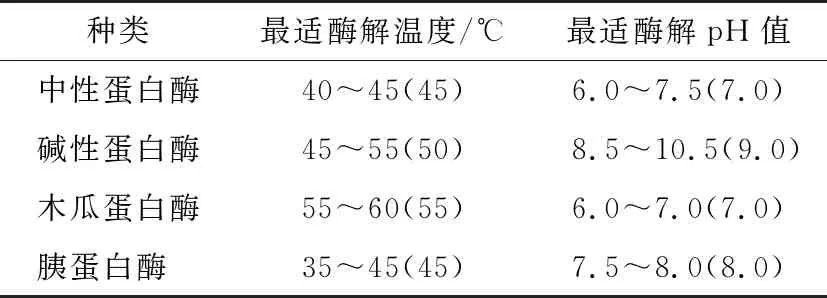
表1 4种蛋白酶的最适酶解条件
(2) 单因素试验:选择水解度最高的一种蛋白酶对影响水解度的4个因素(酶解温度、酶解时间、酶底比和料液比)进行优化,以水解度为评价指标,初始条件选取:酶底比0.3%、料液比1∶3 (g/mL)、酶解温度45 ℃和酶解时间3 h。主要优化条件:酶底比(0.1%,0.2%,0.3%,0.4%,0.5%),料液比[1∶1,1∶2,1∶3,1∶4,1∶5 (g/mL)],酶解温度(35,40,45,50,55 ℃),酶解时间(1,2,3,4,5 h),各组试验均重复3次,数据取平均值。
(3) 响应面法优化酶解工艺:根据单因素试验结果,使用Design-Expert V8.0.6软件进行响应面分析,以水解度指标为响应值进行Box-Behnken设计,建立三因素三水平的响应面分析试验,对显著性影响因素进行优化,筛选出最优酶解工艺条件。
(4) 水解度的测定:采用TNBS法测定蛋白质水解度。根据Adler-Nissen等[15-16]的方法,略作修改。以L-亮氨酸作标准品绘制标准曲线。取酶解上清液0.125 mL,加入1 mL pH 8.2,0.2 mol/L PBS和1 mL 0.1% TNBS,50 ℃恒温避光反应1 h,冷却至室温后加入2 mL 0.1 mol/L HCl并振荡使反应完全终止,340 nm下测定吸光值。按式(1)计算水解度[17]。
(1)
式中:
K——水解度,%;
y——亮氨酸浓度,mmol/L;
B——样品在340 nm下的吸光值;
A——去离子水在340 nm下的吸光值;
m——酶解样品的质量,g;
P——酶解样品中的蛋白质含量,g/g;
Htot——蛋白质总肽键数,7.85 mmol/g蛋白质。
1.3.3 蛋白质含量测定 按GB 5009.5—2016中的凯氏定氮法执行。
1.3.4 氨基酸组成分析 采用氨基酸自动分析仪。
1.3.5 抗炎活性评价
(1) 细胞培养:小鼠巨噬细胞RAW264.7用含10% FBS、1%双抗的DMEM培养基置于5% CO2、37 ℃细胞培养箱中培养,待细胞生长至对数生长期进行传代。当细胞铺板率大于培养瓶面积的80%时,吸尽原培养基,3 mL PBS缓冲液洗涤细胞两次,移液枪吸取培养液2 mL 吹打细胞至完全脱落,细胞计数,根据计数结果调整细胞悬液浓度,接种至孔板中,置于恒温培养箱中培养。
对细胞设计试验分组:空白组以完全培养基孵育;模型组以1 μg/mL的LPS孵育;试验组以不同浓度的待测样品加LPS(1 μg/mL)。每组设置3个复孔。
(2) MTT法测定细胞存活率:采用MTT法评估样品对细胞的毒性作用。调整细胞浓度至1×104个/mL,按每孔100 μL将细胞接种于96孔板中,培养24 h后吸尽原培养液,用PBS洗涤细胞两次,试验组分别加入含不同质量浓度的珍珠贝水解肽的完全培养基(0.125,0.25,0.5,1.0,2.0,4.0 mg/mL) 100 μL,空白组加入等量的完全培养基,每组设6个复孔,继续培养24 h后,每孔加入100 μL MTT溶液(0.5 mg/mL)并在培养箱中孵育4 h。弃去MTT溶液后用PBS洗净,每孔加入150 μL的DMSO完全溶解固体物质,震荡10 min使结晶充分溶解,使用酶标仪测定490 nm下每孔的吸光值(A),按式(2)计算细胞存活率。
(2)
式中:
S——细胞存活率,%;
A0——空白组吸光值;
A1——试验组吸光值;
A2——模型组吸光值。
(3) NO浓度测定:采用Griess法对RAW264.7细胞的NO释放量水平进行测定。调整RAW264.7细胞浓度为1×105个/mL,每孔500 μL接种至24孔板,置于培养箱孵育过夜,吸尽原培养基,空白组和模型组加入500 μL完全培养基,试验组加入500 μL含不同浓度的珍珠贝水解肽的完全培养基(0.125,0.25,0.5,1.0,2.0 mg/mL),置于培养箱中继续培养12 h后,吸尽原培养基并用PBS洗涤两次,模型组和试验组每孔加入500 μL 1 μg/mL的LPS溶液,空白组加入等量的完全培养基,继续培养24 h,收集上清液,在96孔板按50 μL/孔中加入样品上清液,各孔中分别加入50 μL Griess Reagent Ⅰ试剂和Griess Reagent Ⅱ试剂,震荡混合均匀,于450 nm测定吸光值。
(4) ELISA法测定细胞因子含量:按照ELISA测定试剂盒说明书操作,测定细胞培养上清液中的各细胞因子含量。酶标板上加入100 μL培养上清液,贴上封板膜后在37 ℃下避光孵育90 min,弃去液体,加入350 μL洗涤液,静止30 s后弃去,在吸水纸上拍干,重复5次。加入100 μL生物素抗体工作液,贴上封板膜后37 ℃避光孵育1 h,洗板5次。加入100 μL酶结合物工作液,贴上封板膜后37 ℃避光孵育30 min,洗板5次。加入100 μL显色液,37 ℃避光孵育15 min后,加入100 μL反应终止液,450 nm处测定吸光值。根据浓度和OD值算出标准曲线的回归方程,计算样品中各细胞因子含量。
1.4 数据分析
各试验进行3次平行,数据取平均值。统计分析采用SPSS 20.0软件(IBM SPSS, USA)进行单因素方差 (ANOVA)和Duncan法分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 蛋白酶的筛选
由图1可以看出,4种蛋白酶对贝肉的水解程度略有差异。由于酶的专一性,每种酶的酶切位点特定,酶解同一原料所得到的多肽,在肽序列、空间结构和分子量大小等方面具有很大差异,导致水解度也不同[18]。中性蛋白酶对马氏珠母贝肉水解程度最高,为13.09%,故选择中性蛋白酶为最适蛋白酶。
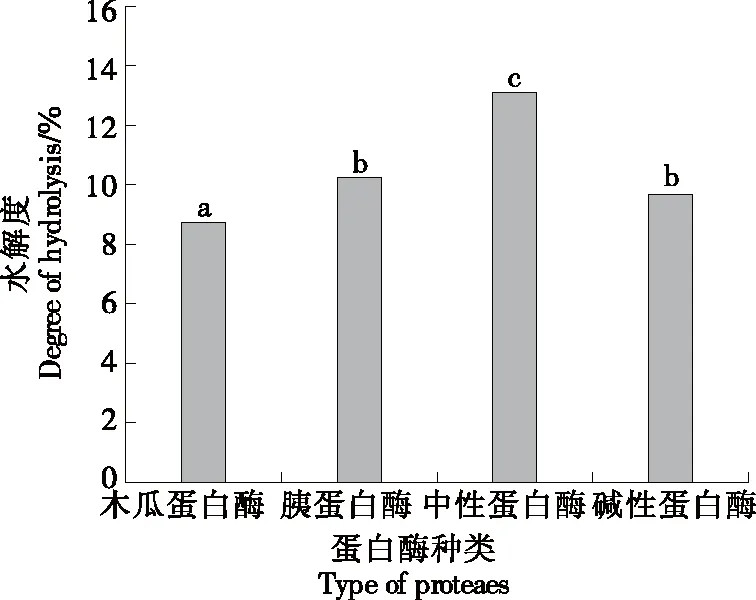
小写字母不同表示差异显著(P<0.05)
2.2 单因素试验
2.2.1 酶底比对蛋白水解度的影响 由图2可以看出,随着酶底比增大,水解度呈先增加后降低的趋势,该结果与马骏等[19]在制备啤酒抗氧化肽时的酶解效果相似,出现这种趋势可能是由于酶底比小,底物与蛋白酶不能充分结合,导致反应速度慢;随着酶底比增大,底物与酶的接触率增加,反应速度随之加快;但当酶与底物结合位点趋于饱和后,过多的酶反而会出现竞争性抑制或酶自身相互水解,导致酶活力降低,影响体系反应速度,水解度下降[20]。当酶底比为0.3%时,水解度最高为13.58%,因此最适酶底比为0.3%。

小写字母不同表示差异显著(P<0.05)
2.2.2 酶解温度对水解度的影响 由图3可以看出,随着温度的增加,水解度呈先增加后逐渐下降的趋势,当酶解温度为45 ℃时,水解度达到最大值为13.48%,酶解温度达到45 ℃后水解度呈逐渐降低的趋势。这是由于中性蛋白酶有其合适的反应温度范围,温度过高可能会影响酶的稳定性,破坏酶的特定空间结构,导致酶活性降低,酶解速度下降,进而使水解程度下降[21]。因此,选择45 ℃ 作为最适的酶解温度。
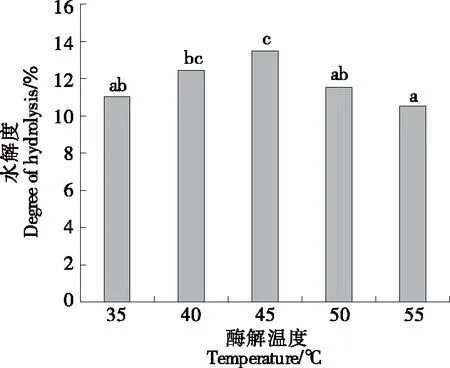
小写字母不同表示差异显著(P<0.05)
2.2.3 料液比对水解度的影响 由图4可以看出,水解度因料液比的不同而差异明显。水解度与料液比呈负相关,料液比的提高会使水解度不断下降,由于料液比增大时,酶浓度被稀释,单位体积内酶含量降低,底物与酶的结合位点变少,使酶解效果受抑制[22],同时随着料液比的提高,单位体积内酶解出来的多肽浓度降低,从而导致水解度下降。当料液比为1∶1 (g/mL)时,水解度最高,为16.15%。因此,选择1∶1 (g/mL)为最适料液比。
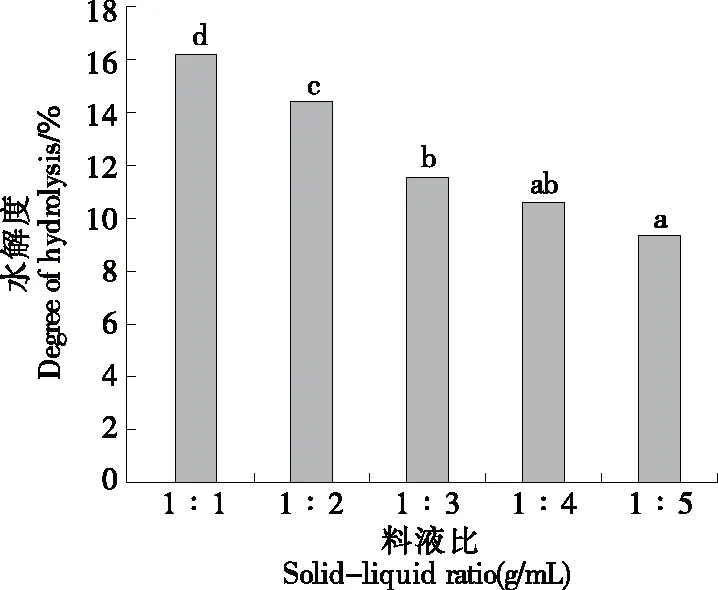
小写字母不同表示差异显著(P<0.05)
2.2.4 酶解时间对水解度的影响 由图5可以看出,水解度随着酶解时间的延长呈先增加后逐渐平缓的趋势,与刘东伟等[23]和张维等[24]的研究结果一致,酶解时间在1~2 h时对水解度的影响较为显著,之后保持稳定。这是因为酶解前期随着酶解时间的增加,酶更容易与底物接触,水解度快速增长,一定时间后,随着底物浓度的降低,可水解的特定部位也随之减少,水解度的增幅也随之降低[25]。因此,选择2 h为最适酶解时间。
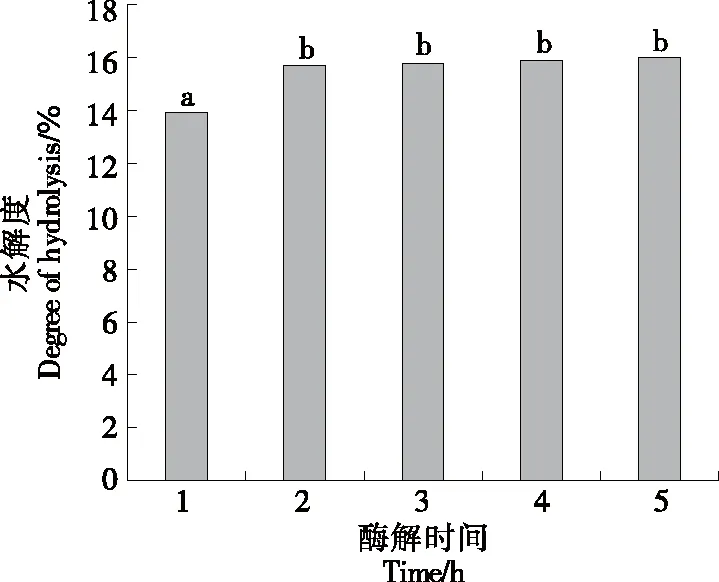
小写字母不同表示差异显著(P<0.05)
2.3 响应面试验
2.3.1 模型建立与显著性检验 在单因素试验结果的基础上,选取酶底比、酶解温度、酶解时间进行三因素三水平的响应面优化试验。响应面试验设计见表2。以水解度为响应值,酶底比、酶解温度、酶解时间为自变量,分析马氏珠母贝肉酶解的最优工艺指标。试验结果见表3。
表2 响应面试验设计
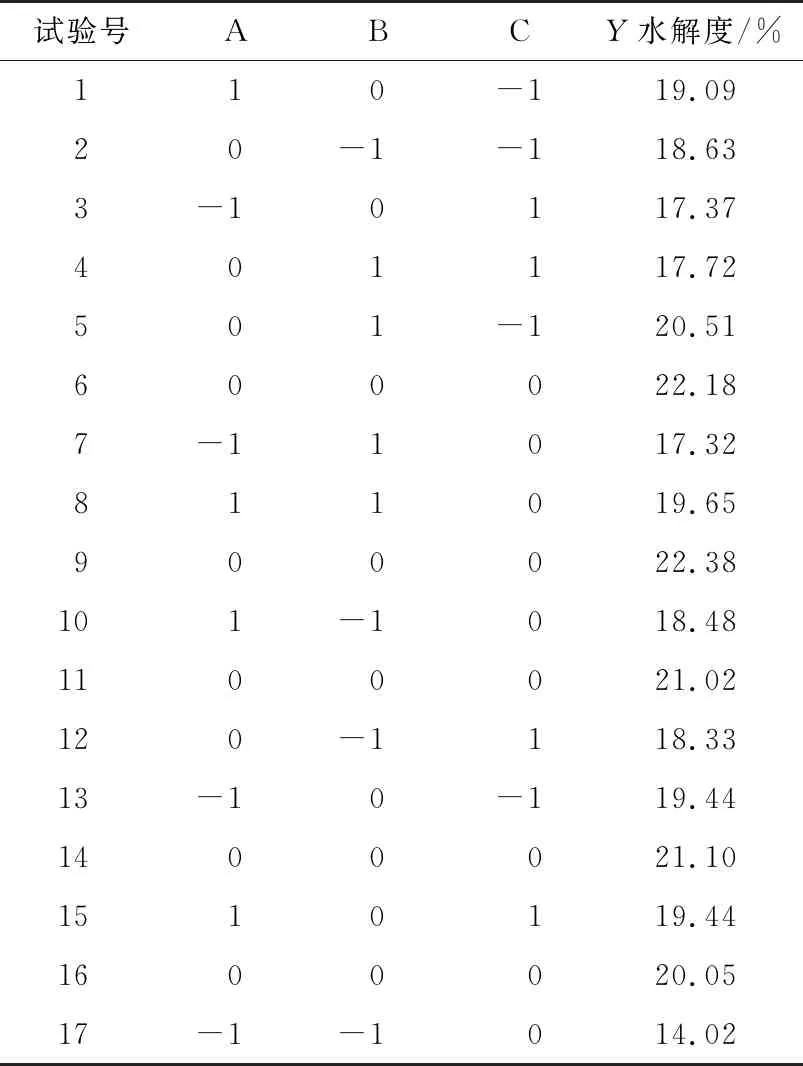
表3 响应面试验结果
对表3数据进行回归拟合,从而得到3个因素的二次多项回归模型为:
Y=21.36+1.06A+0.72B-0.60C-0.53AB+0.61AC-0.62BC-1.98A2-2.02B2-0.55C2。
(3)
为检验该回归方程的有效性,对其进行显著性分析,结果见表4。
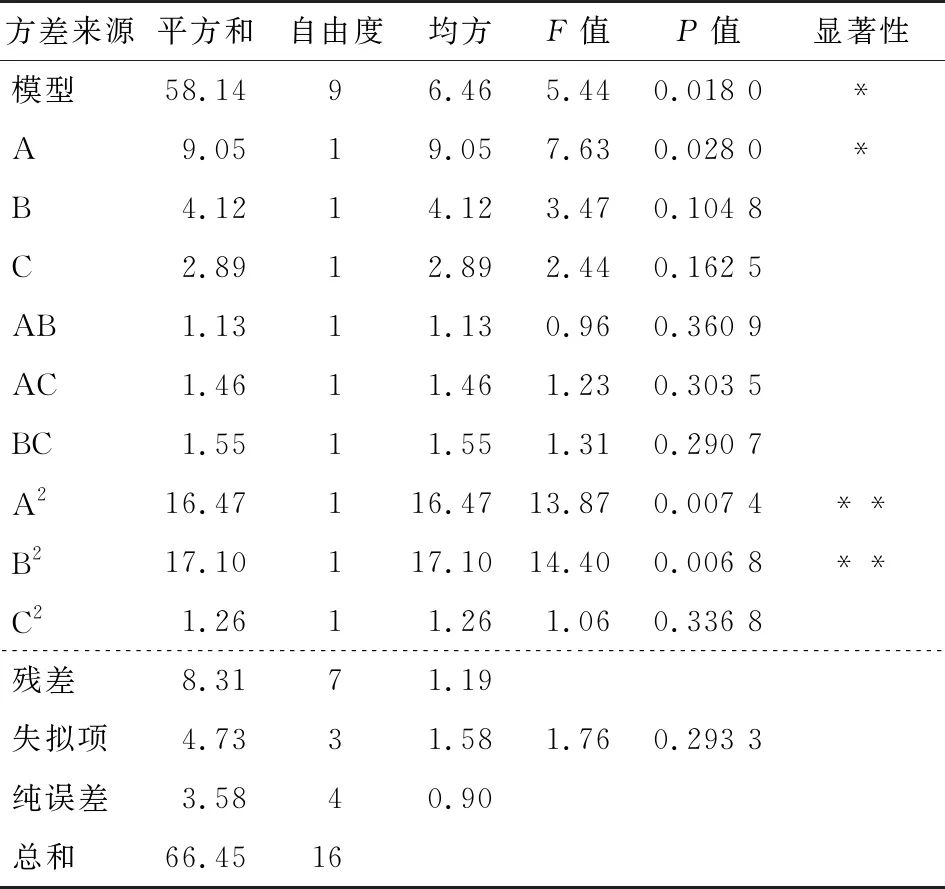
表4 回归模型及方差分析†
由表4可知,回归模型P<0.05,说明试验数据与模型相符;失拟项对应的P=0.293 3>0.05,表明所得方程与实际拟合中非正常误差所占比例较小,方程可行。通过对回归方程的显著性分析可以看出,A对响应值影响显著(P<0.05),A2和B2对响应值的影响极显著(P<0.01),由此可知试验因子对响应值不是简单的线性关系,并且酶底比对水解度有极显著影响。
2.3.2 响应面交互作用分析 从图6可以看出,酶底比和酶解温度曲面坡度较大,酶解温度在40~46 ℃时及酶底比在0.2%~0.3%时坡度更陡,之后趋于平缓,说明酶解温度的二次项和酶底比的二次项对水解度的影响显著。酶解时间和酶底比、酶解时间和酶解温度曲面均有一定的坡度,但酶解时间曲面坡度趋于平缓,说明酶底比和酶解温度对水解度的影响较大,酶解时间对水解度的影响较小。
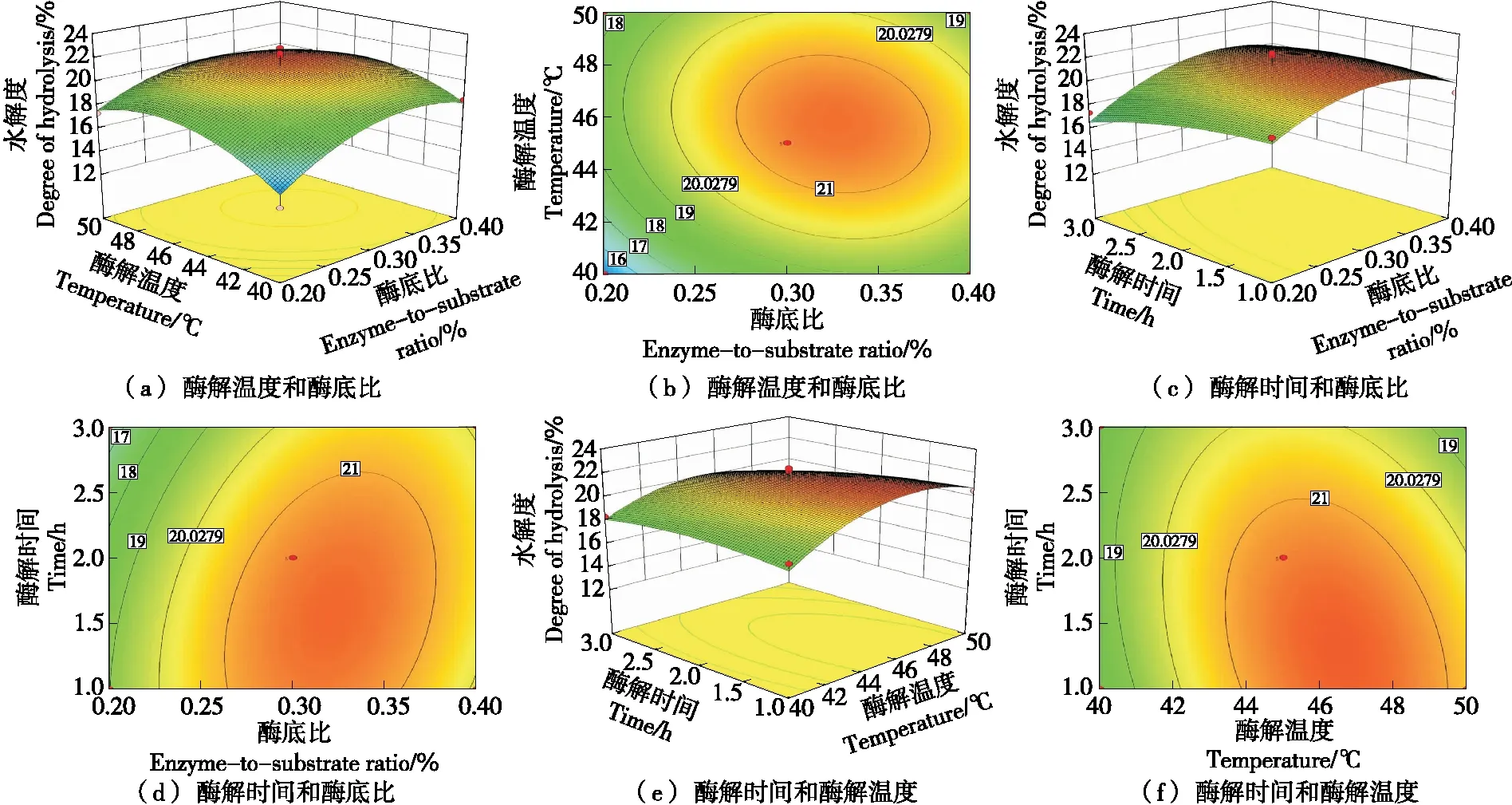
图6 各因素之间交互作用的响应曲面图Figure 6 Response surface diagrams for interaction of various factors
2.3.3 验证实验 经Design-Expert V8.06软件分析得到的最佳酶解条件为酶底比0.32%、酶解时间1.38 h、酶解温度46.27 ℃,在此条件下,水解度预测值为21.71%。为了验证响应面法的可行性,采用得到的最优酶解条件进行验证实验,同时考虑到实际因素,修正工艺参数为:酶底比0.32%、酶解时间1.4 h、酶解温度46.3 ℃,进行3次重复实验得到的水解度为(22.88±0.90)%,与预测值无显著性差异。因此,通过响应面法优化提取珍珠贝水解肽的酶解条件是可行的,回归模型较可靠。
2.4 氨基酸组成分析
如表5所示,酶解物中氨基酸种类齐全,必需氨基酸(EAA)含量为19.84%。活性肽的功能活性与其特殊的氨基酸以及排列顺序有关,具有抗炎活性的肽富含疏水性和带正电的氨基酸,尤其是在N端或C端,其中疏水性高的氨基酸可促进多肽与细胞膜之间的相互作用,并起到调节信号通路的作用,使多肽更容易进入靶细胞发挥抗炎细胞活性,带正电荷的氨基酸也与抗炎活性有关[26]。在珍珠贝水解肽中,有助提高抗炎能力的氨基酸包括疏水性氨基酸(21.19%)和带正电荷氨基酸(10.45%),占比34.65%,从物质基础层面表明珍珠贝水解肽可能具有抗炎方面的潜力。
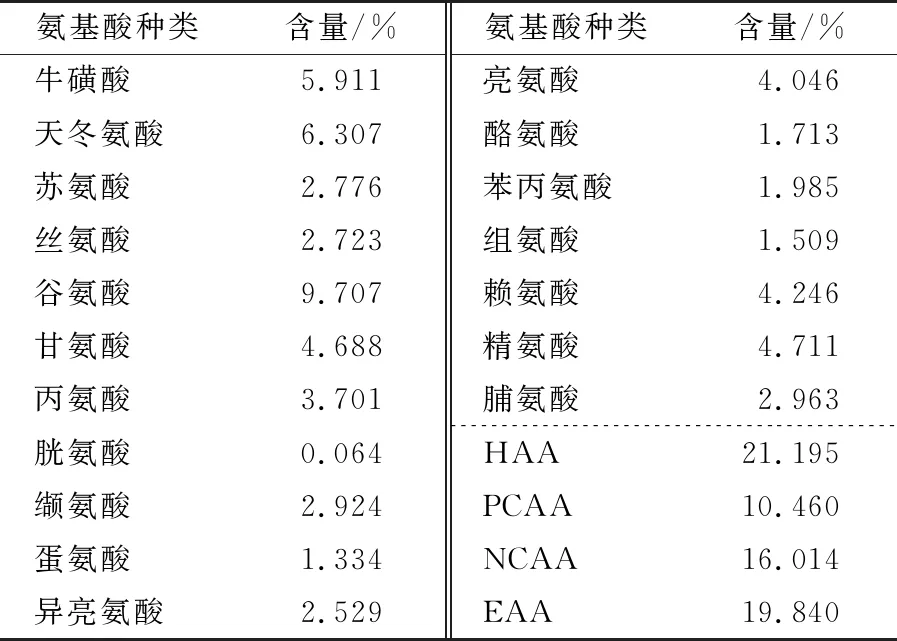
表5 氨基酸组成分析†
2.5 珍珠贝水解肽抗炎活性
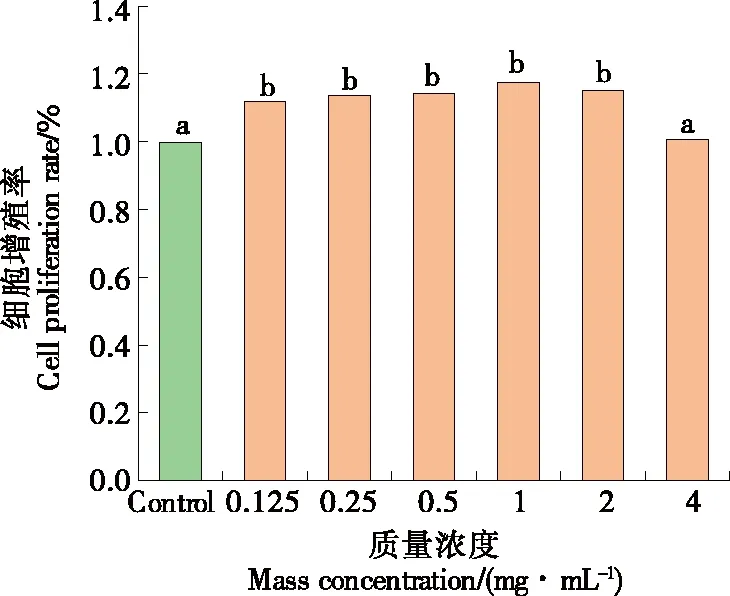
2.5.1 对小鼠巨噬细胞的毒性 如图7所示,在0.125~4.0 mg/mL 的质量浓度范围内各样品均对RAW264.7细胞无细胞毒性,且在0.125~2.0 mg/mL浓度范围内对细胞生长有促进作用。
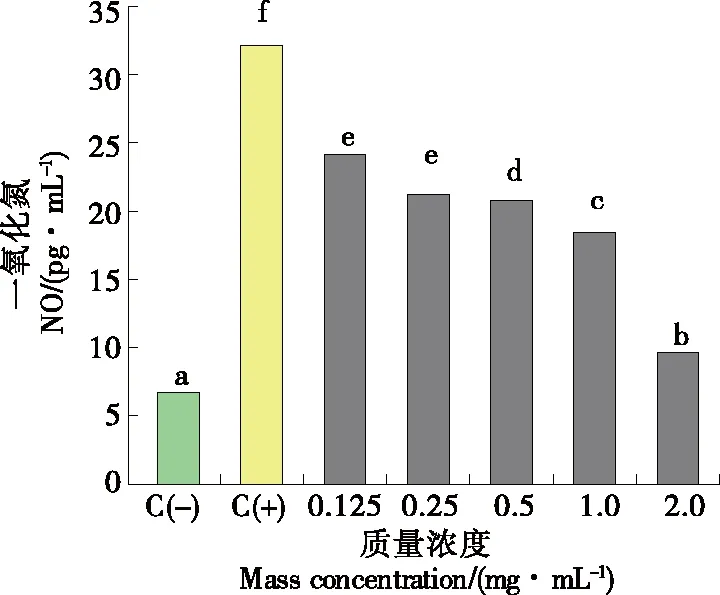
2.5.2 对LPS诱导的RAW264.7细胞NO释放量的影响 如图8所示,与空白组(C-)比较,LPS模型组(C+)的NO分泌显著升高,表明抗炎细胞模型造模成功。与LPS模型组(C+)相比,添加不同质量浓度珍珠贝水解肽处理组均能显著降低造模细胞上清液中NO含量,且呈浓度依赖性,其中最高质量浓度(2.0 mg/mL)处理组NO抑制率达70.00%。由此表明,珍珠贝水解肽可以有效降低炎症细胞模型中的NO分泌,表现出显著的抗炎活性。
2.5.3 对小鼠巨噬细胞RAW264.7炎症因子分泌的影响
炎症细胞因子是炎症反应的关键因素。当病原体感染机体时,巨噬细胞可以通过产生细胞因子来抵抗病原体的入侵。在某种程度上,细胞免疫因子的水平可用于评估免疫反应[27]。
小写字母不同表示差异显著(P<0.05)
如图9所示,与空白组(C-)相比,使用LPS诱导后的模型组(C+)细胞炎症因子TNF-α、IL-6和IL-1β分泌显著上升,而使用不同多肽浓度处理组(0.125~2.0 mg/mL)干预的巨噬细胞产生的细胞炎症因子分泌均被有效抑制,且均呈浓度依赖性,与NO释放量的结果趋势一致。其中最高质量浓度(2.0 mg/mL)处理组能够显著抑制RAW264.7巨噬细胞因子TNF-α、IL-6和IL-10的释放,抑制率分别为83.01%,85.04%,80.43%,由此表明,珍珠贝水解肽能有效降低由LPS刺激的RAW264.7细胞炎症因子的分泌。
3 结论
以马氏珠母贝肉为原料,以水解度为指标筛选出中性蛋白酶为最佳用酶;基于单因素结果结合响应面优化确定了最优工艺参数:酶解时间1.4 h,酶底比0.3%,酶解温度46.3 ℃。在此基础上得到的酶解物氨基酸种类齐全,其中必需氨基酸含量为19.84%,有助于提高抗炎活性的氨基酸(疏水性氨基酸和带正电荷氨基酸)占比达31.65%。通过对珍珠贝水解肽的体外细胞炎症评价模型发现,珍珠贝水解肽能够有效降低由LPS诱导的RAW264.7巨噬细胞的NO和细胞炎症因子TNF-α、IL-6和IL-1β分泌量,表明珍珠贝水解肽具有良好的抗炎活性。后续将对珍珠贝抗炎肽的活性成分及其抗炎机制进行深入研究。
小写字母不同表示差异显著(P<0.05)
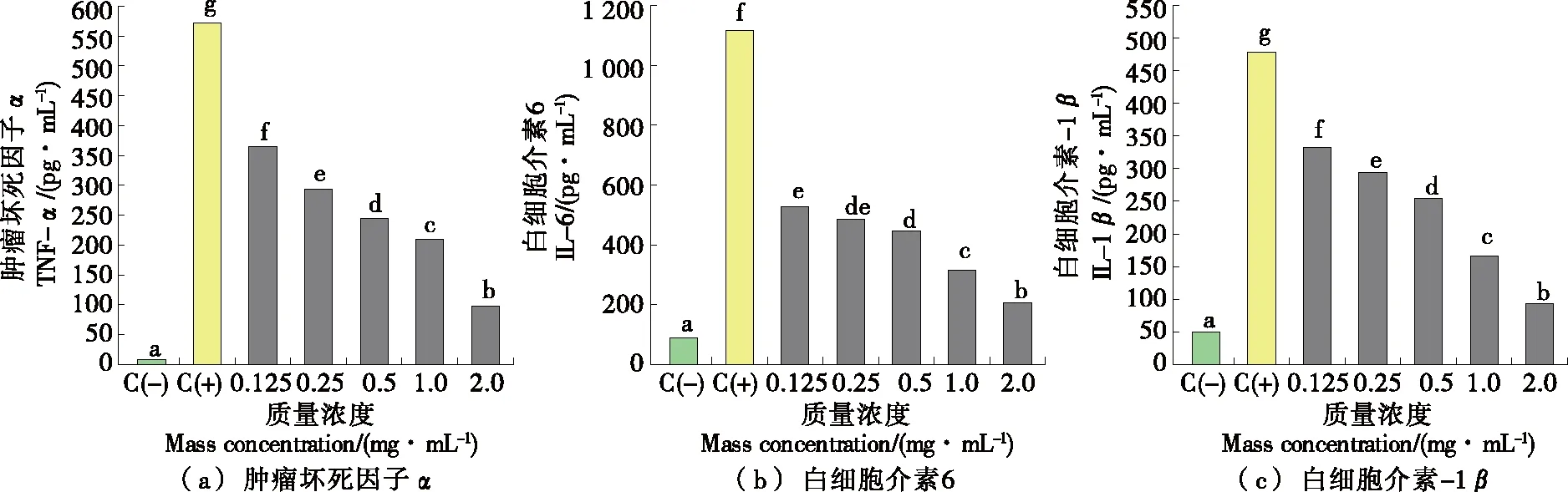
小写字母不同表示差异显著(P<0.05)
