例谈“新高考”中如何解答化学实验探究题
2023-03-18正高级教师
汤 伟(正高级教师)
(安徽省灵璧中学)
通过调研,我们发现很多考生对“新高考”背景下化学实验探究题的解答思路不够清晰,面对试题提供的情境,不知如何探究分析.下面以2022年“新高考”化学实验探究试题为例,进行分析说明.
1 如何探究物质的性质
该类高考试题的命制特点常常根据物质的分类、化合价的高低、组成元素、分子结构特点等进行预测或猜想可能有的性质,然后选择特定试剂进行实验探究,解答过程中常常会出现超出教材所学范围的情况,即出现一些教材讲述内容之外的反应,我们需要根据所学化学原理进行推理探究.解答该类试题的基本思路如图1所示.

图1
例1(2022年北京卷)某小组同学探究不同条件下氯气与二价锰化合物的反应.
资料:ⅰ.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色).
ⅲ.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱.
实验装置如图2所示(夹持装置略).

图2
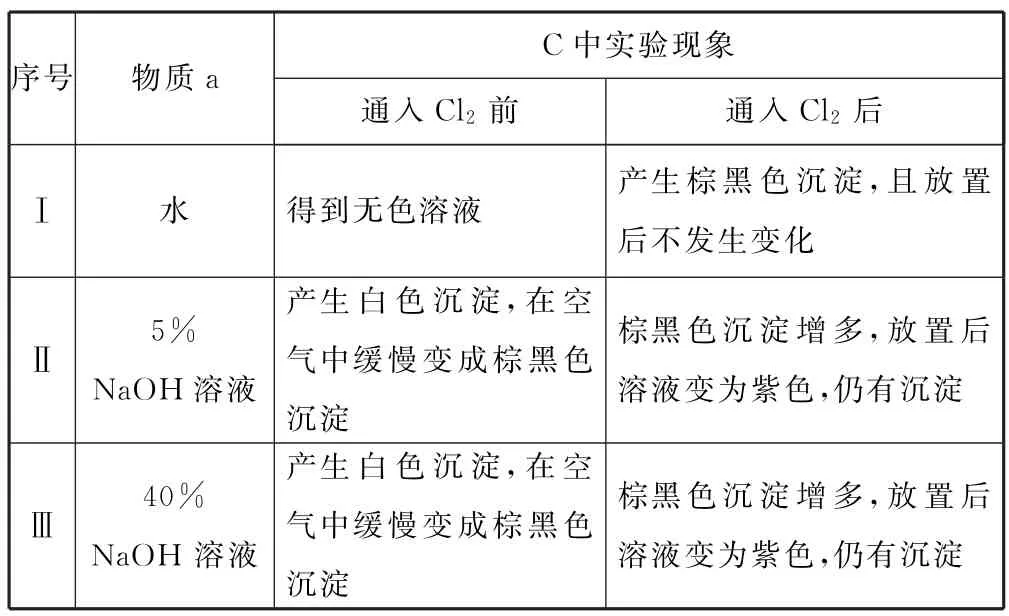
表1
(1)B中试剂是________.
(2)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为________.
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是________.
(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因.
原因一:可能是通入Cl2导致溶液的碱性减弱.
①用化学方程式表示可能导致溶液碱性减弱的原因:_________,但通过实验测定溶液的碱性变化很小.
②取Ⅲ中放置后的1 mL 悬浊液,加入4mL 40%NaOH 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深.溶液紫色变为绿色的离子方程式为_________,溶液绿色缓慢加深,原因是MnO2被_________(填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量.
③取Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生的反应是_________.
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_______.
分析该实验探究的目的是“探究不同条件下氯气与二价锰化合物的反应”,装置C 是完成该实验目的的主要装置图.试题以“不同条件下氯气与二价锰化合物的反应”为情境,注重考查物质性质的实验探究.(1)根据装置图及物质性质特点,容易得出装置A 中HCl与KMnO4发生反应制取Cl2,由于盐酸具有挥发性,为排除HCl对溶液酸碱性的影响,在装置B 中盛放饱和NaCl溶液,除去Cl2中的杂质HCl.(2)通入Cl2前,Ⅱ、Ⅲ中Mn2+与NaOH 电离产生的OH-反应容易产生Mn(OH)2白色沉淀,该沉淀又会被溶解在溶液中的氧气氧化为棕黑色MnO2,所以通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为2Mn(OH)2+O2=2MnO2+2H2O.(3)根据试题提供的资料“Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)”以及对比实验Ⅰ、Ⅱ所提供的信息,可以得出二价锰化合物在中性水溶液中被氧化为MnO2,而添加烧碱后,即在碱性条件下可以被氧化为紫色的.(4)①Cl2通入NaOH 溶液中可以与之反应,可能会使溶液的碱性减弱,反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O;②实验Ⅲ的悬浊液中加入4mL40% NaOH 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深,说明在浓碱条件下,被还原为,该离子方程式为;根据试题提供的资料“Cl2的氧化性与溶液的酸碱性无关,NaClO 的氧化性随碱性增强而减弱”可以推理得出溶液绿色缓慢加深,原因是MnO2被氧化,此时氧化剂应该是NaClO;③根据上述分析,可以得出Ⅱ中放置后的1mL悬浊液,加入4 mL 水,溶液紫色缓慢加深,发生的反应为④实验Ⅲ未得到绿色溶液,从反应速率的角度分析,可以得出反应过程中生成的速率明显要快于生成的速率,以致于实验中难以观察到绿色溶液,由此推理可以得出答案.
答案(1)饱和NaCl溶液.
(2)2Mn(OH)2+O2=2MnO2+2H2O.
(3)二价锰化合物在中性或弱酸性条件下只能被氧化为MnO2,在碱性条件下可以被氧化到更高价态.
(4)①Cl2+2NaOH=NaCl+NaClO+H2O.
③3ClO-+2MnO2+2OH-=2+3Cl-+H2O.
④溶液中存在反应:
在碱性条件下,c(OH-)和c(ClO-)均很大时,反应ⅱ的速度快于反应ⅰ.
2 如何控制变量,探究反应条件对实验的影响
控制变量,探究反应条件对实验的影响是新课标、新高考背景下考查的热点题型之一,影响反应的外界因素有很多时,我们在设计实验探究时需要控制其他因素相同或不变,再进行实验,即控制变量思想的应用.解答该类试题的基本思路如图3所示.

图3
在明确实验目的,确立具体探究问题的前提下,解答该类问题需要把握如下关键点.
1)确定变量:首先要认真审题,厘清影响实验探究结果的因素有哪些.
2)定多变一:在探究时,先确定其他因素不变,只改变一种因素,看这种因素与探究的问题存在怎样的关系;然后通过分析每种因素与所探究问题之间的关系,得出所有影响因素与所探究问题之间的关系.
3)数据有效:解答时注意选择数据(或设置实验)要有效,且变量统一,否则无法作出正确判断.
例2(2022年广东卷)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示).HAc的应用与其电离平衡密切相关.25 ℃时,HAc 的Ka=1.75×10-5=10-4.76.
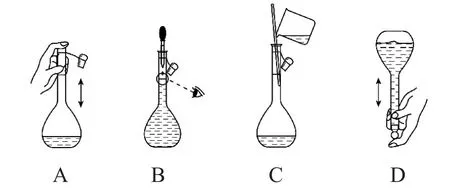
(1)配制250 mL0.1 mol·L-1的HAc溶液,需5mol·L-1HAc溶液的体积为_________mL.(2)下列关于250 mL 容量瓶的操作,正确的是_______.
(3)某小组研究25 ℃下HAc电离平衡的影响因素.
提出假设:稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动.
设计方案并完成实验:用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按表2配制总体积相同的系列溶液,测定pH,记录数据.

表2
①根据表中信息,补充数据:a=_________,b=_______.
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡_________(填“正”或“逆”)向移动;结合表中数据,给出判断理由:________.
③由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动.
实验结论:假设成立.
(4)该小组成员分析上表数据发现:随着n(NaAc)∶n(HAc)的增加,c(H+)的值逐渐接近HAc的Ka.
查阅资料获悉:一定条件下,按n(NaAc)∶n(HAc)=1 配制的溶液中,c(H+)的值等于HAc的Ka.
对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证.
①移取20.00 mL HAc溶液,加入2 滴酚酞溶液,用0.1000 mol·L-1NaOH 溶液滴定至终点,消耗体积为22.08 mL,则该HAc 溶液的浓度为________mol·L-1.画出上述过程的滴定曲线示意图并标注滴定终点.
②用上述HAc溶液和0.1000mol·L-1NaOH溶液配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符.
(5)小组成员进一步提出:如果只有浓度均约为0.1mol·L-1的HAc 和NaOH 溶液,如何准确测定HAc的Ka.小组同学设计方案并进行实验.请完成下面Ⅱ中的内容.
Ⅰ.移取20.00mL HAc溶液,用NaOH 溶液滴定至终点,消耗NaOH 溶液V1mL.
Ⅱ._______,测得溶液的pH 为4.76.
实验总结:得到的结果与资料数据相符,方案可行.
(6)根据Ka可以判断弱酸的酸性强弱.写出一种无机弱酸及其用途:_______.
分析该试题不仅考查了化学实验中的一些基本操作(如一定物质的量浓度溶液的配制、酸碱中和滴定),还通过问题(3)考查了控制变量思想,即反应条件探究类实验问题.
(1)根据溶液稀释过程中,溶质的物质的量守恒,可以得出250mL×0.1mol·L-1=V×5mol·L-1,解得V=5.0mL,即所需醋酸溶液的体积为5.0mL.
(2)根据一定物质的量浓度的溶液配制的实验操作,可以得出:图示A 中,用手触碰瓶口,会污染试剂及对皮肤造成伤害;图示B中,定容时,需平视而不能够仰视或俯视;图示D 中,定容后的操作应该是盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,右手扶住容量瓶底部.由此得出图示C正确.
(3)①实验Ⅶ的溶液中n(NaAc)∶n(HAc)=3∶4,V(HAc)=4.00mL,因此V(NaAc)=3.00mL,即a=3.00,由实验Ⅰ可知,溶液最终的体积为40.00mL,因此V(H2O)=40.00 mL-4.00 mL-3.00mL=33.00mL,即b=33.00;②实验Ⅰ所得溶液的pH=2.86,实验Ⅱ的溶液中c(HAc)为实验Ⅰ的1/10,稀释过程中,若不考虑电离平衡移动,则实验Ⅱ所得溶液的pH=2.86+1=3.86,但实际溶液的pH=3.36<3.86,说明稀释过程中,溶液中c(H+)增大,即电离平衡正向移动.
(4)①根据滴定发生的中和反应:
可以得出滴定至终点时,n(HAc)=n(NaOH),由此推理、计算可得c(HAc)=0.1104 mol·L-1;滴定过程中,当,溶液的pH=2.88,当V(NaOH)=11.04mL 时,n(NaAc)=n(HAc),溶液的pH=4.76,当V(NaOH)=22.08mL时,达到滴定终点,溶液中溶质为NaAc,Ac-发生水解,溶液呈弱碱性,当NaOH 溶液过量较多时,c(NaOH)无限接近0.1 mol·L-1,溶液的pH 接近13,因此滴定曲线如图4所示.
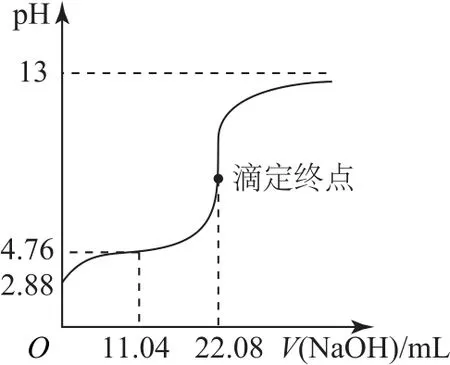
图4
(5)向20.00 mL 的HAc 溶液中加入V1mL NaOH 溶液达到滴定终点,滴定终点的溶液中溶质为NaAc,当n(NaAc)∶n(HAc)=1时,溶液中c(H+)的值等于HAc的Ka,因此另取20.00 mL HAc,加入mLNaOH 溶液,能够使溶液中
(6)不同的无机弱酸在生活中应用广泛,如HClO具有强氧化性,可用于漂白和消毒,H2SO3具有还原性,可用作还原剂,在葡萄酒中添加适量H2SO3可用作防腐剂.
答案(1)5.0.
(2)C.
(3)①3.00;33.00;②正;实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH 增大值小于1.
(4)0.1104;如图4.
(5)另取20.00 mL HAc,加入mL NaOH溶液.
(6)HClO;作漂白剂或消毒液(或H2SO3;作还原剂、防腐剂).
(完)
