三维适形和调强放射治疗在食管癌术后患者辅助治疗中的应用效果
2023-03-18余育贤张龙泉朱明阳李晓林通信作者
余育贤,张龙泉,朱明阳,李晓林(通信作者)
福建医科大学附属漳州市医院 (福建漳州 363000)
食管癌是一类原发于食管的消化系统恶性肿瘤。临床针对已明显侵犯至固有肌层的食管癌常采取根治手术治疗,以清除肿瘤,但单纯行根治手术治疗的效果有待进一步加强。有研究显示,术后未接受辅助治疗是影响患者总生存时间的独立危险因素,且Ⅱb ~Ⅲ期患者术后配合预防性照射的预后较好[1]。因此,食管癌术后配合放射治疗作为辅助治疗手段,对于降低肿瘤局部复发率、提高患者生存率均有积极意义。放射治疗属于放射性疗法,应用于食管癌患者术后辅助治疗时,虽可借助射线破坏癌细胞的DNA 结构,达到阻止癌细胞继续生长的目的,但其具有较强的不良作用,故应科学有效地控制放射剂量,以减轻对周围器官的损伤[2]。三维适形放射治疗(3-dimensional conformal radiation therapy,3D-CRT)靶区内剂量的均匀性一般,无法对不同靶区的剂量进行调制,忽视了照射野附近正常器官受影响的可能性;相较于3D-CRT,调强放射治疗(intensity modulated radiotherapy,IMRT)对照射野放射剂量的控制较为精确,针对性治疗作用较显著,可通过调整放射剂量来控制放射治疗对周围危及器官的不利影响[3]。基于此,本研究旨在探讨3D-CRT 和IMRT 在食管癌术后患者辅助治疗中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2020 年3 月至2022 年2 月于福建医科大学附属漳州市医院行手术治疗的70 例食管癌患者的临床资料,按照放射治疗方式分组,35 例患者术后采用3D-CRT 治疗(3D-CRT 组),另外35 例患者术后采用IMRT 治疗(IMRT 组)。3D-CRT组男21 例,女14 例;年龄56~72 岁,平均(64.49±4.08)岁;临床分期:Ⅰ期19 例,Ⅱ期16 例;癌症类型:鳞癌33 例,腺癌2 例。IMRT 组男20 例,女15 例;年龄53~75 岁,平均(64.73±4.13)岁;临床分期:Ⅰ期18 例,Ⅱ期17 例;癌症类型:鳞癌34 例,腺癌1 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。
纳入标准:符合2020 年中国临床肿瘤学会《食管癌诊疗指南》[4]中食管鳞癌及腺癌的相关诊断标准;具备手术治疗指征,癌变区淋巴结转移数量<6 个,周围器官组织功能正常。排除标准:癌变组织发生肝转移、骨转移等远处转移;存在食管穿孔、大出血、足量放射治疗后复发史;卡氏功能状态评分<60 分;存在恶液质等放射治疗禁忌证。
1.2 方法
1.2.1 CT 模拟定位及治疗靶区勾画
患者取仰卧位,用热塑成型体膜或头颈肩大面罩固定;待患者呼吸频率趋于平稳后,使用64 层螺旋CT 模拟定位机(PHILIPS,型号Brilliance CT BigBore)行连续增强扫描,设定层厚为5 mm;扫描完成后,将扫描图像上传至治疗计划系统,结合断层扫描图像及术前影像勾画临床靶区(clinical target volume,CTV),确保食管吻合口及淋巴结引流区均包含在CTV 内;CTV 前后左右各外放0.6~0.8 cm,头脚方向外放0.8~1.0 cm,形成计划靶区(planing target volume,PTV)。
1.2.2 放射治疗计划设计
将3D-CRT 照射野设定为前后野与两斜野,结合CTV 图像合理调整入射角度与射野剂量;IMRT 照射野设计尽量避开心脏、肺、脊髓、气管等危及器官,设定100%等剂量曲线,应包括95% PTV 体积;将PTV 接受110%处方剂量的总体积控制在10%以下,接受<93%处方剂量的总体积控制在3%以下,除PTV 外,其余照射区域处方剂量均≤110%;针对食管周围危及器官,心脏V30限量40%,肺部V20限量30%,V30限量20%,脊髓最大处方剂量≤45 Gy。
1.2.3 治疗方案
3D-CRT 治疗:首先勾画靶区、设置照射剂量,然后使用6 MV X 线行3D-CRT,1.8~2.0 Gy/次,1 次/d,每周进行5 次,总照射剂量50~66 Gy,持续治疗35~46 d。
IMRT 治疗:首先勾画靶区GTV 和CTV,在靶区GTV 和CTV 的基础上,前后左右外放0.5 cm,头脚外放0.8 cm,形成计划靶区GTV 和CTV,设置照射剂量,给予5~7 野照射;明确照射剂量及范围后,应用6 MV X 线进行IMRT,1.8~2.0 Gy/次,1 次/d,每周进行5 次,总照射剂量约为60 Gy,PTV 总照射剂量约为50~66 Gy,持续治疗35~46 d。
1.3 评价指标
(1)参考剂量体积直方图(dose volume histogram,DVH)参数,比较两组的靶区剂量学参数,包括PTV 百分比(V100%)、靶区适形性指数(conformity index,CI)、 剂 量 均 匀 性 指 数(homogeneity index,HI)。(2)比较两组的心脏、肺、脊髓及气管等危及器官参数,包括心脏平均剂量Dmean,肺平均剂量Dmean,脊髓、气管的平均剂量Dmean及最大剂量Dmax。(3)比较两组的不良反应发生情况,包括心脏损伤、放射性肺炎、胃肠道反应。(4)比较两组1 年内无进展生存率(progression-free survival,PFS),瘤体最大径×最大垂直径与治疗首日相比增大≥25%或出现新发病灶视为进展,1 年内未出现此情况视为无进展生存。
1.4 统计学处理
采用SPSS 22.0 统计软件进行数据分析,计量资料以±s表示,采用t检验,计数资料以率表示,理论频数<5 采用连续性校正χ2检验,理论频数≥5 采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组靶区剂量学参数比较
3D-CRT 组的V100%低于IMRT 组,CI、HI 高于IMRT 组,差异均有统计学意义(P<0.05),见表1。
表1 两组靶区剂量学参数比较(±s)
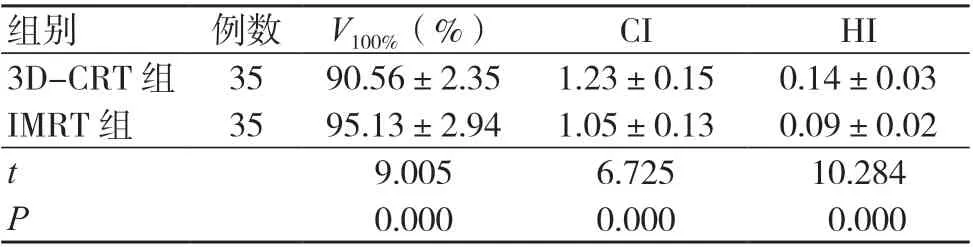
表1 两组靶区剂量学参数比较(±s)
注:3D-CRT 为三维适形放射治疗,IMRT 为调强放射治疗,V100%为计划靶区百分比,CI 为靶区适形性指数,HI 为剂量均匀性指数
组别 例数 V100%(%) CI HI 3D-CRT 组 35 90.56±2.35 1.23±0.15 0.14±0.03 IMRT 组 35 95.13±2.94 1.05±0.13 0.09±0.02 t 9.005 6.725 10.284 P 0.000 0.000 0.000
2.2 两组危及器官参数比较
3D-CRT 组的心脏Dmean、肺Dmean均高于IMRT 组,差异有统计学意义(P<0.05);两组脊髓、气管的受照射剂量比较,差异无统计学意义(P>0.05),见表2。
表2 两组危及器官参数比较(Gy,±s)
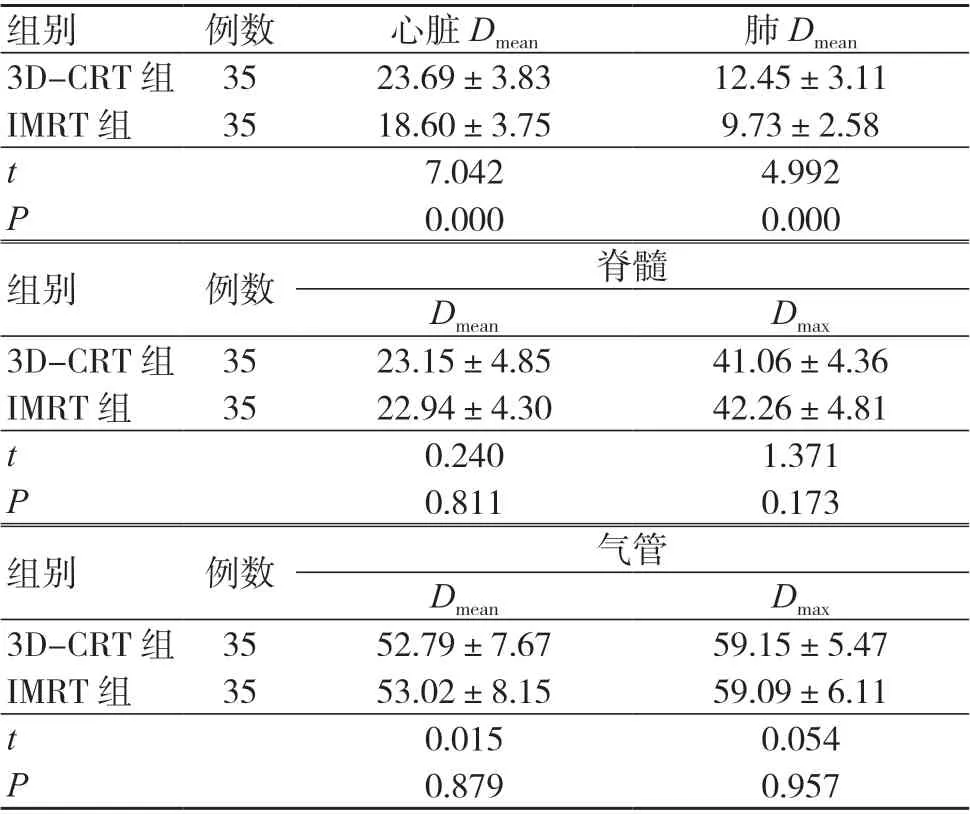
表2 两组危及器官参数比较(Gy,±s)
注:3D-CRT 为三维适形放射治疗,IMRT 为调强放射治疗
组别 例数 心脏Dmean 肺Dmean 3D-CRT 组 35 23.69±3.83 12.45±3.11 IMRT 组 35 18.60±3.75 9.73±2.58 t 7.042 4.992 P 0.000 0.000组别 例数 脊髓Dmean Dmax 3D-CRT 组 35 23.15±4.85 41.06±4.36 IMRT 组 35 22.94±4.30 42.26±4.81 t 0.240 1.371 P 0.811 0.173组别 例数 气管Dmean Dmax 3D-CRT 组 35 52.79±7.67 59.15±5.47 IMRT 组 35 53.02±8.15 59.09±6.11 t 0.015 0.054 P 0.879 0.957
2.3 两组不良反应发生率比较
3D-CRT组的不良反应总发生率高于IMRT组,差异有统计学意义(P<0.05),见表3。
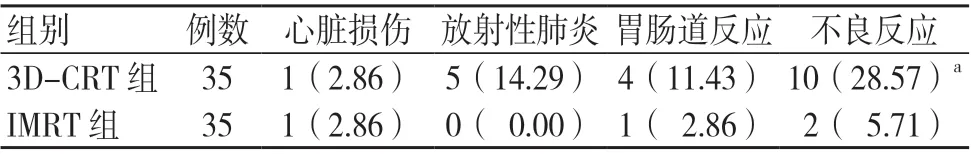
表3 两组不良反应发生率比较[例(%)]
2.4 两组1年内PFS 比较
3D-CRT 组1 年 内PFS 为82.86%(29/35),IMRT 组为91.43%(32/35),差异无统计学意义(χ2=1.148,P=0.284)。
3 讨论
食管癌是一种预后不够理想的消化系统恶性肿瘤,目前以根治性切除术为主要治疗方法,旨在延长患者术后生存时间,防止癌细胞扩散、转移。为进一步增强疗效,临床常在食管癌患者术后配合辅助治疗,以降低肿瘤复发的可能性[5]。放射治疗作为食管癌术后重要的辅助治疗方式,可利用放射线照射杀灭目标范围内的肿瘤细胞;但在此过程中,癌变区域附近的正常组织不可避免地会被纳入放射治疗范围,而高能X 线可能导致周围器官组织的功能受到不利影响,甚至可能产生不良反应[6]。因此,为减少放射性损伤的影响,食管癌患者术后配合放射治疗时应当确定科学的照射范围,以免损伤靶区附近的正常组织。
食管的解剖结构较为特殊,与心脏、肺、脊髓等重要器官相邻。3D-CRT 对靶区范围内和靶区附近采取的照射剂量相同,可能导致部分无肿瘤细胞分布区域的组织受到照射,同时影响对目标靶区内肿瘤细胞的杀灭效果。本研究结果显示,3D-CRT组V100%低于IMRT 组,CI、HI 高于IMRT 组,差异均有统计学意义(P<0.05),说明IMRT 的靶区剂量适形度及放射剂量均匀性均优于3D-CRT。其原因在于,IMRT 能更好地区分正常组织与计划靶区,精确调整放射剂量,利用致死剂量的射线杀灭肿瘤细胞,并可减少对周围正常组织的损害[7-9]。这一优势为临床基于肿瘤区位置及食管与周围正常器官的解剖结构来调节放射剂量奠定了良好的基础。
合理利用IMRT 来调节不同区域照射野的放射剂量,能够针对较复杂的食管癌术后靶区进行治疗,不易受到正常组织限值的影响,可最大限度控制放射剂量对周围危及器官的影响。本研究结果显示,3D-CRT 组的心脏Dmean、肺Dmean均高于IMRT 组,差异有统计学意义(P<0.05);两组脊髓、气管的受照射剂量比较,差异无统计学意义(P>0.05);可见IMRT 可有效降低心脏、肺的受照射剂量,且在控制脊髓、气管等器官放射剂量方面的作用与3D-CRT 相当。本研究结果与张磊等[10]的研究结果相近,进一步说明两种放射治疗模式虽均能运用三维立体成像技术重建食管癌术后病变区域组织结构,但3D-CRT 未能根据肿瘤分布情况对不同区域的放射剂量进行调节,可导致放射治疗照射剂量的分布特征未与食管癌术后靶区形态保持高度一致性;相较于3D-CRT,IMRT 可围绕肿瘤所在位置精准、科学地划分照射野,从而满足对应区域肿瘤致死剂量的要求,并可对各照射野内的输出剂量进行合理控制,考量食管癌术后靶区形状复杂这一特征,减弱瘤体周围危及器官的受照射剂量[11-12],进而可降低放射性损伤引发骨髓抑制的可能性,有利于维持正常组织微循环的稳定性,防止周围心肺系统、细胞代谢机制受累而出现异常症状,有利于控制危及器官受累。
此外,本研究结果显示,3D-CRT 组的不良反应总发生率高于IMRT 组,差异有统计学意义(P<0.05),表明IMRT 的不良反应控制效果优于3D-CRT。这可能与IMRT 的靶区覆盖率高且降低了心脏、肺的受照射剂量有关[13-15]。以PFS 为疗效评估指标发现,两种治疗方式均能够起到长效控制肿瘤组织生长、延长食管癌术后患者生存期的作用,这可能与放射治疗计划良好的靶区覆盖率有关。
综上所述,相较于3D-CRT,IMRT 在食管癌患者术后辅助治疗中的安全性更高,可进一步提高靶区覆盖率及适形性,合理控制不均匀放射剂量,减少对心脏、肺部等危及器官的放射剂量。
