ZCCHC12对分化型甲状腺癌细胞上皮-间质转化和侵袭的作用及其机制
2023-03-18刘光霞陈芳卢亚敏牛丽霞侯瞻赵连春
刘光霞,陈芳,卢亚敏,牛丽霞,侯瞻,赵连春*
1河北省人民医院核医学科,河北 石家庄 050051;2河北以岭医院检验科,河北 石家庄 050091
甲状腺肿瘤为常见的头颈部肿瘤和内分泌肿瘤[1]。甲状腺癌根据组织学特征可分为分化型和未分化型,其中分化型甲状腺癌约占75%,又可分为乳头状甲状腺癌(papillary thyroid carcinoma,PTC)和滤泡状甲状腺癌(follictalar thyroid carcinoma,FTC)[2-7]。ZCCHC12(含CCHC结构域的锌指蛋白12)是骨形态生成蛋白(bone morphogenetic protein,BMP)信号通路中的转录共激活因子[8-10]。本课题组前期研究发现,ZCCHC12在甲状腺癌组织和细胞系中呈过表达,且可能通过BMP/SMAD信号通路促进甲状腺癌的发生和发展[11]。另有研究发现,ZCCHC12可激活环磷腺苷效应元件结合蛋白(cyclic AMP-response element binding protein,CREB)[12],而CREB可促进人脐动脉平滑肌细胞中p21的表达[13],p21上调对甲状腺癌的发生发展具有抑制作用[14]。截至目前,关于ZCCHC12调控CREB/p21信号通路对分化型甲状腺癌的影响鲜少报道。本研究探讨了ZCCHC12对分化型甲状腺癌细胞上皮-间质转化和侵袭的作用及其机制。
1 材料与方法
1.1 细胞、试剂及仪器 人甲状腺滤泡上皮细胞HUM-CELL-0097、人PTC细胞TPC-1由河北省人民医院实验室保存;人FTC细胞FTC-133购自英国HHPACC细胞库。ZCCHC12、CREB、p21、E-cadherin、N-cadherin、GAPDH兔单抗及辣根过氧化物酶标记的羊抗兔二抗购自英国Abcam公司;BCA试剂盒购自美国Pierce公司;CREB ELISA试剂盒购自美国Raybiotech公司;p21 ELISA试剂盒购自美国Proteintech公司;空质粒pcDNA.3.1购自美国Invitrogen公司。高速离心机、移液器购自德国Eppendoff公司;电泳仪购自英国Syngene公司;蛋白凝胶成像系统、PCR仪、iMark酶标仪购自美国Bio-Rad公司;超净工作台购自北京医疗设备厂;细胞培养箱购自美国Thermo Scientific公司。
1.2 研究对象 选取2017年5月-2018年12月河北省人民医院收治的50例分化型甲状腺癌者(设为分化型甲状腺癌组),其中男29例,女21例,年龄42~68(53.5±2.6)岁,PTC 30例,FTC 20例。纳入标准:(1)经病理学检查确诊为分化型甲状腺癌;(2)临床资料完整。排除标准:(1)伴有其他系统恶性肿瘤;(2)合并心脑血管、造血系统、肝、肾等疾病;(3)伴有严重感染性疾病、免疫系统疾病;(4)伴有意识障碍或精神疾病;(5)正接受其他研究。另选取该院同期50名健康体检者作为健康对照组。本研究经河北省人民医院伦理委员会批准(批准文号:K-2018-037),所有研究对象均签署知情同意书。
1.3 ELISA法检测血清CREB、p21含量 抽取研究对象的空腹静脉血3 ml,3500 r/min离心10 min,分离血清。按照CREB、p21 ELISA试剂盒说明书步骤操作,采用iMark酶标仪检测450 nm波长处的光密度(OD)值,计算血清CREB、p21含量。
1.4 细胞培养及pcDNA.3.1-CREB过表达载体的构建 HUM-CELL-0097、TPC-1与FTC-133细胞分别于含10%胎牛血清、100 μg/ml链霉素和青霉素的DMEM培养基中培养。采用Trizol法提取细胞总RNA,以RNA为模板反转录成cDNA,然后扩增CREB基因序列(GenBank accession number AY347527,包括酶切位点XhoⅠ和EcoRⅠ)。将扩增获得的片段酶切后与空质粒pcDNA.3.1连接并测序,将正确的质粒命名为pcDNA.3.1-CREB。
1.5 细胞转染 将TPC-1细胞和FTC-133细胞分别接种于96孔板中,置于37 ℃、5% CO2细胞培养箱中孵育24 h,待细胞融合至70%时,按照转染试剂操作说明进行细胞转染。设置空白对照组(正常培养TPC-1或FTC-133细胞)、NC si组(转染non-specific siRNA)、ZCCHC12 si组(转染ZCCHC12siRNA)、ZCCHC12 si+NC si组(转染ZCCHC12siRNA后,转染non-specific siRNA)、ZCCHC12 si+NC pc组(转染ZCCHC12siRNA后,转染pcDNA.3.1)、ZCCHC12 si+CREB pc组(转染ZCCHC12siRNA后,转染pcDNA.3.1-CREB)、ZCCHC12 si+p21 si组(转染ZCCHC12siRNA后,转染p21 siRNA)。将ZCCHC12 siRNA、p21 siRNA、non-specific siRNA、pcDNA.3.1-CREB和pcDNA.3.1各0.3 μg分别与0.6 μl Turbofect混匀,加入各组细胞中,37 ℃、5% CO2孵育24 h,采用Western blotting检测转染效率。
1.6 Western blotting检测ZCCHC12、CREB、p21、E-cadherin、N-cadherin蛋白表达量 采用Western blotting检测HUM-CELL-009、TPC-1与FTC-133细胞中CREB、p21蛋白表达量;空白对照组、NC si组(转染non-specific siRNA)、ZCCHC12 si组、ZCCHC12 si+NC si组、ZCCHC12 si+NC pc组、ZCCHC12 si+CREB pc组CREB、p21蛋白表达量;ZCCHC12 si组、ZCCHC12 si+NC si组、ZCCHC12 si+p21 si组p21、E-cadherin、N-cadherin蛋白表达量。各组加入预冷的RIPA蛋白抽提试剂,离心后取上清。利用BCA试剂盒定量蛋白。上样,行SDS-PAGE电泳,然后转至PVDF膜上,5%脱脂奶粉室温封闭2 h;加入人源ZCCHC12单抗(1:800)、CREB单抗(1:800)、p21单抗(1:600)、E-cadherin单抗(1:600)、N-cadherin单抗(1:700)和GAPDH兔单抗(1:1000)4 ℃孵育过夜;TBST清洗,加入辣根过氧化物酶标记的羊源二抗室温孵育1 h;TBST清洗,X线曝光,采用Image-ProPlus软件分析。以GAPDH为内参,目的蛋白条带与GADPH条带灰度值的比值为目的蛋白的相对表达量。
1.7 Transwell实验检测细胞侵袭能力 设置空白对照组、ZCCHC12 si组、NC si组、ZCCHC12 si+NC si组和ZCCHC12 si+p21 si组,各组处理方法同1.5,利用Transwell实验检测细胞侵袭能力。Transwell上层小室中加入细胞悬液,下层小室加入含5%胎牛血清及0.5%小牛血清的培养基,5% CO2、37 ℃条件下培养24 h后,擦去凝胶和滤膜上表面细胞,经苏木精染色后进行细胞计数。
1.8 统计学处理 采用SPSS 22.0软件进行统计分析。所有数据以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
2 结 果
2.1 分化型甲状腺癌患者血清及细胞系中CREB、p21含量 与健康对照组比较,分化型甲状腺癌组血清CREB含量明显升高(P<0.05),p21含量明显降低(P<0.01)(图1A)。与HUM-CELL-0097细胞比较,TPC-1、FTC-133细胞中CREB蛋白相对表达量明显升高,p21蛋白相对表达量明显降低(P<0.01,图1B)。

图1 分化型甲状腺癌患者血清(n=50)及细胞系(n=3)中CREB、p21含量Fig.1 Contents of CREB and p21 in serum of patients (n=50) with differentiated thyroid cancer and cell line (n=3)
2.2 干扰ZCCHC12对分化型甲状腺癌细胞上皮-间质转化及侵袭能力的影响 ZCCHC12 si组TPC-1或FTC-133细胞中ZCCHC12蛋白相对表达量较NC si组明显降低(P<0.01),表明ZCCHC12干扰实验成功(图2A)。ZCCHC12 si组TPC-1或FTC-133细胞中E-cadherin蛋白相对表达量明显高于空白对照组和NC si组,N-cadherin蛋白相对表达量明显低于空白对照组和NC si组,细胞迁移数明显少于空白对照组和NC si组(P<0.01,图2)。

图2 干扰ZCCHC12对分化型甲状腺癌细胞上皮-间质转化和侵袭能力的影响Fig.2 Influence of ZCCHC12 interference on epithelial-mesenchymal transition and invasion of differentiated thyroid cancer cells
2.3 干扰ZCCHC12对分化型甲状腺癌细胞中CREB、p21蛋白表达的影响 与空白对照组比较,ZCCHC12 si组TPC-1或FTC-133细胞中CREB蛋白相对表达量明显低于空白对照组和NC si组,p21蛋白相对表达量明显高于空白对照组和NC si组(P<0.01,图3)。

图3 干扰ZCCHC12对分化型甲状腺癌细胞中CREB、p21蛋白表达的影响(Western blotting, n=3)Fig.3 Influence of ZCCHC12 interference on the protein expressions of CREB and p21 in differentiated thyroid cancer cells(Western blotting, n=3)
2.4 干扰ZCCHC12且过表达CREB对分化型甲状腺癌细胞中p21蛋白表达的影响 ZCCHC12 si+CREB pc组TPC-1或FTC-133细胞中CREB蛋白相对表达量明显高于ZCCHC12 si+NC pc组和ZCCHC12 si组(P<0.01),表明细胞转染实验成功。ZCCHC12 si+CREB pc组TPC-1或FTC-133细胞中p21蛋白相对表达量明显低于ZCCHC12 si组和ZCCHC12 si+NC pc组(P<0.01,图4)。

图4 干扰ZCCHC12且过表达CREB对分化型甲状腺癌细胞中p21蛋白表达的影响( Western blotting, n=3)Fig.4 Influence of ZCCHC12 interference and CREB overexpression on the protein expression of p21 in differentiated thyroid cancer cells (Western blotting, n=3)
2.5 干扰ZCCHC12和p21对分化型甲状腺癌细胞上皮-间质转化及侵袭能力的影响 ZCCHC12 si+p21 si组TPC-1或FTC-133细胞中p21蛋白相对表达量明显低于ZCCHC12 si+NC si组和ZCCHC12 si组(P<0.01),表明细胞转染成功(图5A)。ZCCHC12 si+p21 si组TPC-1或FTC-133细胞中E-cadherin蛋白相对表达量明显低于ZCCHC12 si组和ZCCHC12 si+NC si组,N-cadherin蛋白相对表达量明显高于ZCCHC12 si组和ZCCHC12 si+NC si组,细胞迁移数明显多于ZCCHC12 si组和ZCCHC12 si+NC si组(P<0.01)(图5)。
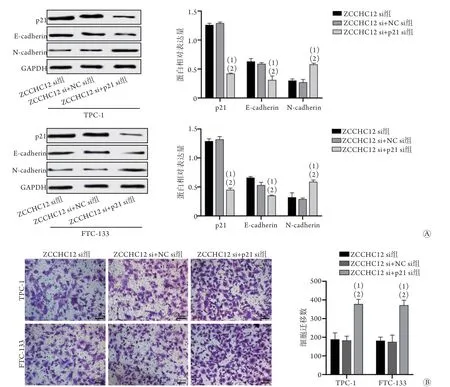
图5 干扰ZCCHC12和p21对分化型甲状腺癌细胞上皮-间质转化和侵袭能力的影响Fig.5 Influence of interference of ZCCHC12 and p21 on epithelial-mesenchymal transition and invasion of differentiated thyroid cancer cells
3 讨 论
既往研究发现,ZCCHC12在甲状腺癌组织中呈高表达[11]。ZCCHC12高表达可明显促进甲状腺癌细胞CGTH W-3和FTC-133增殖并抑制其凋亡,干扰ZCCHC12则可明显抑制CGTH W-3和FTC-133细胞增殖并促进其凋亡,表明ZCCHC12对甲状腺癌细胞增殖和凋亡起调控作用[11]。另有研究发现,ZCCHC12可明显促进神经细胞中CREB的表达[8],而CREB可抑制小鼠胰岛β细胞中p21的表达[15]。Ruan等[16]发现,p21高表达可有效抑制甲状腺癌的发展。截至目前,ZCCHC12通过CREB/p21通路调控分化型甲状腺癌细胞上皮-间质转化和侵袭能力相关的研究鲜见。因此,本研究探讨了ZCCHC12、CREB和p21在分化型甲状腺癌细胞中的调控关系,以及对分化型甲状腺癌细胞上皮-间质转化和侵袭能力的影响,结果显示,干扰ZCCHC12可上调E-cadherin表达、下调N-cadherin表达,表明干扰ZCCHC12可明显抑制分化型甲状腺癌细胞的上皮-间质转化;Transwell实验结果显示,干扰ZCCHC12可明显抑制分化型甲状腺癌细胞的侵袭能力。
Ayroldi等[17]研究发现,CREB在甲状腺癌的发展中起着重要作用,可促进肿瘤的生长。Li等[12]发现,ZCCHC12可上调宫颈癌细胞、神经母细胞瘤细胞和脑胶质瘤细胞中CREB的表达。然而,ZCCHC12对分化型甲状腺癌细胞中CREB的调控作用尚未明确。本研究结果显示,分化型甲状腺癌患者血清中CREB含量明显升高,而抑制分化型甲状腺癌细胞中ZCCHC12的表达后,CREB蛋白表达量明显下降。由此可见,在分化型甲状腺癌中,ZCCHC12可促进CREB的表达,与Li等[12]报道的宫颈癌细胞、神经母细胞瘤细胞和脑胶质瘤细胞中ZCCHC12对CREB的正向调节作用一致。p21是一种细胞周期蛋白依赖性激酶抑制蛋白,作为G1/S期限制点的调节因子,可抑制细胞从G1期向S期转化,起到抑制细胞生长的作用[18-20]。Li等[21]研究发现,p21过表达可有效抑制甲状腺癌细胞的增殖。Yang等[22]研究发现,p21可促进甲状腺间变性癌细胞凋亡。有研究发现,干扰lncRNA-HOTAIR可上调p21的表达,从而抑制结直肠癌细胞的侵袭能力[23]。截至目前,p21对分化型甲状腺癌细胞侵袭能力的调节作用尚不清楚。本研究结果显示,分化型甲状腺癌患者血清中p21含量明显降低。在分化型甲状腺癌细胞中,干扰ZCCHC12可明显上调p21蛋白的相对表达量,而过表达CREB可明显消除干扰ZCCHC12对p21表达的促进作用,提示在分化型甲状腺癌细胞中,干扰ZCCHC12可通过CREB促进p21的表达。此外,与干扰ZCCHC12的细胞比较,同时干扰ZCCHC12和p21可明显下调E-cadherin蛋白的表达、上调N-cadherin蛋白的表达,表明干扰p21可有效消除干扰ZCCHC12对分化型甲状腺癌细胞上皮-间质转化的影响。Transwell实验结果也表明,干扰p21可有效消除干扰ZCCHC12对分化型甲状腺癌细胞侵袭能力的影响。因此,在分化型甲状腺癌细胞中,干扰ZCCHC12可通过CREB增强p21的表达,进而抑制分化型甲状腺癌细胞的上皮-间质转化和侵袭。有研究发现,ZCCHC9可通过与NF-kB启动子结合抑制MAPK通路[24],而MAPK通路可激活Notch通路,影响甲状腺乳头状癌细胞的增殖[25]。截至目前,ZCCHC12通过调控MAPK通路影响分化型甲状腺癌细胞增殖的报道较少,后期可探讨ZCCHC12/MAPK在分化型甲状腺癌细胞增殖中的作用。
综上所述,分化型甲状腺癌患者血清中CREB含量明显升高,p21含量明显降低,干扰分化型甲状腺癌细胞中的ZCCHC12可通过抑制CREB的表达而促进p21的表达,进而抑制分化型甲状腺癌细胞的上皮-间质转化和侵袭。但本研究未在体内探讨ZCCHC12、CREB、p21对分化型甲状腺癌发生发展的作用,后续需进一步进行大鼠体内实验探讨ZCCHC12、CREB、p21对分化型甲状腺癌发生发展的影响。
