TGF-β1/Smad3信号通路在阻塞性睡眠呼吸暂停综合征大鼠认知障碍中的作用
2023-03-18薛志远岳宇娇黄琴徐源周雪向桃程明徐平
薛志远,岳宇娇,黄琴,徐源,周雪,向桃,程明,徐平
作者单位1.成都市金牛区人民医院 成都 610032
2.遵义医科大学附属医院 贵州遵义 563099
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是一种以全部或局部上呼吸道阻塞为特征的睡眠呼吸障碍性疾病[1]。缺氧后复氧是OSAS最主要的病理生理过程,OSAS可导致认知功能衰退,表现为学习记忆力差、警惕性下降等[2]。有影像学报道,OSAS患者大脑左侧海马内侧皮质、左后顶叶皮质、右侧额上回的灰质体积减少,这些脑区域结构变化诱发脑功能变化,最终导致认知受损[3]。转化生长因子-β(transforming growth factor-β,TGF-β)/Smad 信号转导途径参与神经发育及损伤修复,在中枢神经系统疾病中高度活跃,如脑肿瘤、脑积水等,损害神经元,使疾病恶化[4,5]。我们提出科学假想,TGF-β1/Smad3信号转导途径是否参与OSAS大鼠认知功能障碍?对认知功能到底起保护作用还是损害作用?基于以上思考,本实验拟经慢性间断性缺氧(chronic intermittent hypoxia,CIH),建造OSAS 大鼠模型,并采用TGF-β1抑制剂选择Disitertid(别名P144)进行阻断通路,从行为学、病理学等角度出发,探索TGF-β1/Smad3 信号转导途径与认知功能之间的关系。
1 材料与方法
1.1 主要试剂与材料
1.1.1 实验动物 成年健康雄性SD 大鼠42 只,SPF级,体质量170~200 g,购于长沙市天勤生物技术有限公司[许可证号:SCXK(湘)2014-0011]。
1.1.2 主要试剂TGF-β1 抗体、Smad3 抗体、pSmad3 抗体、GAPDH抗体购于Abcom公司;尼氏染色试剂盒购于北京雷根生物技术有限公司;兔抗二抗购于万类生物科技有限公司。
1.2 方法
1.2.1 动物分组及处理 SD 大鼠适应性饲养1 周后随机分为7组:正常对照组(N组)、CIH 1W组、CIH 2W组、CIH 3W 组、CIH 4W 组、CIH 4W+ P144 组、CIH 4W+DMSO组,每组6只。在借鉴Fletcher、Li等[6]建模方法的基础上,改进CIH 并建造OSAS 大鼠模型。将各CIH 各组大鼠置于动物低氧仓内,氧气浓度(8.0±0.5)%,维持90 s 后将大鼠从低氧舱内取出复氧,90 s后再次放入低氧舱中,重复循环,8 h/d,持续4周,记录大鼠尾动脉血氧饱和度。其中CIH 4W+P144 组、CIH 4W+DMSO 组大鼠于建模前30 min 分别腹腔内注射P144(70µg/kg)或DMSO(1 mL/kg),隔日1次。第5周行水迷宫实验,检测大鼠的学习和记忆能力。水迷宫实验后灌注处死大鼠,取出海马组织。
1.2.2 Morris 水迷宫行为学测试 适应性训练1 d 避免大鼠应激。隐蔽平台实验5 d,统计120 s 内大鼠找到水池内隐蔽平台的时间;找不到平台的大鼠,将其引领至平台停留10 s,找寻平台时间记做120 s。空间探索实验:第7天拆除水池内平台,统计120 s内每只大鼠穿过平台位置的次数。
1.2.3 尼氏染色法 取大鼠海马组织后切片(5 μm)、脱蜡(二甲苯溶液及梯度酒精各3 min)、清洗、染色(暗房,亚甲蓝约30µL,56 ℃恒温箱60 min)、清洗、分化(暗房,滴加Nissl Differentiation约30µL)、清洗、脱水、干燥、中性树脂封片、光学显微镜下采图。
1.2.4 蛋白免疫印迹法 取大鼠海马组织后蛋白提取、定性及变性、电泳、电转、封闭及一、二抗孵育、曝光、图像结果分析,其中一抗浓度TGF-β1 1∶100、Smad3 1∶100、pSmad3 1∶500,二抗IGg浓度1∶5000。
1.3 统计学处理
采用SPSS 18.0 软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,采用配对t检验统计分析鼠尾动脉血氧饱和度值,重复测量数据的方差分析水迷宫数据计,单因素方差分析蛋白表达水平;P<0.05为差异有统计学意义。
2 结果
2.1 OSAS大鼠模型的评定
CIH 各时间点组、CIH 4W+P144 组、CIH 4W+DMSO组大鼠在低氧处理期间均有烦躁、白天嗜睡、憋醒等症状,缺氧期间大鼠尾动脉血压饱和度为(67.61±7.03)%,自然空气环境复氧期间(95.44±2.71)%,缺氧相与复氧相间相比大鼠平均血氧饱和度下降>4%,差异具有统计学意义(P<0.05),建模成功。
2.2 大鼠学习和记忆能力改变
水迷宫定位航行实验中,各组大鼠逃避潜伏期见表1;N组、CIH 1W组、CIH 2W组、CIH 3W组、CIH 4W组、CIH 4W+DMSO组及CIH 4W+P144组空间探索时穿越平台次数分别为(4.10±0.85)次、(3.65±0.98)次、(2.70±1.08)次、(2.15±0.74)次、(1.00±0.72)次、(1.05±0.82)次及(3.05±0.68)次。分析显示,与N 组相比,CIH 1W 组大鼠的逃避潜伏期及穿越平台次数差异无统计学意义(P>0.05),而2W、3W、4W 时间点组大鼠逃避潜伏期延长,穿越平台次数减少(均P<0.05);与CIH 4W+DMSO 组相比,CIH 4W+P144 组大鼠逃避潜伏期缩短,穿越平台次数增加(均P<0.05)。
表1 各组大鼠逃避潜伏期比较(s,±s)
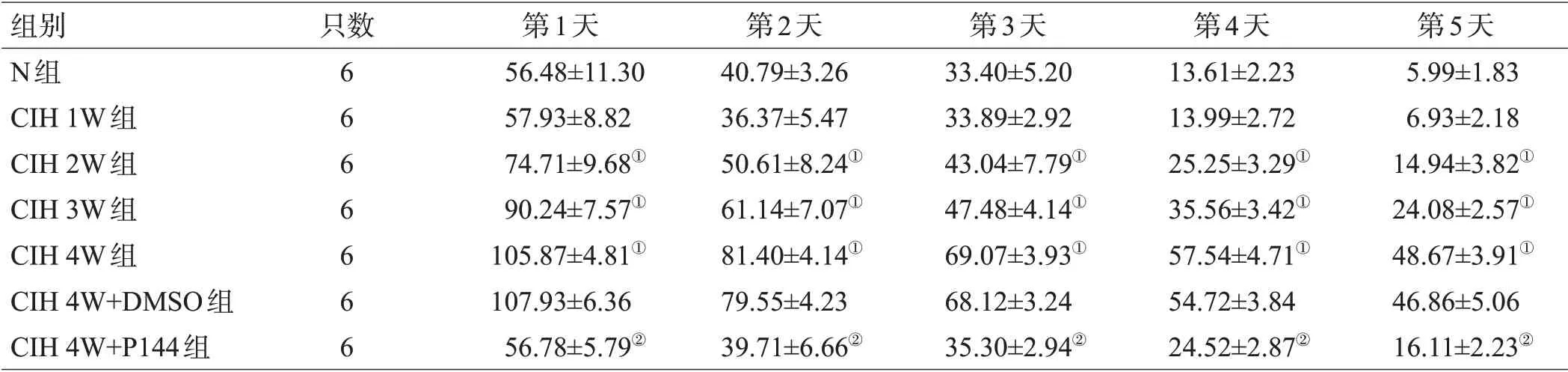
表1 各组大鼠逃避潜伏期比较(s,±s)
注:与N组比较,①P<0.05;与CIH 4W+DMSO组比较,②P<0.05
组别N组CIH 1W组CIH 2W组CIH 3W组CIH 4W组CIH 4W+DMSO组CIH 4W+P144组只数6666666第1天56.48±11.30 57.93±8.82 74.71±9.68①90.24±7.57①105.87±4.81①107.93±6.36 56.78±5.79②第2天40.79±3.26 36.37±5.47 50.61±8.24①61.14±7.07①81.40±4.14①79.55±4.23 39.71±6.66②第3天33.40±5.20 33.89±2.92 43.04±7.79①47.48±4.14①69.07±3.93①68.12±3.24 35.30±2.94②第4天13.61±2.23 13.99±2.72 25.25±3.29①35.56±3.42①57.54±4.71①54.72±3.84 24.52±2.87②第5天5.99±1.83 6.93±2.18 14.94±3.82①24.08±2.57①48.67±3.91①46.86±5.06 16.11±2.23②
2.3 尼氏染色光镜观察结果
尼氏染色光镜观察结果显示,N 组大鼠海马CA1和CA3区尼氏小体数量多,结构完好,胞浆颜色深,胞核居中;CIH 4W 组及CIH 4W+DMSO 组部分细胞结构被破坏、尼氏小体数量减少溶解、胞浆着色浅、细胞由多极形变为圆形、尼氏小体消失;CIH 4W+P144 组尼氏小体数量多,细胞浆着色较深,且结构较完整,细胞受损程度相对轻,见图1、图2。

图1 大鼠海马组织CA1区尼氏染色图(40×,标尺=1 mm)
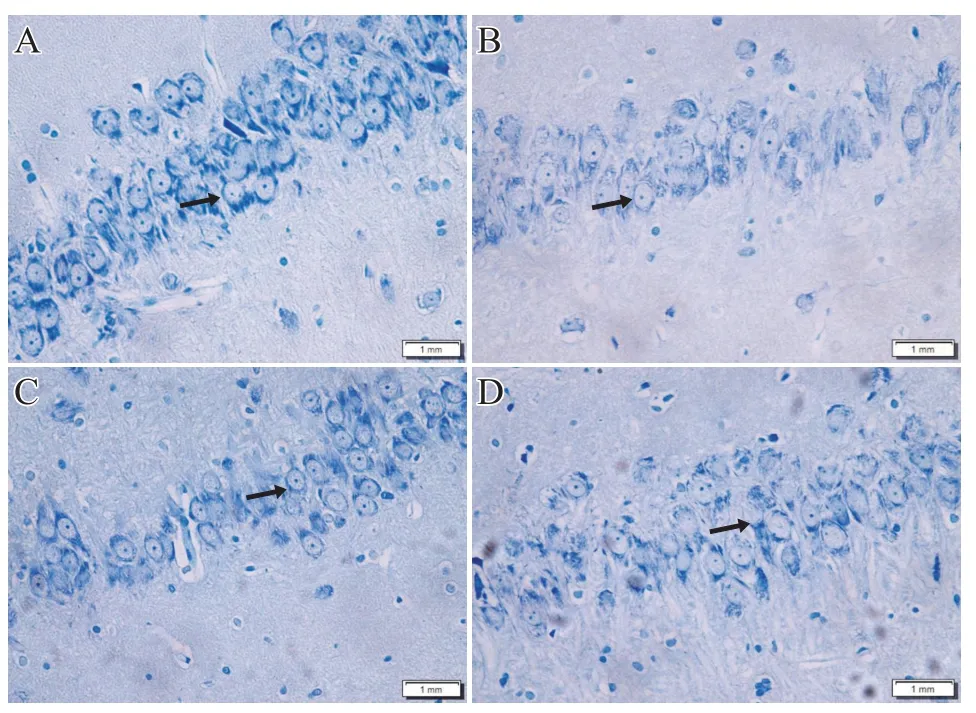
图2 大鼠海马组织CA3区尼氏染色图(40×,标尺=1 mm)
2.4 TGF-β1、tSmad3、pSmad3蛋白的表达变化
各组大鼠海马组织中均检测到TGF-β1、Smad3及pSmad3 蛋白的表达,与N 组比较,TGF-β1、pSmad3 在CIH 1W、2W、3W、4W 时间点的蛋白表达量递增(均P<0.05);而Smad3 无明显变化(P>0.05);与CIH 4W+DMSO组比较,CIH 4W+P144组TGF-β1、pSmad3蛋白表达量表达下降(均P<0.05),而Smad3无明显变化(P>0.05),见表2、图3。

图3 大鼠海马区TGF-β1、tSmad3、pSmad3蛋白表水平(免疫印迹法)
表2 各组大鼠海马TGF-β1、tSmad3、pSmad3蛋白IOD值比较(±s)

表2 各组大鼠海马TGF-β1、tSmad3、pSmad3蛋白IOD值比较(±s)
注:与N组比较,①P<0.05;与CIH 4W+DMSO组比较,②P<0.05
组别N组CIH 1W组CIH 2W组CIH 3W组CIH 4W组CIH 4W+DMSO组CIH 4W+P144组只数666666 6 TGF-β1 1.00±0.00 1.43±0.51①1.60±0.11①2.15±0.12①2.31±0.51①2.32±0.35 tSmad3 1.00±0.00 0.98±0.15 1.01±0.15 0.98±0.00 1.03±0.00 0.98±0.00 pSmad3 1.00±0.00 1.36±0.20①1.53±0.23①1.65±0.20①2.12±0.23①2.09±0.55 1.81±0.15②1.02±0.11 0.75±0.51②
3 讨论
3.1 OSAS损害大鼠认知功能
OSAS 常由夜间睡眠期间反复气道塌陷所引起,睡眠期间歇性缺氧是其最主要的病理生理特征,导致大脑区域中参与学习和记忆的细胞结构破坏,并降低海马CA1、CA3区神经元兴奋性及海马长时程增强,影响学习、记忆能力等[7]。关于OSAS动物模型构建尚无统一标准,国外OSAS 模型需满足以下3 个条件之一:同质性(发病因素与人体相同)、同形性(临床症状与人体相似)、可预测(对治疗反应似与人体相似),而大多数OSAS模型只能部分同形;本研究采用的模型,是在睡眠期间发生阻塞性呼吸暂停,伴SpO2下降至90%以下,伴上气道解剖结构异常,是最接近人类OSAS的动物模型[8]。本次造模将各组大鼠置于舱内反复进行缺氧后再复氧,建模过程中各组大鼠烦躁、嗜睡等症状均表现于缺氧期间,鼠尾动脉血氧饱和度波动在(67.61±7.03)%,与OSAS 患者临床症状相似,符合OSAS 模型标准。与人类相似,OSAS 大鼠白天嗜睡可能与低氧血症相关[9]。最接近OSAS 的试验模型是对大鼠进行气道阻塞并使用多导睡眠检测仪器进行呼吸暂停指数、微觉醒指数等检测,课题组既往曾使用透明质酸钠凝胶阻塞大鼠气道,虽能较好地阻塞气道,但大鼠死亡率高,故课题组参考国内外造模方法进行改造,该问题也是实验不足之处。
与身体其他部位相比,大脑需要更多的能量和氧气消耗,并且对缺氧更加敏感[10],在慢性CIH 条件下,OSAS 大鼠海马CA1 和CA3 区细胞水肿、部分尼氏小体溶解,海马神经细胞结构的破坏渐进性地损害认知功能。水迷宫实验显示,CIH 1W 大鼠学习、空间联想能力强,这可能因为CIH早期,大鼠海马功能处于代偿阶段,认知障碍发生的超早期。随CIH时间延长,海马功能结构及功能损害加重,由代偿期过度到失代偿期,损害学习、空间联想能力。已有研究发现CIH 诱发神经系统炎症反应的证据:在CIH状态下,机体释放IL6、IL8、TNF-α等[11]多种炎症因子进入血液,中断内皮细胞之间的紧密衔接,使炎症因子更容易穿过血脑屏障进入大脑,加速促炎细胞因子的趋化及释放,活化的小胶质细胞和星形胶质细胞放大炎症反应。在长期慢性炎症状态下,小胶质细胞介导的突触吞噬作用增强,Tau过度磷酸化,β-淀粉样蛋白集聚,触发神经细胞的凋亡及坏死[12-15]。这一系列的调控可能发生在OSAS 大鼠大脑内,造成大鼠海马细胞结构破坏,学习记忆及空间联想能力受损,最终导致认知功能障碍。
3.2 OSAS认知障碍大鼠激活TGF-β1/Smad3信号通路
TGF-β家族包含许多在胚胎发育和成体组织稳态期间具有不同功能的细胞因子,参与细胞增殖、分化及死亡,TGF-β1 是TGF-β家族中的最重要成员之一。SMAD 家族是目前已知的唯一TGF-β受体底物和信号转导媒介,是TGF-β家族发挥多种生物学效应的核心[16]。据报道,TGF-β1/Smad 信号转导途径参与神经系统多种难治性疾病,如:亨廷顿舞蹈症、肌萎缩性侧索硬化症等[17,18]。本实验中,随缺氧时间延长,TGF-β1、pSmad3 蛋白表达含量逐渐上调,OSAS 认知障碍大鼠大脑内TGF-β1/Smad3信号通路处于开放状态,且伴有Smad3质核穿梭。TGF-β家族受体属于丝氨酸/苏氨酸激酶家族,其中Ⅱ型受体通过磷酸化Ⅰ型受体的GS区而激活Ⅰ型受体的激酶活性,TGF-β1/Smad3信号通路能够调控小胶质细胞影响丝氨酸激酶活性[19]。同样,下游Smad 蛋白的活性及蛋白稳定性受到多种激酶的调控,R-Smad的linker区富含丝氨酸与苏氨酸,其中很多位点都是脯氨酸导向激酶的靶点,Smad3 在核孔蛋白和输入蛋白介导下结合输入蛋白β被转运至核内,承载生物学信息,调节受体的活性[20,21]。本实验中OSAS大鼠体内炎症反应存在局部或全身,小胶质细胞作为免疫反应的第一道防线,成熟及分化受TGF-β1 调控,活化状态下的小胶质细胞可能会通过影响丝氨酸激酶活性促使TGF-β1/Smad3 信号通路异常开放,使TGF-β1蛋白表达上调,损害认知功能,小胶质细胞可能是缺氧、神经炎症、TGF-β1/Smad3 信号转导途径异常激活的重要媒介[22,23]。
3.3 抑制TGF-β1可改善OSAS大鼠认知功能障碍
P144 是TGF-β1 受体特异性抑制剂,能显着降低TGF-β1 与其受体的结合率[24]。本实验应用P144 干预后,OSAS组大鼠海马CA1、CA3区细胞结构破坏减轻,尼氏小体数量相对较多,水迷宫行为学表现为空间学习能力及记忆能力改善,且免疫印迹检测可见TGF-β1、pSmad3 蛋白表达水平下调。说明抑制TGF-β1 后TGF-β1/Smad3 信号通路活化受抑制,OSAS 大鼠的学习及记忆能力一定程度上得到改善。国外有类似的研究报道,在阿尔茨海默病和血管性认知障碍中,TGF-β1可通过与血管紧张素Ⅱ(AngⅡ)1型受体(AT1R)信号传导途径的相互作用发挥损害作用[25];在亨廷顿舞蹈病中,海马区TGF-β1 水平升高会损害神经祖细胞增殖,导致海马功能障碍,最终导致学习及记忆能力下降[17]。当然,也有研究报道,TGF-β1 通过调节突触重塑诱导海马长时程增强而改善认知功能[26,27]。TGF-β1可能是导致认知障碍的原因之一,但具体机制仍需更多的科学研究。
然而,本实验亦有不足之处。首先,模型建造没有在夜晚进行,无法模拟人类的睡眠,没有使用TGF-β1/Smad3 信号通路特异性激动剂,无法研究该信号通路激活后大鼠认知功能及目的蛋白变化情况。其次,水迷宫实验中没有对各组大鼠进行视力障碍及运动障碍的排查。最后,没有行小胶质细胞、神经炎症因子的相关检测。在下一步实验中,将课题组将完善本实验的不足,深究TGF-β1/Smad3信号通路导致OSAS大鼠认知障碍的机制。
