单/双脉冲经颅磁刺激检测皮质兴奋性在癫痫的应用及前景
2023-03-18周营营吴辉婷黄珊珊朱遂强
周营营,吴辉婷,黄珊珊,朱遂强
作者单位华中科技大学同济医学院附属同济医院神经内科 武汉430030
兴奋性和抑制性神经元功能失衡引起的皮质神经元过度兴奋和超同步化是癫痫的病理生理基础[1]。了解不同类型癫痫的皮质兴奋性特征和疾病不同阶段的皮质兴奋性水平变化,有助于更深入地认识癫痫的发生和发展,并为临床抗发作药物的使用提供证据。经颅磁刺激(tanscranial magnetic stimulation,TMS)是一种非侵入性的神经生理检测技术,可通过测量神经元细胞膜兴奋性、突触兴奋性和神经元及轴突的可塑性,评估运动皮质兴奋性和抑制性神经元网络功能,反映皮质兴奋性的水平[2],也为癫痫疾病的机制研究提供新的思路和方向。TMS 最早由Baker 等于1985 年提出,分为单脉冲TMS、双脉冲TMS,重复TMS 和θ波脉冲刺激模式。已有随机对照研究证明低频重复TMS 对减少局灶性难治性癫痫患者的癫痫发作频率和改善脑电图异常放电方面有一定疗效[3,4]。但单/双脉冲TMS 检测皮质兴奋性技术在临床未被广泛认识及应用。因此,本文对单/双脉冲TMS 在癫痫患者皮质兴奋性检测中的应用及前景进行综述。
1 单/双脉冲TMS 检测皮质兴奋性的原理,常用参数及意义
初级运动皮质是大脑皮质兴奋/抑制网络重要的一环,远隔部位的致痫灶(如颞叶)可对同侧半球初级运动皮质的兴奋性产生影响[5]。放置于头皮选定位置的刺激线圈发放的脉冲刺激作用于初级运动皮质,经突触传递激活锥体神经元,产生的运动诱发电位(motor evoked potential,MEP)可以在包括手部小肌肉等多处肌肉被记录[5]。对于有明确癫痫病灶且位于一侧半球的患者,视研究目的不同,可将线圈放置于癫痫病灶侧半球或病灶对侧半球;对于全面性癫痫或无法定位的局灶性癫痫,则选择将线圈放置于优势半球侧。
单脉冲TMS 主要用于测量MEP 波幅、静息运动阈值(resting motor threshold,rMT)和皮质静默期(cortical silence period,CSP)。MEP 波幅可以直观的反映皮质兴奋性水平。与MEP 相关的参数包括rMT 及皮质运动诱发电位(cortical motor evoked potential,cMEP)。能引起10 个MEP 中至少5 个MEP 的波幅≥100 µv 的最小刺激强度为rMT(图1A),rMT用机器最大输出强度的百分比来表示,每位受试者均可测量出其专有的rMT。至少10 次120% rMT 刺激下得到的平均MEP 波幅称为cMEP。MEP的产生主要依赖于初级运动皮质神经元细胞膜上电压门控钠通道的传导性,因此rMT可反映大脑皮质神经元细胞膜的兴奋性,rMT值降低意味着皮质神经元细胞膜兴奋性升高。让受试者保持目标肌肉(即拇短展肌)的主动轻微收缩,予以一个阈上刺激,经过一段静默期后肌肉恢复自主收缩,从MEP 的结束至恢复主动收缩这段时间称为CSP(图1B)。CSP的长短反映皮质内抑制性中间神经元伽马氨基丁酸B(gamma-aminobutyric acid B,GABAB)受体的活性;CSP 延长意味着GABAB 受体活性增强,即皮质内抑制性中间神经元网络功能增强。
双脉冲TMS是指机器发放单个脉冲刺激后经过一定的时间间隔,再发放下一个单脉冲刺激。前后两个单脉冲的时间间隔称为刺激间隔(inter-stimulus interval,ISI),短ISI 一般指1~5 ms,长ISI一般指10~30 ms和50~300 ms,本文列举了最常用的几种ISI。两对成对脉冲的刺激时间间隔一般是10~15 s。常用的参数包括短间隔皮质内抑制(short-interval cortical inhibition,SICI)、皮质内易化(intracortical facilitation,ICF)和长间隔皮质内抑制(long-interval cortical inhibition,LICI)。先予以一个阈下刺激,2 ms 或5 ms 后再予以一个阈上刺激,此时MEP 波幅与cMEP 的比值代表SICI(图1C-D),比值越接近0 表示皮质内伽马氨基丁酸A(gamma-aminobutyric acid A,GABAA)受体介导的抑制性中间神经元网络功能越强,>1表示抑制性网络功能受损。先予以一个阈下刺激,10 ms或15 ms后再予以一个阈上刺激,此时的MEP波幅与cMEP的比值代表ICF(图1E-F),表示皮质内α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4 isoxazolpropionic acid,AMPA)受体介导的兴奋性中间神经元网络功能,该值越大反映皮质内易化网络功能越强,比值越接近0表示皮质内易化网络功能越弱。先予以一个阈上刺激,150 ms、200 ms、250 ms或300 ms后再予以一个阈上刺激,第二个阈上刺激MEP波幅与第一个阈上刺激MEP波幅的比值代表LICI(图1G-J),比值越接近0表示皮质内GABAB受体介导的抑制性中间神经元网络功能越强,>1表示抑制性网络功能受损。双脉冲恢复曲线是不同刺激间隔下对应的MEP 比值所连成的曲线,同样反映皮质内兴奋/抑制网络功能。
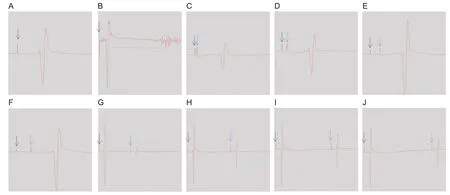
图1 运动诱发电位
2 单/双脉冲TMS检测的皮质兴奋性与基因突变相关癫痫
在明确有癫痫相关基因突变的患者中,目前单/双脉冲TMS研究一致认为致痫基因可导致SICI 减弱和CSP 缩短[6],表明遗传背景影响下的癫痫患者存在大脑皮质内GABAA和GABAB受体介导的抑制性网络功能减弱。例如,钠离子通道SCN1A基因编码电压门控钠通道的α亚基,在超过80%Dravet 综合征患者中可以发现SCN1A基因突变,一项针对6名Dravet综合征患者进行的TMS检测发现其SICI与健康对照和无SCN1A基因突变的癫痫患者相比均明显减弱,提示基因突变患者GABAA受体介导的皮质内抑制功能严重受损[7]。GABAA受体γ2亚基R43Q基因突变可能与特发性全面性癫痫有关,在14个有R43Q基因突变的患者中同样发现SICI减弱,另有ICF增强,表明基因突变患者皮质内GABAA受体介导的抑制性网络功能减弱和AMPA受体介导的兴奋性网络功能增强[8]。有学者对Unverrich-Lundborg 病(一种常染色体隐形遗传的进行性肌阵挛性癫痫)进行TMS 研究,发现SICI减弱,认为这可能与疾病的高致痫倾向有关[9]。家族性皮质肌阵挛性震颤伴癫痫(familial cortical myoclonic tremor with epilepsy, FCMTE)是一种常染色体显性遗传疾病,一个意大利FCMTE 家系中4 名成员的皮质兴奋性检测同样发现SICI减弱,CSP缩短[10]。另一荷兰FCMTE家系6名成员的研究也得到一致性结论[11]。
除了上述较为一致的研究结果,尚有部分研究存在异议,在对17 名Rett 综合征患者进行单脉冲TMS 检测时,发现患者CSP 缩短,同时rMT 显著升高[12],皮质神经元细胞膜兴奋性降低。但是CSP 缩短与是否存在甲基-CpG 结合蛋白2 基因突变(methyl-CpG-binding protein 2 gene,MECP2)无关[12]。在24 例有胱抑素B(cystatin B,CSTB)扩增突变的Unverrich-Lundborg病患者中发现CSP延长,即GABAB受体介导的抑制性网络功能增强,同时伴有rMT显著升高[13],且基因扩增的长度和rMT值相关[14]。但在儿童交替性偏瘫患者中发现rMT 明显降低[15]。另外,某些有瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)基因突变的个体ICF 增强,皮质内AMPA受体介导的兴奋性网络功能增强,但未见皮质内抑制网络功能异常[16]。以上研究结果的不一致可能与疾病间不同的遗传背景和抗发作药物的使用有关。
综上所述,在遗传因素作用下的癫痫患者普遍存在皮质内抑制网络功能减弱和神经元细胞膜兴奋性降低,相关基因突变可能改变大脑皮质的兴奋性水平,参与癫痫发生和发展。单/双脉冲TMS通过对皮质兴奋性检测,有助于揭示遗传性癫痫患者大脑皮质神经元兴奋/抑制网络功能的特点。
3 单/双脉冲TMS检测的皮质兴奋性与癫痫分类
根据国际抗癫痫联盟(International League Against Epilepsy,ILAE)2017年的最新分类,癫痫发作类型分为局灶性起源、全面性起源、未知起源和不能分类4 大类。初始治疗有效和癫痫的预后密切相关[17],不同类型的癫痫对同种抗发作药物有时甚至表现出截然不同的疗效。因此,精准的分类是癫痫患者管理的重要环节之一。目前鉴别全面性和局灶性癫痫主要依据患者及目击者对发作表现的描述,视频脑电图和影像学检查也可提供部分诊断信息,对于常规检查未能检出阳性结果的患者,高分辨率3.0T 磁共振、正电子发射断层成像术(positron emission tomography,PET)和基因检测可能有助于诊断,其中PET 对癫痫病灶定位的敏感性优于其他[18]。
有研究表明,TMS也具有鉴别全面性和局灶性癫痫的潜在能力。有学者提出,新发未用药的局灶性癫痫患者的皮质兴奋性存在半球间差异,即病灶侧半球与健侧相比呈现过度兴奋的状态[19],而已使用抗发作药物的慢性局灶性癫痫患者中则未发现半球间皮质兴奋性差异[20]。近年来报道,局灶性癫痫的病灶侧CSP较对侧和健康人相比均明显延长,SICI较健康人相比有减弱,两侧大脑半球有不对称性的皮质内抑制和兴奋系统失衡[21],进一步阐明了局灶性癫痫更复杂的皮质电生理特征。部分研究提示局灶性癫痫患者的双侧大脑半球rMT 与健康对照均有显著差异,因此rMT对于区分癫痫分类的应用价值有限[22]。
对新发未用药的全面性癫痫患者皮质兴奋性研究发现患者的双侧大脑皮质均存在皮质内抑制网络功能受损,表现出皮质高兴奋性[19],后来的研究也证实了这一观点[23]。此外,Silbert 等[24]的研究同样提示未用药的特发性全面性癫痫SICI减弱和ICF增强,总体表现为高兴奋性。肌阵挛癫痫[25],尤其是青少年肌阵挛癫痫[26]也存在SICI减弱。综上,笔者推测新发未用药的局灶性癫痫和全面性癫痫的皮质电生理可能为不同模式,虽然均表现为过度兴奋,但局灶性癫痫为偏侧过度兴奋效应,仅局限于致痫灶侧半球,而全面性癫痫为双侧大脑半球过度兴奋,因此,可以通过单/双脉冲TMS检测将两者区分开。未来需要大样本量研究进一步验证其灵敏性和特异性。
4 单/双脉冲TMS检测的皮质兴奋性与抗发作药物疗效
TMS作为一种神经生理检测技术,可为癫痫的药物治疗提供指导,且能够早期预测难治性癫痫。目前大部分抗发作药物都是通过作用于离子通道进而降低皮质兴奋性来发挥抗惊厥和防止癫痫活动扩散。苯妥英钠[27]、卡马西平[28]、奥卡西平[29]、拉考沙胺[28]、左乙拉西坦[30]等药物均可提高癫痫患者和正常人的rMT,使皮质神经元细胞膜兴奋性降低;拉莫三嗪可使癫痫患者的rMT升高且呈剂量依赖性[31];托吡酯可使SICI增强[32],提高皮质内抑制网络的功能;丙戊酸具有多种抗惊厥机制,短期使用和长期使用对皮质兴奋性有不同的影响[33]。对于第四代抗发作药物例如比仑帕奈等是否影响癫痫患者皮质兴奋性水平尚无研究。除了对癫痫发作的观察及对脑电图监测,对抗发作药物的有效性的评价可通过单/双脉冲TMS检测用药前后皮质兴奋性的变化进行客观评估,更深入地认识癫痫患者对抗发作药物的反应及疾病的转归。
治疗前多次发作[17]、初始药物疗效欠佳[17]、复杂部分性发作[34]、大脑结构异常[35]等因素均与耐药性癫痫相关。目前关于耐药性癫痫预测因素的研究主要聚焦于发作形式、病因和疗效等方面,而单/双脉冲TMS 作为一种更客观的评估皮质兴奋性水平和药物疗效的工具成为近年来耐药性癫痫早期预测研究热点之一。一项为期3 年的前瞻性研究提出,发病初期未用药时的皮质兴奋性水平并不能预测将来是否发展为耐药性癫痫[36]。但是,该研究结果还表明癫痫个体的皮质兴奋性是动态变化的,不论全面性癫痫或是局灶性癫痫,仅使用一种抗发作药物即可达到癫痫无发作的患者在用药后8~12周的皮质兴奋性较用药前明显降低,双脉冲恢复曲线接近健康对照;使用2种抗发作药物达到癫痫无发作的患者在加用第2种药物后其皮质兴奋性较用药前和仅使用第1种药物时有所降低,LICI增强,上述变化在用药30~36月后仍然存在;而耐药性癫痫在加用第2种药物后其皮质兴奋性仍未发现有降低的趋势,LICI反而减弱。以上研究提示皮质兴奋性水平或可评价患者对抗发作药物的反应。另外一项多中心研究[37]称LICI不宜作为耐药性癫痫的标志物,因耐药性全面性癫痫、耐药性局灶性癫痫和健康人三组之间在任一刺激间隔的LICI均无显著差异,虽然该结论亦可能由于不同中心TMS 刺激方案的差异所致。以上不一致的研究结论需要扩大的样本研究。癫痫患者个体内不同病程阶段的致痫过程是动态变化的,受慢性长期癫痫发作带来的为阻止由发作间期向发作期转变的代偿机制和抗发作药物的影响[38],因此对于癫痫患者个体,早期未能对抗发作药物显示皮质兴奋性改善仍可能是预测耐药的有价值的早期预测指标[38]。动态观察癫痫患者皮质兴奋性的变化,尤其是在加药前后的8~12周内,有助于临床医生尽早识别出可能发展成为耐药性癫痫的患者。值得关注的是目前尚未见TMS 检测皮质兴奋性对停药后癫痫复发有无预测价值的研究。
5 展望及前景
综上所述,应用TMS检测皮质兴奋性水平在癫痫领域有良好的应用前景。不仅在基因突变相关癫痫的研究中获得一致性结论,还有助于指导临床癫痫的分类和客观评估抗发作药物的疗效。虽然目前已有大量的相关研究,但以上大部分均为小样本量横断面研究,且不同研究之间的TMS 刺激方案异质性较大,目前尚没有公认的刺激参数标准。虽然TMS的安全性已得到广泛的认同,但是仍缺乏健康人群大样本量的数据。皮质兴奋性检测可受多种因素的影响,如抗发作药物、睡眠剥夺、性别、生理周期、抗抑郁药物和其他神经系统疾病等。因此,在未来的研究中,应尽量除外混杂因素的影响,扩大样本量,使用严格统一的刺激方案,提高各研究的可比性,探索单/双脉冲TMS在特定刺激间隔下鉴别不同类型癫痫的可能性,寻找兼具敏感性和特异性的指标,设计前瞻性队列动态观察不同病程阶段的单/双脉冲TMS参数变化与疾病转归的关系。
