益气调髓方通过骨髓间充质干细胞CD56+来源的外泌体调控软骨细胞活性的机制研究
2023-03-16张扬缪毛毛化昊天成锋童培建
张扬,缪毛毛,化昊天,成锋,童培建
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)是一类具有多向分化、多因子分泌及免疫调节等特点的多功能干细胞[1-2]。研究发现,BM-MSCs 是一些细胞标志物的异质细胞群,不同的BM-MSCs 亚型细胞异质性程度不同、分化能力也不同[3]。最新研究表明,CD56+BM-MSCs可进行有效软骨细胞分化[4-5]。此外,BM-MSCs 被证实可通过分泌外泌体修复受损软骨组织[6-7]。
益气调髓方(下文简称“YQTS”)由黄芪、杜仲、丹参、当归、菟丝子等药物组成,具有益气活血、补益肝肾、理气止痛的功效[8],临床应用已有二十余年,疗效确切。临床研究发现,YQTS可治疗膝骨关节炎、骨质疏松等疾病,并有效促进骨髓水肿吸收、修复软骨组织,但其具体机制尚不明确。本研究探究YQTS是否通过CD56+BM-MSCs来源的外泌体调控软骨细胞活性。
1 材料与方法
1.1 实验动物
12只6~8周的雌性健康SD大鼠,体重(200±10)g,SPF级,饲养条件为室温22℃、恒湿、自由饮水。动物使用许可证号为SYXK(浙)20190010,动物实验在浙江省中医药研究院实验动物中心完成。
1.2 材料与试剂
YQTS由黄芪20 g、丹参20 g、杜仲15 g、当归20 g、菟丝子10 g、延胡索10 g组成,方中药材均购自浙江中医药大学中药饮片有限公司,将上述药材按照1∶10料液比水煎煮提取(煎煮2 次、每次1 h),过滤后合并提取液,浓缩至1 g/ml 备用。DMEM 培养基(ELGBIO,EH80243)、0.25%的胰蛋白酶(ELGBIO,EH80042)、0.2%Ⅱ型胶原酶(Gibco,17101-015)、CD56 小鼠单克隆抗体(Cell Signaling Technology,3576S)、抗CollagenⅡ抗体(Abcam,ab188570)、抗Aggrecan抗体(Abcam,ab3778)、GAPDH单克隆抗体(Cell Signaling Technology,5174S)、抗兔IgG HRP连接抗体(Cell Signaling Technology,7074S)、间充质干细胞成软骨诱导分化试剂盒(iCell Bioscience,iCell-MSCYD-003)、CCK-8试剂盒(Solarbio,CA1210)、逆转录试剂盒(Yeasen,11119ES60)、荧光定量PCR试剂盒(Yeasen,10102ES08)、BCA 试剂盒(Thermo Scientific,23227)、PVDF 膜、BSA 试剂、外泌体提取试剂盒(Rengen Biosciences,EXORG10B-1)。
1.3 实验方法
1.3.1 动物分组及给药:SD大鼠适应性饲养后,随机分为YQTS 给药组6 只,采用浓缩后的YQTS 药液灌胃1.62 ml/kg,每日3 次;空白给药组6 只,采用与YQTS同等剂量的生理盐水灌胃,每日3 次。两组灌胃2 周后,均给予过量的戊巴比妥钠处死,其中两组各3只用于提取BM-MSCs进行流式细胞检测以及免疫荧光染色实验,两组各3只用于CD56+BM-MSCs外泌体的提取及后续细胞实验。
1.3.2 BM-MSCs提取:两组SD大鼠处死后,分别取胫骨和股骨,剔除表面肌肉和筋膜组织后用PBS 冲洗。将骨头从两端剪断,用注射器吸取适量培养液冲洗骨髓腔,多次冲洗致骨髓腔发白,冲洗液800 rpm/min离心4 min。重悬细胞,将细胞悬液加入预先装有淋巴细胞分离液的离心管中,保持细胞悬液在淋巴细胞分离液上层。1600 rpm/min离心15 min,离心后吸取中间白色浑浊的骨髓基质层,800 rpm/min 离心4 min。用含10%FBS的DMEM-F12培养基重悬,接种于细胞培养瓶中,置于37℃、5%CO2恒温培养箱中培养24~48 h,观察贴壁情况后换液、培养、传代,备用于后续相关实验。
1.3.3 原代软骨细胞培养及软骨细胞特异性染色:SD大鼠处死后,无菌切取关节软骨组织放入培养皿中,PBS 反复漂洗,将软骨剪成大小约1 mm3的小碎块移至离心管中。加入0.02%Ⅱ型胶原酶、DMEM-F12 培养基及双抗,倾斜放置于细胞培养箱过夜;吹打均匀后经150 目筛网过滤收集细胞,1000 rpm/min 离心8 min,吸去上清,加入10%胎牛血清的DMEM-F12培养基,置于细胞培养箱培养。7 d 后开始换液、传代,备用于后续相关实验。
BM-MSCs 加入成软骨诱导分化试剂后,弃去培养基,直接滴加甲苯胺蓝染色3~5 min。弃掉染色液,PBS冲洗2次,显微镜拍照,并统计软骨细胞数量。
1.3.4 流式细胞术检测BM-MSCs 的CD56 表达及细胞分选:BM-MSCs 经胰酶消化离心,重悬后细胞浓度为1×107/ml;两组每管各取100 μl 的细胞,使细胞数达到每管1×106;一抗孵育,空白给药组不加抗体,YQTS给药组加入CD56抗体充分混匀,4℃孵育30 min;用细胞清洗液洗涤2 次,离心弃上清后重悬细胞;二抗孵育,YQTS 给药组加入荧光标记的二抗,4℃避光孵育30 min,清洗细胞;上机检测,分析CD56+/-细胞群占总细胞的比例。
BM-MSCs胰酶消化后细胞悬浮液,1200 rpm/min离心5 min,弃上清。用含4%FBS 的PBS 重悬;加入CD56 单克隆抗体孵育,4℃避光孵育30 min,1200 rpm/min 离心5 min,弃上清,4%FBS 的PBS 重悬。按照流式分选仪的操作步骤收集分选后的CD56+BM-MSCs 细胞,清洗细胞后接种于细胞培养瓶中正常培养。
1.3.5 免疫荧光检测CD56表达:两组细胞分别铺细胞爬片,每个爬片1.5×105个细胞,放入细胞培养箱中培养24 h。细胞贴壁后,取出爬片,甲醇固定,PBS清洗,用免疫组织化学笔画圈,用羊血清封闭液封闭。一抗加于细胞爬片,4℃避光孵育过夜,PBS清洗。二抗4℃避光孵育过夜,弃去二抗,PBS清洗,DAPI避光孵育,PBS清洗。荧光显微镜下拍照。
1.3.6 外泌体的提取与电镜鉴定:收集CD56+BM-MSCs细胞上清液,4℃,300×g,离心10 min 后小心吸取上清,上清加入超滤管离心管,3500×g 离心30 min,吸取浓缩液,用外泌体提取试剂盒提取后,0.22 μm 过滤器过滤,BCA 试剂盒测外泌体浓度后备用。透射电镜观察并鉴定外泌体。
1.3.7 细胞共培养:分别进行下述三种共培养。
CD56+BM-MSCs 与BM-MSCs 共培养:采用Transwell小室,上室接种空白给药组的CD56+BM-MSCs或YQTS 给药组的CD56+BM-MSCs,下室接种未经处理的空白组BM-MSCs,置于细胞培养箱中培养。待其贴壁后,将0.4 μm 孔径Transwell 小室加入6 孔板孔中,培养稳定后,在下室中加入软骨细胞诱导分化试剂,分化完成后进行甲苯胺蓝染色及后续实验。
CD56+BM-MSCs 外泌体与软骨细胞共培养:原代软骨细胞稳定培养后,分别加入20 μg 的YQTS 给药组的CD56+BM-MSCs 外泌体及空白给药组的CD56+BM-MSCs外泌体进行共培养。
CD56+BM-MSCs 外泌体与BM-MSCs 共培养:BM-MSCs 稳定培养后加入软骨细胞诱导分化试剂后,加入YQTS 给药组的CD56+BM-MSCs 外泌体20 μg(用PBS 混悬),并以等量的PBS 溶液作为PBS对照组,诱导分化10 d 后进行软骨细胞特异性染色及后续实验。
1.3.8 CCK-8 法检测细胞存活率:将细胞悬液均匀接种在6 孔板中,置于培养箱中培养。经过一系列共培养或给药处理后,按照CCK-8试剂盒说明书,避光加入适量CCK-8试剂,于培养箱中培养0.5 h,于450 nm处测定吸光度。细胞存活率%=(YQTS 给药组吸光度/空白给药组吸光度)×100%。
1.3.9 qRT-PCR 检测mRNA 表达:使用Trizol 提取细胞总RNA,按照逆转录试剂盒说明书进行反转录。荧光定量PCR 反应体系:2x SYBR(由杭州博日科技提供)10 μl,上下引物1 μl,cDNA(由上海生工生物提供)2 μl,ddH2O 6 μl。扩增程序:94℃ 2 min;94℃10 s;60 ℃ 30 s共进行40个循环。TypeⅡCollagen上引物为5'-CAGAGTGGAAGAGCGGAGAC-3',下 引物 为5'-GCCGTTCATGGTCTCTCCAA-3';Aggrecan上引物 为5'-AATCCAGAACCTTCGCTCCAA-3',下引物为5'-GGGCTCGGTCAAAGTCCAGT-3'。
1.3.10 western blot 检测蛋白表达:使用全蛋白提取试剂盒和BCA试剂盒提取并测定细胞蛋白质浓度,100℃变性5 min。使用10%聚丙烯酰胺凝胶,上样20 μg、120 V、2 h。电泳结束后转移至PVDF 膜,5%BSA 室温下封闭1 h。一抗Ⅱ型胶原(1∶1000),Aggrecan(1∶1000),4℃孵育过夜。次日进行PBST/TBST 洗涤,加入二抗(1∶2000),室温孵育1 h。PBST/TBST 洗涤,化学发光底物试剂检测,实验结果导入Image Lab软件,对蛋白灰度值进行分析。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。计量资料以均数±标准差表示,采用独立样本t检验。
2 结果
2.1 YQTS增加CD56+ BM-MSCs数量
两组给药后SD大鼠的BM-MSCs并进行培养、标记及流式检测,结果显示与空白给药组比较,YQTS给药组BM-MSCs的CD56表达明显增加(P=0.001,图1)。免疫荧光结果表明,与空白给药组比较,YQTS给药组BM-MSCs 中CD56 的荧光强度有明显增强。上述结果均表明YQTS 促进CD56+BM-MSCs 的比例增加(图1)。
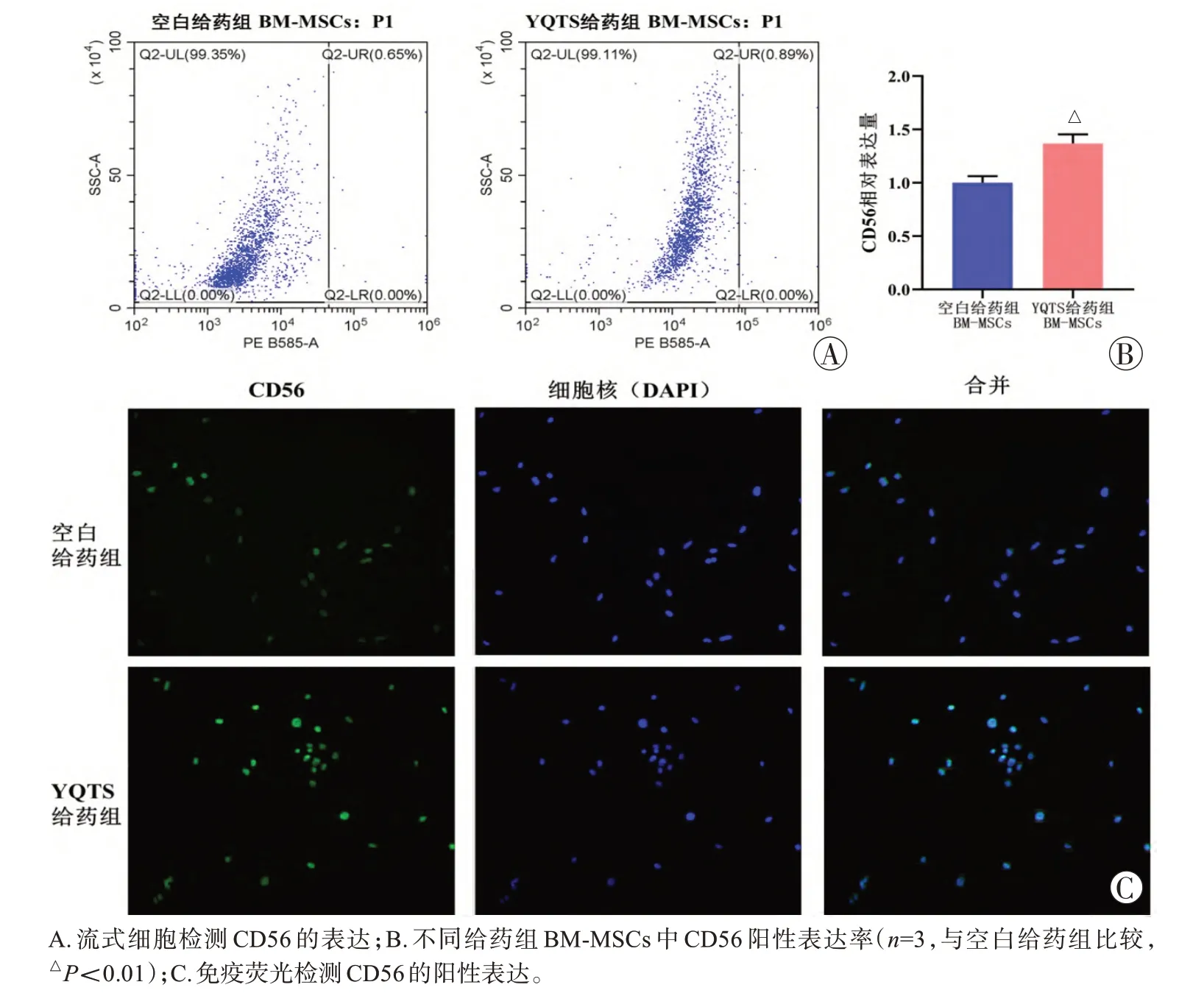
图1 YQTS对CD56+ BM-MSCs的影响
2.2 YQTS 处理的CD56+ BM-MSCs 对BM-MSCs 软骨分化的影响
Transwell 小室上室接种空白给药组及YQTS 给药组的CD56+BM-MSCs(接种约4000个细胞),下室接种BM-MSCs(接种约2×105个细胞),并在下室中加入诱导分化试剂,诱导软骨分化(图2A)。分化完成后进行甲苯胺蓝染色,染色结果表明,与诱导剂作用下比较,空白给药组CD56+BM-MSCs 与YQTS 给药组CD56+BM-MSCs 软骨分化效果较好(P=0.002,P<0.001,图2B、C),且与空白给药组的CD56+BM-MSCs比较,YQTS给药组的CD56+BM-MSCs能有效提高下室BM-MSCs的成软骨分化能力(P=0.009,图2B、C)。qRT-PCR结果表明,与诱导剂作用下比较,空白给药组和YQTS 给药组处理的CD56+BM-MSCsⅡ型胶原的mRNA表达上升(P<0.001,P<0.001,图2D)、Aggrecan的mRNA表达上升(P=0.001,P<0.001,图2D),且YQTS给药组较空白给药组CD56+BM-MSCs,Ⅱ型胶原的mRNA 表达上升(P=0.002,图2D)、Aggrecan的mRNA表达上升(P=0.001,图2D)。Western blot结果表明,与诱导剂作用下比较,空白给药组和YQTS 给药组CD56+BM-MSCs能促进软骨细胞分化过程中的Ⅱ型胶原蛋白表达(P=0.030,P<0.001,图2E、F)、Aggrecan 蛋白表达(P=0.001,P<0.001,图2E、F),且YQTS给药组较空白给药组能进一步提高Ⅱ型胶原蛋白和Aggrecan蛋白表达(P=0.002,P=0.009,图2E、F)。

图2 YQTS处理的CD56+ BM-MSCs对BM-MSCs软骨分化的影响
2.3 YQTS 处理的CD56+ BM-MSCs 的外泌体对BM-MSCs软骨分化影响
2.3.1 YQTS 处理的CD56+BM-MSCs 外泌体促进软骨细胞增殖:提取CD56+BM-MSCs 的外泌体进行鉴定。根据电镜及纳米颗粒跟踪分析仪结果显示,外泌体呈现典型的脂质双分子层结构,且颗粒大小在30~150 nm(图3B)。
96 孔板中每孔接种2000 个软骨细胞,贴壁24 h,各加入20 μg 的YQTS 给药组和空白给药组的CD56+BM-MSCs外泌体培养48 h,CCK-8检测结果示YQTS 给药组的CD56+BM-MSCs 外泌体与软骨细胞共培养后,软骨细胞增殖率高于空白给药组的CD56+BM-MSCs外泌体(P=0.012,图3C),表明YQTS处理的CD56+BM-MSCs外泌体促进软骨细胞增殖。
2.3.2 YQTS 处理的CD56+BM-MSCs 的外泌体促进BM-MSCs软骨分化:接种BM-MSCs(约2 万个细胞)于35 mm 皿,各给药组均加入诱导分化试剂,分别加入PBS 对照组及YQTS 给药组的CD56+BM-MSCs外泌体20 μg(PBS混悬),诱导分化约10 d,用软骨染色试剂盒检测下室软骨分化程度,结果显示与不加外泌体的PBS 对照组相比,加入YQTS 给药组的CD56+BM-MSCs外泌体处理的BM-MSC软骨分化程度更高,分化效果更为明显(P<0.001,图3E、F)。
qRT-PCR 结果表明,与不加外泌体的PBS 对照组比较,加入YQTS 给药组的CD56+BM-MSCs 外泌体后,Aggrecan 和Ⅱ型胶原的mRNA 表达均显著上升(P=0.002,P=0.002,图3G),说明YQTS 处理的CD56+BM-MSCs 外泌体对BM-MSC 的Ⅱ型胶原、Aggrecan的mRNA表达有促进作用。
Western blot 结果显示,与不加外泌体的PBS 对照组比较,加入YQTS给药组的CD56+BM-MSCs外泌体后,Aggrecan蛋白水平有所提升(P=0.005,图3H、I),Ⅱ型胶原蛋白水平显著升高(P<0.001,图3H、I),说明YQTS处理的CD56+BM-MSCs外泌体对BM-MSCs的Ⅱ型胶原和Aggrecan的蛋白表达有促进作用。
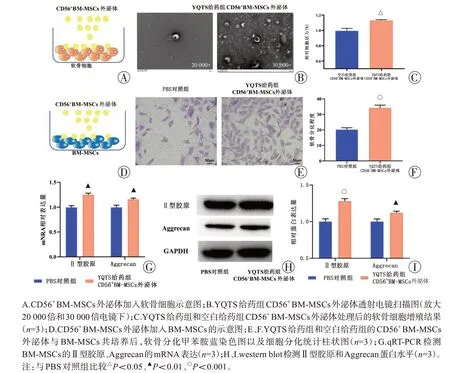
图3 YQTS处理的CD56+BM-MSCs外泌体对BM-MSCs软骨分化的影响
3 讨论
软骨是一种由致密细胞外基质组成的高度结缔组织,软骨细胞是软骨组织中的功能细胞,也是分泌细胞外基质的唯一效应细胞[9-10]。因软骨及软骨细胞的再生能力及自我修复能力有限,常导致骨关节炎等各类骨科疾病的发生[11-12]。近年来,BM-MSCs 在关节软骨上的作用受到广泛而持续地关注,但由于BM-MSCs种类的复杂性、多样性,使得其维持分化成软骨表型仍是一项重大挑战[13]。研究表明,BM-MSCs是一些细胞标志物的异质细胞群,不同的细胞亚群具有不同的标志物,且分布、分化过程均不同。近年来,单细胞RNA测序(single-cell RNA sequencing)技术为探究BM-MSCs的异质细胞亚群提供了新的方法[14-15]。运用单细胞RNA测序技术在LEPR+/CD45-BM-MSCs中鉴定出不同的细胞亚型,其中表达CD56亚型具有软骨分化潜能,被视为软骨细胞前体,且该细胞亚群主要位于生长板。另有研究表明,CD56+BM-MSCs 在不同异质性骨髓间充质干细胞中表达有差异,且CD56 介导软骨前体细胞与软骨细胞的细胞间通讯[16]。因此,推测CD56+BM-MSCs可能是BM-MSCs修复软骨损伤过程中主导细胞迁移和分化的重要细胞类型。外泌体是目前发现的介导细胞间通讯的新机制,研究表明BM-MSCs 来源的外泌体具有促进软骨细胞增殖的作用,通过介导BM-MSCs和软骨细胞之间的细胞间通讯,修复软骨损伤,减轻膝骨关节炎的疼痛[17]。BM-MSCs可通过外泌体中的miR-127-3p抑制软骨细胞中的钙黏附蛋白11,从而阻断Wnt/β-catenin通路的激活,减轻骨关节炎中软骨细胞的损伤;BM-MSCs 来源的外泌体miR-136-5p 可以促进软骨细胞迁移,抑制体内软骨变性[18-19]。
本研究团队一直致力于“髓系骨病”的研究,将骨关节炎、股骨头坏死等骨病概括为“髓系骨病”,认为其发病机制是由于患者骨枯髓减,肾虚则骨弱髓空,不能束骨而利关节也。“髓系骨病”的治法根本在于调髓,调髓治法在细胞层面的解释即指调动BM-MSCs的迁移、分化与归巢,调节成骨细胞-破骨细胞的偶联平衡及修复软骨组织等,进而恢复并维持骨稳态,达到“髓足骨健”的效果[20]。已有文献报道指出,黄芪、杜仲、菟丝子等均具有促进BM-MSCs 成软骨分化的作用[21]。基于“髓系骨病”的理论,临床上采用YQTS 治疗股骨头坏死、膝骨关节炎等骨病的疗效显著。
本研究采用YQTS 进行大鼠灌胃给药,给药后提取大鼠BM-MSCs,通过流式细胞术鉴定CD56 标记细胞亚型在BM-MSCs 中的比例显著增加,且与免疫荧光结果相同,提示YQTS 给药后增加CD56+BM-MSCs 的 数量。采用CD56+BM-MSCs 与BM-MSCs 共培养的细胞模型,结果发现YQTS 给药后提取的CD56+BM-MSCs 能促进BM-MSCs 的软骨分化,并增加软骨分化标志物Ⅱ型胶原、Aggrecan的表达。在上述实验结果的基础上,进一步对CD56+BM-MSCs 来源的外泌体进行提取,并将其与BM-MSCs共培养,发现CD56+BM-MSCs来源的外泌体能显著提高BM-MSCs 的软骨分化效能。上述结果证实,YQTS 的调髓机制可能是通过促进CD56+BM-MSCs 亚型的增殖及CD56+BM-MSCs 来源的外泌体的分泌,进而促进软骨分化(图4)。
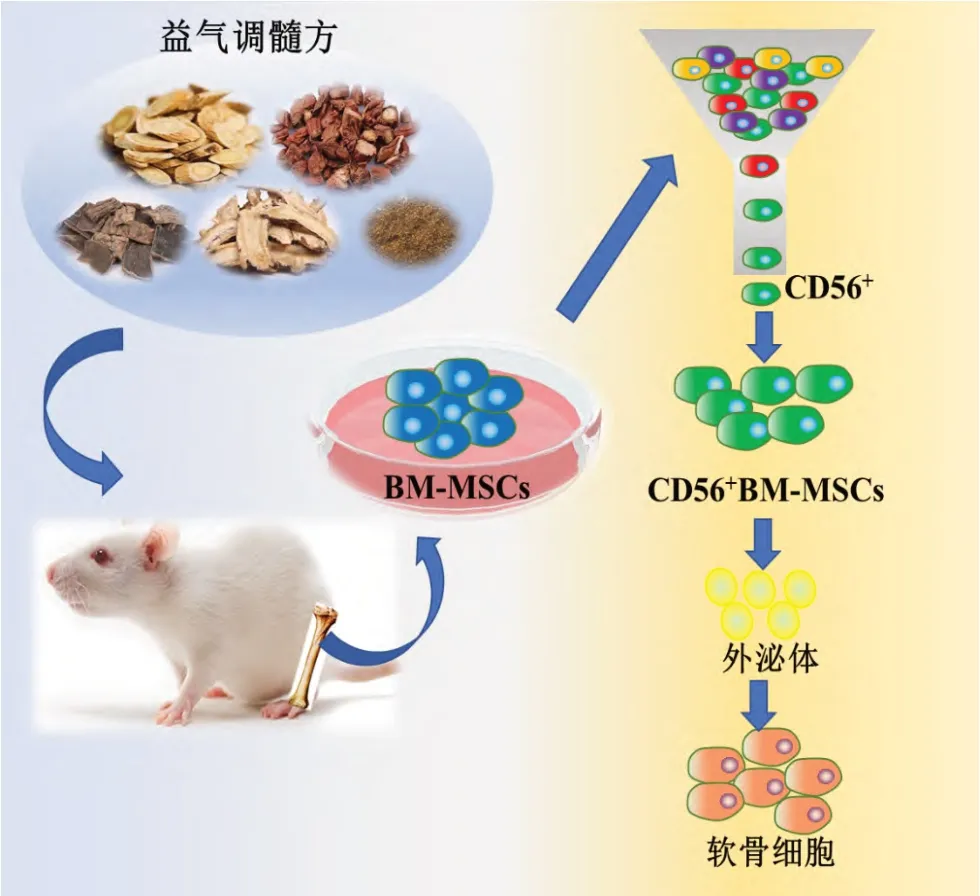
图4 实验流程图及益气调髓方的作用机制图
本研究尚存不足之处:①未对外泌体中具体发挥作用的mRNA 或miRNA 未做进一步研究,有待于后续研究完善;②中药复方中具体哪些效物质发挥作用有待于进一步研究。
4 结论
综上所述,明确了YQTS 在调控BM-MSCs 中CD56 标记的细胞亚型中的作用,并初步阐明其通过CD56+BM-MSCs来源的外泌体发挥改善软骨细胞功能的作用。YQTS 的药效物质基础及体内的具体作用机制尚有待进一步验证。
【利益冲突】所有作者均声明不存在利益冲突
