α7nAChR激动剂经内质网应激调控NLRP3炎症小体改善缺氧缺血性脑损伤的分子机制研究*
2023-03-15蔡群张晓群张志军沈丽媛
蔡群,张晓群,张志军,沈丽媛
(1.南通大学附属医院 儿科,江苏 南通 226001; 2.南通大学医学院 解剖教研室,江苏 南通 226001)
缺氧缺血性脑损伤(hypoxic ischemic brain damage, HIBD)作为临床常见的新生儿神经疾病之一,若干预不及时可导致智力发育不足、癫痫等后遗症,给家庭和社会带来较大的影响[1]。α7烟碱型乙酰胆碱受体(α7nAChR)主要表达在巨噬细胞表面,经其配体激活后参与胆碱能抗炎通路,可降低机体炎症水平。有研究[2]发现,α7nAChR激动剂能减轻HIBD大鼠的神经系统损伤,可能与其抑制炎症作用有关。NOD样受体热蛋白结构域相关蛋白3(NLRP3)是一种能被多种外源物质及自身危险信号激活的炎症小体,目前已经发现其参与了多种神经系统炎症相关疾病[3]。此外,内质网应激(endoplasmic reticulum stress, ERS)参与激活NLRP3,但在不同类型细胞中的具体调控机制不同[4]。本研究拟探讨α7nAChR激动剂通过介导ERS调控NLRP3炎症小体表达对HIBD的影响及可能机制。
1 材料与方法
1.1 实验动物、试剂及仪器
实验动物:选择出生7 d左右的SPF级SD雄性大鼠48只,体重11~14 g,每12 h昼夜灯光轮流照射,环境温度22~24 ℃,自由取食和饮水。所有大鼠均由北京维通利华动物技术有限公司提供[动物生产许可证号:SCXK(京)2019-0008;动物使用许可证号:SYXK(京)2020-0024]。本研究严格遵守3R原则并经医院动物委员会批准。试剂:α7nAChR激动剂PNU282987(上海碧云天生物技术有限公司),白细胞介素-18(IL-18)、白细胞介素-1β(IL-1β)ELISA试剂盒(合肥莱尔生物科技有限公司),TTC染色试剂盒(上海联迈生物工程有限公司),苏木精-伊红染液(上海信帆生物科技有限公司),TUNEL检测试剂盒(美国Roche公司),BCA蛋白定量试剂盒(合肥莱尔生物科技有限公司)。仪器:小动物行为分析系统(上海欣软信息科技有限公司XR-Xmaze型),酶标仪(型号:ST-MB96A,山东三体仪器有限公司),倒置显微镜(型号:CKX53,日本奥林巴斯株式会社),电泳仪(型号:16-8033,美国伯乐公司)。
1.2 实验动物分组、模型复制及给药
48只大鼠随机分为假手术组(S组)、模型组(HIBD组)、HIBD +α7nAChR激动剂PNU282987组(HP组),每组16只。HIBD组和HP组大鼠均进行HIBD模型复制;S组进行假手术,不做结扎和缺氧处理。HIBD组和HP组均采用改良Rice法复制HIBD模型:腹腔注射2%戊巴比妥钠麻醉,仰卧固定在实验台上,碘伏消毒颈部,颈部正中偏左纵行5 mm切开皮肤,钝性分离皮下组织和肌肉,暴露颈动脉三角区,剥离出迷走神经,采用5-0丝线结扎颈总动脉近心端和远心端,缝合消毒。术后将幼鼠放回母鼠旁休息1 h后放置在缺氧箱(92% N2+ 8% O2)中缺氧处理2.5 h,缺氧过程大鼠出现晃头、抽搐,缺氧处理结束后出现肢体瘫痪、站立不稳、四肢抖动、夹尾、无法自主行走等症状视为模型复制成功。HP组模型复制成功后1 h腹腔注射0.8 mg/kg PNU282987,HIBD组和S组同时间腹腔注射0.02 mL/g生理盐水。
1.3 水迷宫实验检测大鼠学习记忆能力
术后48 h每组大鼠均开展水迷宫实验,将一个圆形水池(直径= 180 cm,高= 50 cm)等分为4个象限,中央原点放置一个低于水面1 cm的圆形平台(直径= 9 cm),水中加入染料隐蔽圆台,水温保持在22~25 ℃,采用小动物行为分析系统测定大鼠逃避潜伏期和2 min内穿越圆台的次数。
1.4 酶联免疫吸附试验(ELISA)检测IL-18、IL-1β水平
水迷宫实验结束后2 h,给予大鼠注射戊巴比妥钠麻醉,抽取其外周静脉血,离心取上清液,按照ELISA试剂盒说明书进行操作,将标准品和稀释样品分别加入到时孔板,并设置空白组和空白凋零组作为对照,在孔板上粘上覆膜,室温孵育2 h后移去酶标板液体并洗涤,随后加入生物素化抗体、Streptavidin-HRP各100 μL,室温孵育后洗涤,随后显色,在450 nm波长处测定OD值,并根据标准曲线读出样本浓度,再乘以稀释倍数,计算出IL-18、IL-1β实际浓度。
1.5 HE染色观察脑组织病理改变
取大脑组织并在4% 甲醛中固定过夜,石蜡包埋、切片,经二甲苯和酒精脱蜡置水后进行HE染色,光学显微镜下观察脑组织形态变化。
1.6 TTC染色法检测脑梗死面积
将各实验组大鼠断头法处死,取出完整大脑置于-20 ℃冰箱冷冻20 min后取出,快速自前脑额极平行切成厚度约2 mm的冠状切片,将其放入TTC染液中避光孵育20 min,每隔5 min将切片翻转1次,染色结束后取出,用PBS冲洗干净,相机拍照。脑梗死面积百分比(%)=梗死面积/横切片总面积×100%。
1.7 TUNEL法检测大脑皮质、海马CA1区神经细胞凋亡情况
按照1.6中方法获取各组大鼠脑组织及左侧海马体石蜡切片,采用TUNEL染色试剂盒检测神经细胞凋亡,找到每张切片上大脑皮质、海马CA1区域,光学显微镜下观察,棕黄、棕褐色细胞为凋亡细胞,蓝色为正常细胞。随机选择5个高倍镜视野,计算细胞凋亡,细胞凋亡率(%)=凋亡细胞数/视野总细胞数×100%。
1.8 Western blotting检测脑组织中NLRP3、GRP78、CHOP蛋白表达
取各组大鼠左侧海马组织在冰上研磨并加入细胞裂解液,取上清液采用BCA标准蛋白定量化测定蛋白浓度,合格后取50 μL样品进行SDSPAGE电泳,转膜、封闭,分别加入NLRP3、葡萄糖调节蛋白78(glucose regulated protein78, GRP78)、C/EBP同源蛋白(C/EBP homologous protein, CHOP)一抗(稀释浓度均为1∶1 000)孵育过夜、加二抗室温孵育2 h,加入ECL显色液在暗室下曝光显影,以β-actin为内参,计算NLRP3、GRP78、CHOP蛋白相对表达量。
1.9 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,多组的比较用方差分析,进一步两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠水迷宫实验逃避潜伏期和穿越圆台次数的比较
水迷宫实验结果显示,S组、HIBD组及HP组逃避潜伏期、穿越圆台次数比较,经方差分析,差异有统计学意义(P<0.05),HIBD组和HP组逃避潜伏期较S组延长(P<0.05),穿越圆台次数较S组减少(P<0.05);HP组逃避潜伏期较HIBD组缩短(P<0.05),穿越圆台次数较HIBD组增加(P<0.05)。见表1。
表1 3组大鼠水迷宫实验逃避潜伏期和穿越圆台次数的比较 (n =16,±s)
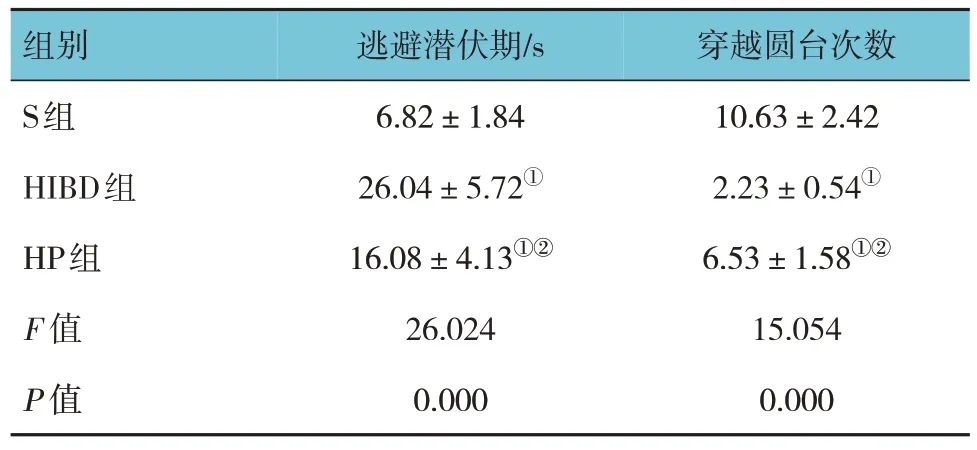
表1 3组大鼠水迷宫实验逃避潜伏期和穿越圆台次数的比较 (n =16,±s)
注 : ①与S组比较,P <0.05; ②与HIBD组比较,P <0.05。
组别S组HIBD组HP组F 值P 值逃避潜伏期/s 6.82±1.84 26.04±5.72①16.08±4.13①②26.024 0.000穿越圆台次数10.63±2.42 2.23±0.54①6.53±1.58①②15.054 0.000
2.2 3组大鼠血清IL-18、IL-1β水平比较
ELISA检测结果显示,S组、HIBD组和HP组IL-18、IL-1β水平比较,经方差分析,差异有统计学意义(P<0.05),HIBD组和HP组IL-18、IL-1β水平较S组升高(P<0.05),HP组IL-18、IL-1β水平较HIBD组降低(P<0.05)。见表2。
表2 3组大鼠血清IL-18、IL-1β水平的比较(n =16,pg/mL,±s)
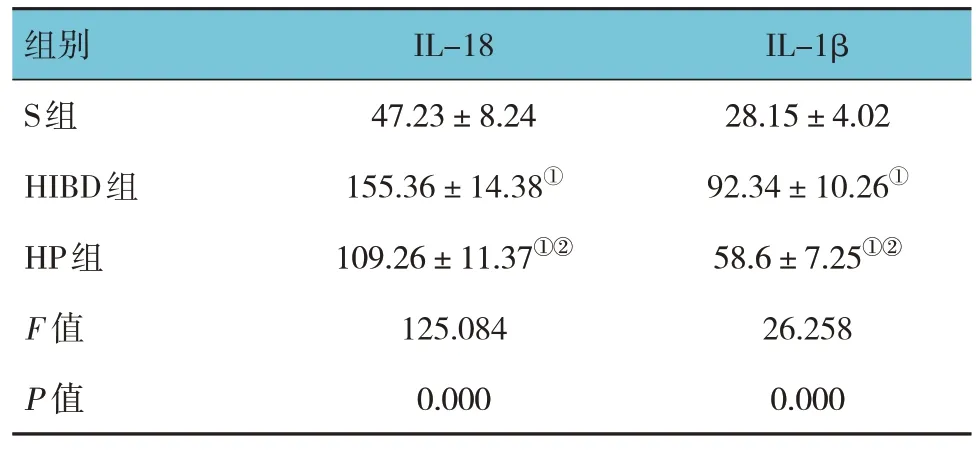
表2 3组大鼠血清IL-18、IL-1β水平的比较(n =16,pg/mL,±s)
注 : ①与S组比较,P <0.05; ②与HIBD组比较,P <0.05。
组别S组HIBD组HP组F 值P 值IL-18 47.23±8.24 155.36±14.38①109.26±11.37①②125.084 0.000 IL-1β 28.15±4.02 92.34±10.26①58.6±7.25①②26.258 0.000
2.3 3组大鼠脑组织病理改变
HE染色结果显示,S组脑皮层完整,细胞排列正常,无明显神经元损伤;HIBD组可见脑皮层神经元排列较为紊乱,细胞间隙变宽,细胞膜破裂;HP组神经元排列紊乱,水肿程度、坏死程度较HIBD组轻。见图1。

图1 3组大鼠脑组织病理改变 (HE染色×400)
2.4 3组大鼠脑梗死面积比较
TTC染色结果显示,S组、HIBD组和HP组脑梗死面积的占比分别为(0.02±0.01)%、(27.16±4.38)%、(18.29±3.96)%,经方差分析,差异有统计学意义(F=256.158,P=0.000)。其中S组无明显梗死灶,HIBD组和HP组均可见白色梗死灶,HP组梗死面积占比明显低于HIBD组(P<0.05)。见图2。
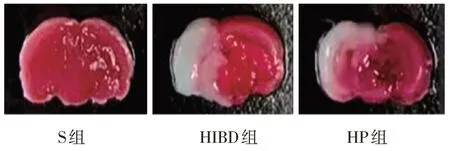
图2 大鼠脑梗死面积 (TTC染色)
2.5 3组大鼠脑皮层、海马CA1区神经细胞凋亡率比较
TUNEL法检测结果显示,S组、HIBD组和HP组脑皮层和海马CA1区神经细胞凋亡率比较,经方差分析,差异有统计学意义(P<0.05),HIBD组和HP组脑皮层和海马CA1区神经细胞凋亡率较S组升高(P<0.05),HP组脑皮层和海马CA1区神经细胞凋亡率较HIBD组降低(P<0.05)。见表3。
表3 3组大鼠脑皮层、海马CA1区神经细胞凋亡率比较 (n =16,%,±s)
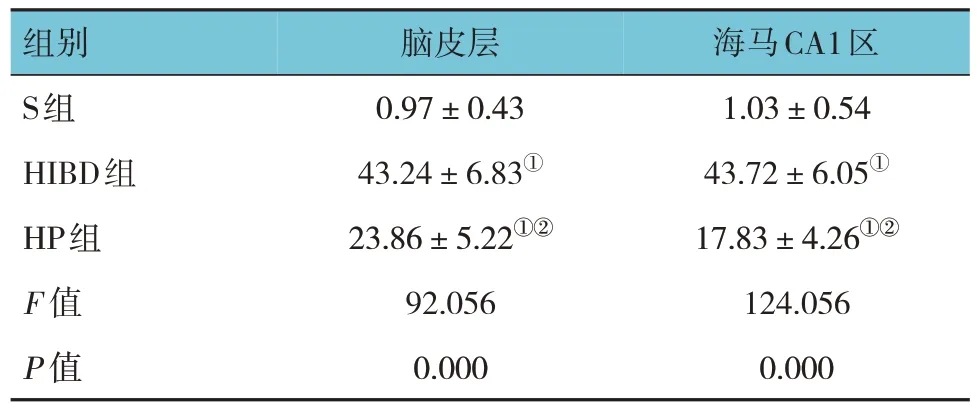
表3 3组大鼠脑皮层、海马CA1区神经细胞凋亡率比较 (n =16,%,±s)
注 : ①与S组比较,P <0.05; ②与HIBD组比较,P <0.05。
组别S组HIBD组HP组F 值P 值脑皮层0.97±0.43 43.24±6.83①23.86±5.22①②92.056 0.000海马CA1区1.03±0.54 43.72±6.05①17.83±4.26①②124.056 0.000
2.6 3组大鼠脑组织中NLRP3、GRP78、CHOP蛋白表达比较
Western blotting检测结果显示,S组、HIBD组和HP组NLRP3、GRP78、CHOP蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),HIBD组、HP组NLRP3、GRP78、CHOP蛋白相对表达量较S组升高(P<0.05),HP组NLRP3、GRP78、CHOP蛋白相对表达量较HIBD组降低(P<0.05)。见 表4和图3。

图3 3组大鼠脑组织中NLRP3、GRP78、CHOP蛋白表达
表4 3组大鼠脑组织中NLRP3、GRP78、CHOP蛋白相对表达量比较 (n =16,±s)
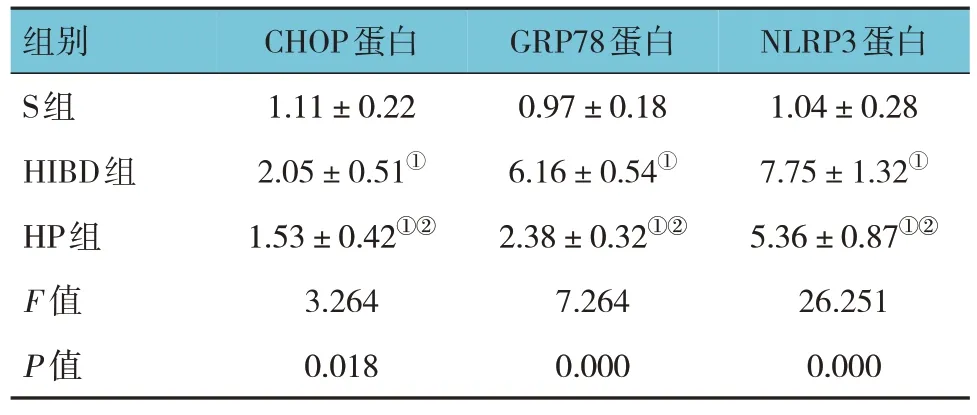
表4 3组大鼠脑组织中NLRP3、GRP78、CHOP蛋白相对表达量比较 (n =16,±s)
注 : ①与S组比较,P <0.05; ②与HIBD组比较,P <0.05。
组别S组HIBD组HP组F 值P 值CHOP蛋白1.11±0.22 2.05±0.51①1.53±0.42①②3.264 0.018 GRP78蛋白0.97±0.18 6.16±0.54①2.38±0.32①②7.264 0.000 NLRP3蛋白1.04±0.28 7.75±1.32①5.36±0.87①②26.251 0.000
3 讨论
HIBD多由围生期窒息所引发的新生儿脑损伤疾病,其病理机制与炎症所引发的神经元炎症因子浸润和神经细胞凋亡密切相关[5]。目前HIBD尚无确切有效的治疗方法,临床常采用的亚低温治疗,预后并不十分理想[6],而深入了解HIBD发病机制对寻找更有效的治疗方法具有重要意义。
α7nAChR是一种表达在神经细胞、免疫细胞等多种细胞表面的配体依赖性离子通道受体,主要有抗炎作用[7-8]。相关研究[9]显示,α7nAChR激动剂能通过抑制炎症因子表达改善体循环引发的大鼠脑损伤,但在HIBD中的作用尚不明确。本研究结果显示,HIBD模型复制成功后,HIBD组大鼠逃避潜伏期延长,穿越圆台次数减少,表现为大脑神经功能异常,而在注射α7nAChR激动剂后HP组大鼠逃避潜伏期缩短,穿越圆台次数增加,提示α7nAChR激动剂可改善大鼠大脑神经功能。HE染色结果也证实了这一点。此外,HIBD组、HP组脑梗死面积占比、脑皮层和海马CA1区神经细胞凋亡比例较S组升高,HP组脑梗死面积占比、脑皮层和海马CA1区神经细胞凋亡率较HIBD组降低,表明α7nAChR激动剂可能通过减少神经细胞凋亡来改善神经功能,而炎症因子的大量表达可能参与了此过程[10]。
NLRP3是NLR家族研究最多的炎症小体,目前已经发现其参与了HIBD的发生、发展过程[11]。相关研究[12-14]显示,巨噬细胞、胶质细胞等免疫细胞可在多种炎症因子的刺激下激活细胞质中NLRP3炎症小体,如外界炎症信号诱导的ERS可通过K+外流、溶酶体损伤模型和活性氧(ROS)途径激活NLRP3。本次研究发现,HIBD组、HP组NLRP3、GRP78、CHOP蛋白相对表达量较S组升高,HP组NLRP3、GRP78、CHOP蛋白相对表达量较HIBD组降低,提示α7nAChR激动剂可能通过抑制ERS途径相关GRP78/CHOP通路蛋白表达来降低脑组织中NLRP3炎症小体的表达。马度芳等[15]发现,α7nAChR激动剂能抑制ERS途径和稳定线粒体功能,减少ROS释放;而ROS大量释放可刺激NLRP3炎症小体激活[16],这可能是α7nAChR激动剂能降低NLRP3表达的原因之一。而NLRP3炎症小体激活后可通过相关信号促进IL-18、IL-1β等炎症因子的成熟和大量表达,释放的IL-18、IL-1β可募集更多其他的炎症因子和细胞,导致脑组织炎症损伤[17-18]。本研究结果显示,HIBD组、HP组血清IL-18、IL-1β水平较S组升高,HP组血清IL-18、IL-1β水平较HIBD组降低,提示α7nAChR激动剂能降低HIBD大鼠体内的炎症水平。LEAVY等[19]认为,脑组织受损及神经细胞能量代谢紊乱能诱导机体发生ERS,出现错误折叠和未折叠的蛋白聚集,激活NLRP3和相关炎症因子的表达,导致大鼠发生脑梗死和神经功能障碍。BECKMANN等[20]研究发现,新生大鼠与成年大鼠在HIBD实验中NLRP3表达出现峰值时间存在差异,可能与HIBD的不同发展阶段有关,具体情况有待进一步研究论证。
综上所述,α7nAChR激动剂可改善大鼠HIBD脑损伤,其机制可能与抑制ESR途径、降低NLRP3炎症小体表达有关,NLRP3及相关炎症因子的表达在大鼠神经元损伤及神经细胞凋亡中发挥了保护作用,这可能为HIBD治疗药物研究提供新的思路和方向。
