唑来膦酸联合依西美坦治疗激素受体阳性老年乳腺癌的疗效及安全性研究*
2023-03-15王绪麟刘新梅王丽华孟娟
王绪麟,刘新梅,王丽华,孟娟
(海口市人民医院 1.乳腺甲状腺外科,2.肿瘤内科,海南 海口 570100)
乳腺癌的发病率占女性恶性肿瘤的首位,根据2018年国际癌症研究机构调查显示,全球乳腺癌的发病率高达24.2%[1]。乳腺癌早期大多无明显症状,多以乳房肿块、乳头溢液等局部症状为主,常被患者忽视。病情发展至中晚期时,癌细胞侵袭范围扩大及癌细胞发生远处转移累及多器官病变,影响患者预后。激素受体阳性是指雌激素受体(estrogen receptor, ER)及孕激素受体(progesterone receptor, PR)均表现为阳性,激素受体阳性乳腺癌患者占乳腺癌患者的60%左右,以疼痛、高钙血症等症状为主要表现[2-3]。因此,及时采取积极的对症治疗对改善病情、预防骨性病变尤为关键。除常规手术及放化疗治疗外,内分泌治疗已被美国国立综合癌症网络指南推荐用于对激素敏感的乳腺癌[4]。依西美坦是临床常用的抗肿瘤药物,通过不可逆地与芳香酶活性位点结合而使其失活,降低绝经妇女血液循环中的雌激素水平[5-6]。唑来膦酸属于二磷酸盐类药物,对矿化骨具有较高的亲和性,可抑制破骨活性增加所致的骨吸收[7]。研究[8]发现,高龄女性易合并不同程度的骨质疏松,而芳香化酶抑制剂治疗可能会降低老年患者骨密度,增加骨质增生。唑来膦酸与内分泌药物联合使用可发挥抗肿瘤协同效应,同时可治疗因内分泌药物引起的骨量丢失。本研究采用唑来膦酸联合依西美坦治疗激素受体阳性老年乳腺癌,观察其疗效与安全性。
1 资料与方法
1.1 一般资料
选取2018年4月—2021年4月海口市人民医院收治的106例激素受体阳性老年乳腺癌患者纳入本研究。按照随机数字表法分为对照组和观察组,每组53例。患者年龄60~81岁,平均(53.46±5.37)岁;体质量指数(BMI)21.6~26.3 kg/m2,平均(23.62±3.45)kg/m2;病程3~8年,平均(4.24±1.08)年;病理TNM分期:Ⅱ期41例,Ⅲ期39例,Ⅳ期26例;手术方式:保乳手术45例,改良根治术35例,乳房切除术26例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性(见表1)。本研究经医院医学伦理委员会批准。

表1 两组一般资料比较 (n =53)
1.2 纳入和排除标准
纳入标准:①符合中国抗癌协会乳腺癌诊治指南与规范(2015版)[9]的诊断标准,且经病理确诊;②经免疫组织化学检查提示ER和/或PR均呈阳性;③年龄> 70岁;④近期内未服用过相关药物治疗;⑤既往无手术、放化疗治疗史;⑥均已绝经;⑦骨密度< -1.0 SD;⑧均签署知情同意书。排除标准:①合并其他恶性肿瘤;②对本次药物过敏;③合并精神疾病或认知功能障碍。
1.3 治疗方法
1.3.1 对照组 对照组予以基础治疗,根据患者的自身状况选择手术及放化疗治疗。在此基础上常规给予活性维生素D钙剂,饭后口服依西美坦片(进口药品批准文号:H20160052,规格:25 mg,辉瑞有限公司)25 mg,1 次/d,共服用12个月。
1.3.2 观察组 观察组在对照组治疗基础上给予注射用唑来膦酸(国药准字H20064298,规格:4 mg,江苏奥赛康药业有限公司)加入至100 mL氯化钠注射液(0.9%),静脉注射。1次/月,治疗12个月。两组手术均由同一医生完成。
1.4 观察指标
1.4.1 治疗疗效 参照WHO实体瘤客观疗效评价标准评估疗效,完全缓解(CR):经临床检查结果及影像学提示肿瘤完全消失,且持续时间>4 周;部分缓解(PR):经治疗后肿瘤病灶最大径及最大垂直径的乘积减小>50%,且持续时间>4 周;稳定(NC):病灶无明显变化,且仍需接受8 周的治疗才可进行评价;疾病进展(PD):转移灶体积呈现增大或出现新病灶。总有效率=(CR+PR)例数/总例数×100%。
1.4.2 免疫功能 于治疗前及治疗后12个月收集两组患者空腹静脉血5 mL,以3 000 r/ min离心10 min,分离血清置于-20 ℃的环境中保存待检。采用FACSVia流式细胞仪[注册证号:国械注进20172402482,碧迪医疗器械(上海)有限公司]检测CD3+、CD4+、CD8+水平,并计算CD4+/CD8+。
1.4.3 性激素 采用化学发光法(试剂盒购自上海羽哚生物科技有限公司)检测血清雌二醇(E2)、孕酮(P)、睾酮(T)水平。
1.4.4 骨标志物 使用LC-5800全自动化学发光免疫分析仪(注册证号:桂械注准20212220221,广西岚煜生物科技有限公司)检测β-胶原特殊序列(β-Cross Laps)、总骨Ⅰ型前胶原氨基端延长肽(PⅠNP)水平。
1.4.5 不良反应情况 统计两组用药期间关节疼痛、发热、恶心呕吐等不良反应发生率。
1.5 统计学方法
数据处理采用SPSS 23.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;等级资料的比较用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组疗效的比较
对照组治疗总有效率为33.96%(18/53),观察组为56.60%(30/53),两组比较,经χ2检验,差异有统计学意义(χ2=5.483,P=0.019),观察组治疗总有效率高于对照组。见表2。

表2 两组疗效比较 [n =53,例(%)]
2.2 两组免疫功能的比较
对照组与观察组治疗前各项免疫功能指标比较,经t检验,差异无统计学意义(P>0.05);治疗后各项免疫功能指标比较,经t检验,差异有统计学意义(P<0.05),观察组治疗后CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组。见表3。
表3 两组组免疫功能比较 (n =53,±s)
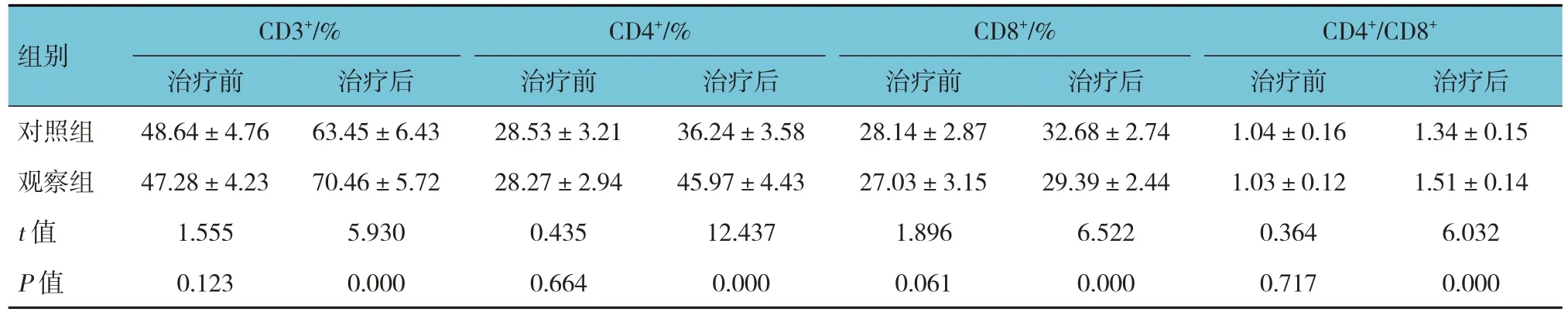
表3 两组组免疫功能比较 (n =53,±s)
组别对照组观察组t 值P 值CD3+/%治疗前48.64±4.76 47.28±4.23 1.555 0.123治疗后63.45±6.43 70.46±5.72 5.930 0.000 CD4+/%治疗前28.53±3.21 28.27±2.94 0.435 0.664治疗后36.24±3.58 45.97±4.43 12.437 0.000 CD8+/%治疗前28.14±2.87 27.03±3.15 1.896 0.061治疗后32.68±2.74 29.39±2.44 6.522 0.000 CD4+/CD8+治疗前1.04±0.16 1.03±0.12 0.364 0.717治疗后1.34±0.15 1.51±0.14 6.032 0.000
2.3 两组性激素水平的比较
对照组与观察组治疗前性激素水平比较,经t检验,差异无统计学意义(P>0.05);治疗后性激素水平比较,经t检验,差异有统计学意义(P<0.05),观察组治疗后E2、P、T水平低于对照组。见表4。
表4 两组性激素水平比较 (n =53,±s)
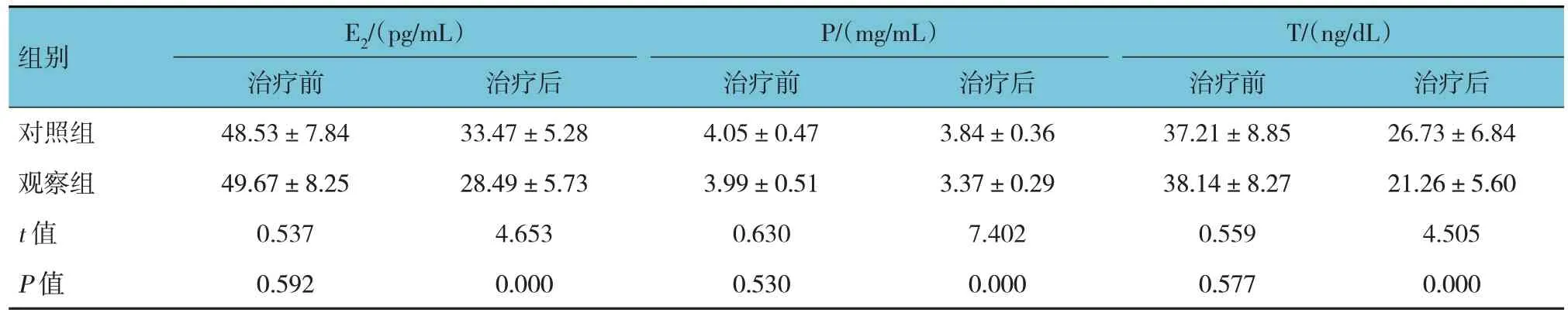
表4 两组性激素水平比较 (n =53,±s)
组别对照组观察组t 值P 值E2/(pg/mL)治疗前48.53±7.84 49.67±8.25 0.537 0.592治疗后33.47±5.28 28.49±5.73 4.653 0.000 P/(mg/mL)治疗前4.05±0.47 3.99±0.51 0.630 0.530治疗后3.84±0.36 3.37±0.29 7.402 0.000 T/(ng/dL)治疗前37.21±8.85 38.14±8.27 0.559 0.577治疗后26.73±6.84 21.26±5.60 4.505 0.000
2.4 两组骨标志物的比较
对照组与观察组治疗前骨标志物水平比较,经t检验,差异无统计学意义(P>0.05);治疗后骨标志物水平比较,经t检验,差异有统计学意义(P<0.05),观察组治疗后β-Cross Laps、PⅠNP水平较对照组降低(P<0.05)。见表5。
表5 两组骨标志物水平比较 (n =53,±s)
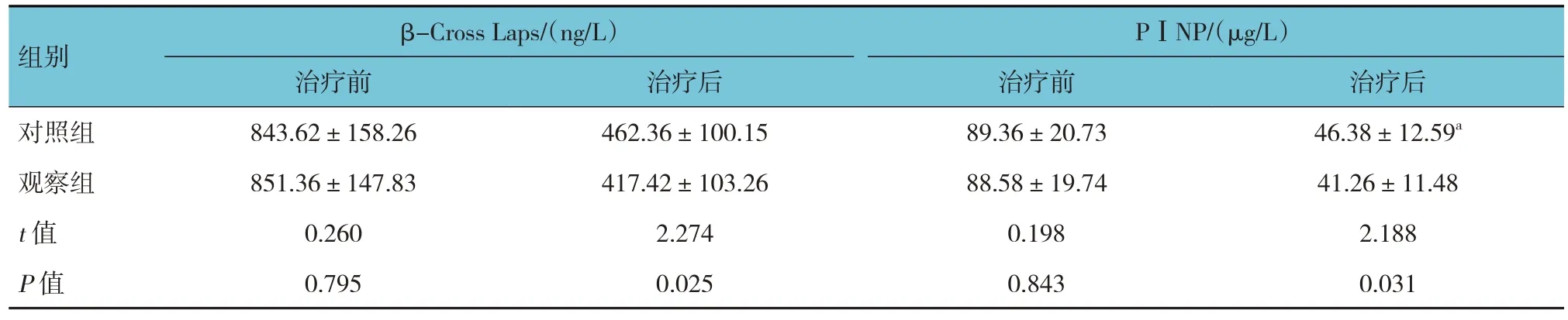
表5 两组骨标志物水平比较 (n =53,±s)
组别对照组观察组t 值P 值β-Cross Laps/(ng/L)治疗前843.62±158.26 851.36±147.83 0.260 0.795治疗后462.36±100.15 417.42±103.26 2.274 0.025 PⅠNP/(μg/L)治疗前89.36±20.73 88.58±19.74 0.198 0.843治疗后46.38±12.59a 41.26±11.48 2.188 0.031
2.5 两组不良反应情况
对照组不良反应总发生率为18.87%(10/53),观察组为28.30%(15/53),两组比较,经χ2检验,差异无统计学意义(χ2=1.039,P= 0.253)。见表6。
3 讨论
乳腺癌是世界范围内最为常见的女性恶性肿瘤,我国发病率呈逐年上升趋势。临床已有研究[10]表明,年龄是乳腺癌发生的高危因素,小于65岁群体乳腺癌的发生风险比65岁及以上的群体高。目前,临床针对激素受体阳性的老年乳腺癌患者多采用来曲唑治疗,该药可抑制芳香化酶与雌激素生物合成,减少或消除雌激素刺激肿瘤生长,但该药物在杀伤癌细胞的同时会降低淋巴细胞水平,影响患者免疫功能,且会产生一定程度的骨髓抑制[11-12]。毛启新等[13]对53例乳腺癌患者给予他莫昔芬及来曲唑治疗,结果发现,来曲唑治疗可降低髓系抑制性细胞的数量并抑制其功能,证实了上述论证。因此,寻找一种或多种科学有效的药物对提高激素受体阳性老年乳腺癌患者的疗效,改善免疫功能和骨代谢水平具有重要意义。
受疾病本身影响,加之手术、放化疗等治疗不可避免地会损伤机体正常细胞,故老年乳腺癌患者常伴有免疫功能受损。CD3+、CD4+、CD8+是人体免疫系统中非常重要的免疫细胞,其中CD4+为辅助诱导,CD8+可特异杀伤靶细胞,CD4+/CD8+比值高低可反映机体平衡状态[14]。本研究结果显示,观察组治疗后CD8+水平较对照组降低,治疗后CD3+、CD4+、CD4+/CD8+较对照组升高,治疗总有效率也较对照组高,结果提示唑来膦酸联合依西美坦用药治疗激素受体阳性老年乳腺癌疗效较佳,且可改善免疫功能,其原因在于依西美坦通过阻滞肾上腺生成的雄烯二酮转变为雌酮,降低雌激素的水平,起到抑制肿瘤细胞生长增殖的作用;联合唑来膦酸后可通过对γδT淋巴细胞的刺激活化与增殖作用,激活Fas/FASL信号通路,抑制肿瘤坏死因子-α等因子生成,从而发挥改善免疫应答、调节机体免疫组织平衡的作用[15-16]。联合用药可发挥协同效应,从诸多途径来提高患者的免疫功能。从安全角度而言,联合用药方案并未明显增加不良反应,故安全性较高。
雌激素是刺激乳腺癌细胞生长的重要因子,研究发现[17],临床有近33%的乳腺癌是在雌激素刺激下发展形成。王思等[18]回顾性分析了52例单发及多发乳腺癌患者与111例无骨转移乳腺癌患者临床资料,单发及多发骨转移组的ER与PR水平高于无转移组,提示雌激素在乳腺癌与骨转移的发生、发展中具有重要意义。乳腺癌细胞需借助骨基质细胞释放出的趋化因子或黏附分子,在结合表面细胞受体后迁移至骨组织。约近90%的骨基质是由β-Cross Laps组成,在Ⅰ型纤维原细胞构造期间PⅠNP/PⅠCP被释放入血液,故β-Cross Laps可反映骨合成情况和骨重吸收率。乳腺癌患者骨转移后发生骨质疏松,Ⅰ型胶原蛋白被分解,PⅠNP会游离至血液中,可反映骨细胞功能与骨形成。LUMACHI等[19]检测51例化疗转移性乳腺癌患者的血清标本,其中38例被确诊为骨转移,结果发现,骨转移患者的PⅠNP明显高于无骨转移患者。本研究发现,观察组治疗后血清E2、P、T、β-Cross Laps、PⅠNP水平低于对照组,结果提示唑来膦酸联合依西美坦治疗可降低性激素和骨标志物水平,抑制骨质流失。分析原因可能是依西美坦具有强效选择性,能够抑制癌细胞的增长,但长期服用可能会导致骨量的丢失,故在降低雌激素的同时尽量减少骨丢失对乳腺癌患者具有重要意义。通过联合唑来膦酸可抑制破骨细胞的活性,从而减少骨小梁的溶解;此外,唑来膦酸还能够减少骨基质生长因子的释放,抑制骨基质上黏附的癌细胞,从而减少骨吸收,达到阻滞癌细胞诱发骨性病变的目的[20]。
综上所述,唑来膦酸联合依西美坦用药治疗激素受体阳性老年乳腺癌疗效较佳,可提高免疫功能,改善骨代谢水平,且未明显增加不良反应,安全有效。但本研究仍存在一定不足:未分析治疗前与治疗后药物剂量、持续时间对手术效果的影响,故未来期待大样本量、前瞻性随机对照、多中心的研究,以证实本研究结论。
