牡蒿总黄酮的提取、纯化及抗氧化活性分析
2023-03-15张宽朝徐晨阳余佳琪苏鸿呈徐忠有
张宽朝,徐晨阳,余佳琪,苏鸿呈,徐忠有
1安徽农业大学 生命科学学院,合肥 230036;2安徽沃土稻虾养殖专业合作社,合肥 231252
牡蒿(ArtemisiajaponicaThunb.)是我国多地常见的一种菊科蒿属植物,多年生草本,植株有香气,为药食两用植物,其嫩茎叶可供食用,风味甚佳[1]。牡蒿味苦、微甘,性凉,可全草入药;具清热,凉血,解毒之功效。现代药理学研究表明,牡蒿含有丰富的黄酮类、多糖、多酚类、皂苷类以及挥发油等化合物,具有消炎、抗氧化、抗衰老等多种保健功效[2,3]。牡蒿含有的萜烯类、生物碱、类黄酮、甾类、酚类、独特的氨基酸和多糖等化学成分均具有驱虫杀虫、抗菌杀菌的活性,可用于开发植物源杀虫剂[4,5]。
黄酮类化合物是一类具有羰基的天然有机产物,因大多具有颜色,故名黄酮。作为植物中的一类重要次生代谢产物,黄酮类化合物具有重要的生理和药理作用。自然界中菊科、豆科、唇形科等双子叶植物一般含有黄酮类化合物较多。牡蒿作为菊科蒿属植物,其黄酮类化合物含量尤为丰富。
目前,牡蒿作为蔬菜食用或作为药材在传统中医药临床方剂中有较多应用,现代医药健康领域对牡蒿的药用资源开发程度仍处于较低水平[6]。国内外关于牡蒿总黄酮的研究报道较少。Gu等[7]分析了牡蒿的化学成分,从中鉴定出的牡蒿黄酮类化合物主要为茵陈色原酮、8,4′-二羟基-3,7,2′-三甲氧基黄酮、3,5-二羟基-6,7,3′,4′-四甲氧基黄酮等;Zhang等[8]研究牡蒿总黄酮的提取方法,发现85%甲醇溶液索氏提取2 h条件下牡蒿总黄酮得率最高,70%乙醇溶液提取6 h得率较次但最适用于工业生产。尚未见牡蒿总黄酮的提取、纯化工艺优化及抗氧化活性相关报道。
基于此,本研究以牡蒿地上部茎叶为试验材料,利用响应面法优化牡蒿总黄酮乙醇浸提法工艺,在此基础上探究大孔树脂对牡蒿总黄酮纯化条件,分析牡蒿总黄酮的抗氧化活性,以期为牡蒿在医药、保健和食品等领域的开发应用提供理论依据和数据参考。
1 材料与方法
1.1 实验原料
牡蒿鲜样于2021年4月采自安徽省肥西县境内。安徽农业大学生命科学学院植物学教研室鉴定为菊科蒿属牡蒿。将牡蒿鲜样于烘箱中杀青并烘干即得到牡蒿干样。干样经粉碎后过100目筛,备用。
1.2 主要药品试剂
芦丁标准品(批号MUST-21121201,中国药品生物制品检定所);维生素C(批号211026,国药集团);2,2-二(4-叔辛基苯基)-1-苦肼基自由基(DPPH,批号211229,上海源聚生物科技有限公司);2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,批号220123,上海源聚生物科技有限公司);AB-8大孔吸附树脂(上海源叶生物科技有限公司);X-5大孔吸附树脂(上海源叶生物科技有限公司);CD-180大孔吸附树脂(蚌埠天星树脂有限公司);无水乙醇、亚硝酸钠、硝酸铝、硫酸亚铁、水杨酸、铁氰化钾、三氯乙酸、三氯化铁、邻苯三酚等均为国产分析纯。
1.3 实验方法
1.3.1 芦丁标准曲线绘制
参照亚硝酸钠-硝酸铝-氢氧化钠比色法测定总黄酮含量[9]。
准确吸取0.10 mg/mL芦丁标准液0、1.00、2.00、3.00、4.00、5.00 mL,加30%乙醇溶液至5 mL,再加5%亚硝酸钠溶液0.3 mL,震荡后放置5 min,加入10%硝酸铝溶液0.3 mL,摇匀后放置6 min,加1.0 mol/mL NaOH溶液2 mL,30%乙醇定容至10 mL,摇匀,510 nm处测定吸光度值。以芦丁含量(μg)为横坐标,反应体系在510 nm下的吸光度为纵坐标,绘制标准曲线方程:y=0.001 2x-0.007 8,R2=0.999 3。
1.3.2 单因素试验
1.3.2.1 乙醇体积分数对牡蒿总黄酮提取的影响
取牡蒿待测样品1.0 g,分别加入体积分数为30%、40%、50%、60%、70%、80%的乙醇溶液40 mL,50 ℃水浴加热60 min,取出样品振摇,冷却,5 000 r/min离心。取0.5 mL上清液测定,探究不同乙醇体积分数对牡蒿总黄酮提取的影响。
1.3.2.2 乙醇用量对牡蒿总黄酮提取的影响
按上述最佳乙醇体积分数,固定提取温度为50 ℃,提取时间为60 min,乙醇用量分别为10、20、30、40、50、60、70 mL,取出样品振摇,冷却,5 000 r/min离心。取0.5 mL上清液测定,探究不同乙醇用量对牡蒿总黄酮提取的影响。
1.3.2.3 提取时间对牡蒿总黄酮提取的影响
取上述最佳乙醇体积分数及用量,固定提取温度为50 ℃,时间分别为40、60、80、100、120、140、160 min,取出样品振摇,冷却,5 000 r/min离心。取0.5 mL上清液测定,探究不同提取时间对牡蒿总黄酮提取的影响。
1.3.2.4 提取温度对牡蒿总黄酮提取的影响
取上述最佳乙醇体积分数、乙醇用量及提取时间,控制提取温度分别为30、40、50、60、70、80 ℃,取出样品振摇,冷却,5 000 r/min离心。取0.5 mL上清液测定,探究不同提取温度对牡蒿总黄酮提取的影响。
1.3.3 响应面法试验因素水平设计
在单因素试验的基础上,利用Design Expert 10.0软件的Box-Behnken中心组合试验设计原理进行响应面试验。试验选取A-乙醇体积分数(%)、B-乙醇用量(mL)、C-提取时间(min)、D-提取温度(℃)4个因素作为自变量,设定编码水平为-1、0、1,以牡蒿提取液总黄酮含量(Y)为响应值。响应面试验因素及水平见表1。
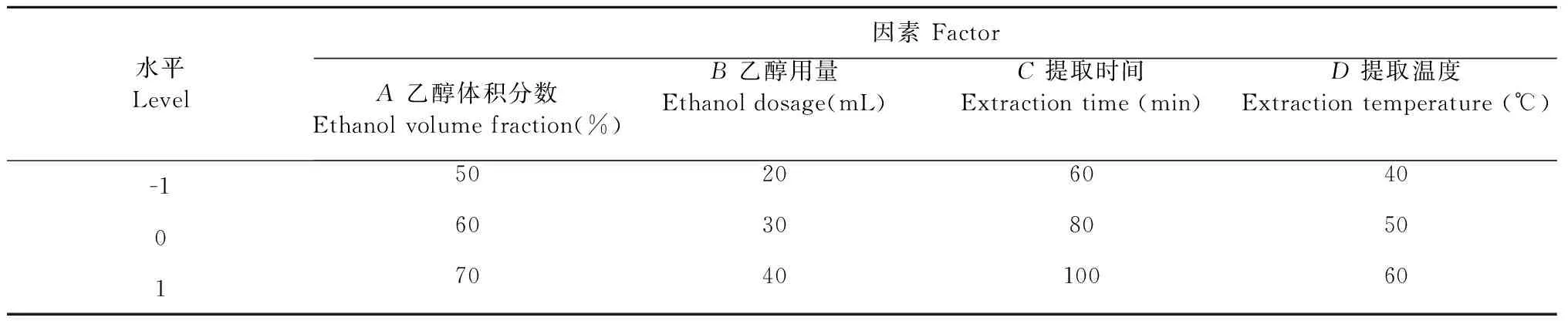
表1 响应曲面优化设计因素与水平Table 1 Factors and levels of response surface method
1.3.4 大孔树脂纯化条件的优化
1.3.4.1 不同大孔树脂对牡蒿总黄酮纯化效果的比较
选择AB-8、X-5和CD-180 3种大孔树脂作为研究对象。以树脂对总黄酮的饱和吸附量、吸附率以及解析率作为指标来确定大孔树脂吸附法纯化牡蒿总黄酮的最佳树脂种类。
1.3.4.2 大孔树脂纯化条件的优化
根据“1.3.4.1”项下确定的树脂,从静态吸附与解吸的最佳时间选择、溶液质量浓度对静态吸附的影响、乙醇浓度对大孔吸附树脂解吸的影响等进行纯化条件的优化。
1.3.5 牡蒿总黄酮的抗氧化活性测定
参考铁氰化钾法测定还原力[10]。


式中:Ai为样品吸光度,Aj分别为纯水代替ABTS+·体系、无水乙醇溶液代替DPPH乙醇溶液、纯水代替H2O2及邻苯三酚溶液的吸光度;A0为空白样品吸光度。
1.4 数据处理
所有试验均重复三次。采用Excel 2016和Design Expert 10.0软件进行数据统计、作图和响应面分析。
2 结果与分析
2.1 单因素试验
高效、绿色、低成本是植物有效成分提取方法选择的基本原则,传统有机溶剂浸提法仍是普遍采用的常规方法。溶剂的极性不同,对植物有效成分萃取的影响存在显著差异[15]。黄酮类化合物不易溶于水,易溶于极性强的有机溶剂。作为安全性高的有机浸提溶剂之一,乙醇在植物黄酮提取中被广泛应用。
乙醇体积分数、乙醇用量、提取时间、提取温度对牡蒿总黄酮提取含量的影响如图1~4所示。可以发现,随着乙醇体积分数的上升、乙醇用量的增加、提取时间的延长、提取温度的升高,牡蒿提取液总黄酮含量均呈先升后降趋势。可能由于不同乙醇体积分数溶剂具有不同的极性而对黄酮的溶解力不同,但过大的乙醇体积分数导致黄酮物质与溶剂的极性差增大,溶解性降低;乙醇用量较低时,提取体系料液饱和,黄酮物质析出不足,而乙醇用量超过30 mL时,醇溶性和脂溶性杂质溶出量增大,影响牡蒿黄酮物质的溶出;提取时间较短,牡蒿吸热不足,细胞破裂程度较低,溶出黄酮成分较少,提取时间过长,大部分活性成分溶出,含量不再升高,且易造成分解;提取温度的适度升高,体系扩散系数增加,分子运动加速,利于黄酮物质的溶出与扩散,但提取温度过高,导致乙醇溶剂挥发影响黄酮物质的溶解,以及黄酮物质结构的破坏造成有效成分的损失[16,17]。

图1 乙醇体积分数对牡蒿总黄酮提取的影响Fig.1 Effect of ethanol volume fraction on extraction of total flavonoids from A.japonica
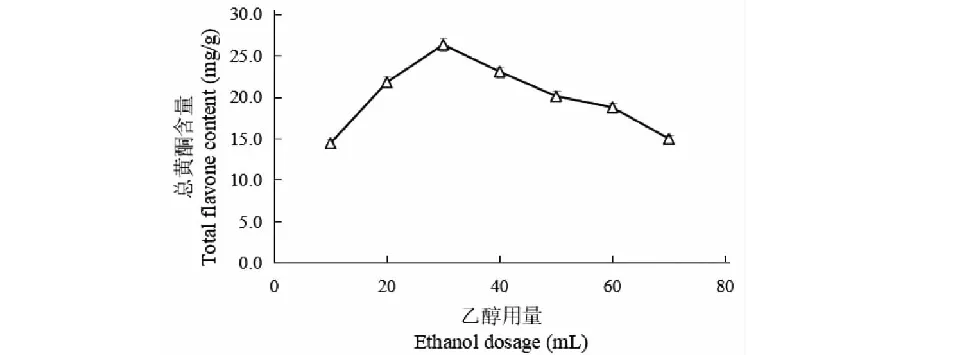
图2 乙醇用量对牡蒿总黄酮提取的影响Fig.2 Effects of ethanol dosage on extraction of total flavonoids from A.japonica

图3 提取时间对牡蒿总黄酮提取的影响Fig.3 Effects of time on extraction of total flavonoids from A.japonica

图4 提取温度对牡蒿总黄酮提取的影响Fig.4 Effects of temperatures on extraction of total flavonoids from A.japonica
单因素试验条件下,乙醇体积分数60%、乙醇用量30 mL、提取时间80 min、提取温度50 ℃时,提取液总黄酮含量最大,分别为25.90、26.32、26.84、27.09 mg/g。后续以乙醇体积分数60%、乙醇用量30 mL、提取时间80 min、提取温度50 ℃进行响应面试验设计。
2.2 响应面优化
2.2.1 响应面分析
根据Box-Behnken试验设计原理,在单因素试验结果基础上,对总黄酮的提取工艺进行4因素3水平中心组合试验设计。试验设计与响应结果如表2所示。用Design Expert 10.0软件对表2数据进行回归模型方差分析。分析结果如表3所示。对各因素实验数据进行回归拟合,得回归方程为:牡蒿提取液总黄酮含量(mg/g)=23.616 0-0.104 2A+0.962 5B+1.643 3C-1.445 0D-4.020 0AB+4.345 0AC-0.332 5AD+0.347 5BC+2.745 0BD+0.092 0A2-1.160 5B2-2.776 8C2+2.855 8D2。由表3分析可知,回归方差分析显著性检验表明该模型回归显著(P=0.000 9<0.01),失拟项不显著(P=0.919 8>0.05),该模型具有统计学意义。方程的1次项C、D对响应值的影响显著,2次项C2、D2对响应值的影响极显著;交互项AB、AC和CD对响应值的影响极显著,BD影响显著。试验中各因素的F值可以直观反映各因素影响的大小,F值越大,其对响应值的影响也越大。通过对各因素的影响程度进行分析可以发现,FA=0.024,FB=2.08,FC=6.07,FD=4.69,故可知各因素对牡蒿提取液总黄酮含量影响大小顺序为提取时间>提取温度>乙醇用量>乙醇体积分数。试验影响因素之间交互作用的响应面图和等高线图见图5,与表3所示回归模型方差分析结果一致。

图5 交互项AB、AC、BD、CD交互作用的响应面图和等高线图Fig.5 Response surface plot and contour diagram of interaction items AB,AC,BD and CD

表2 Box-Behnken试验响应结果Table 2 Response results of Box-Behnkenn test

续表2(Continued Tab.2)
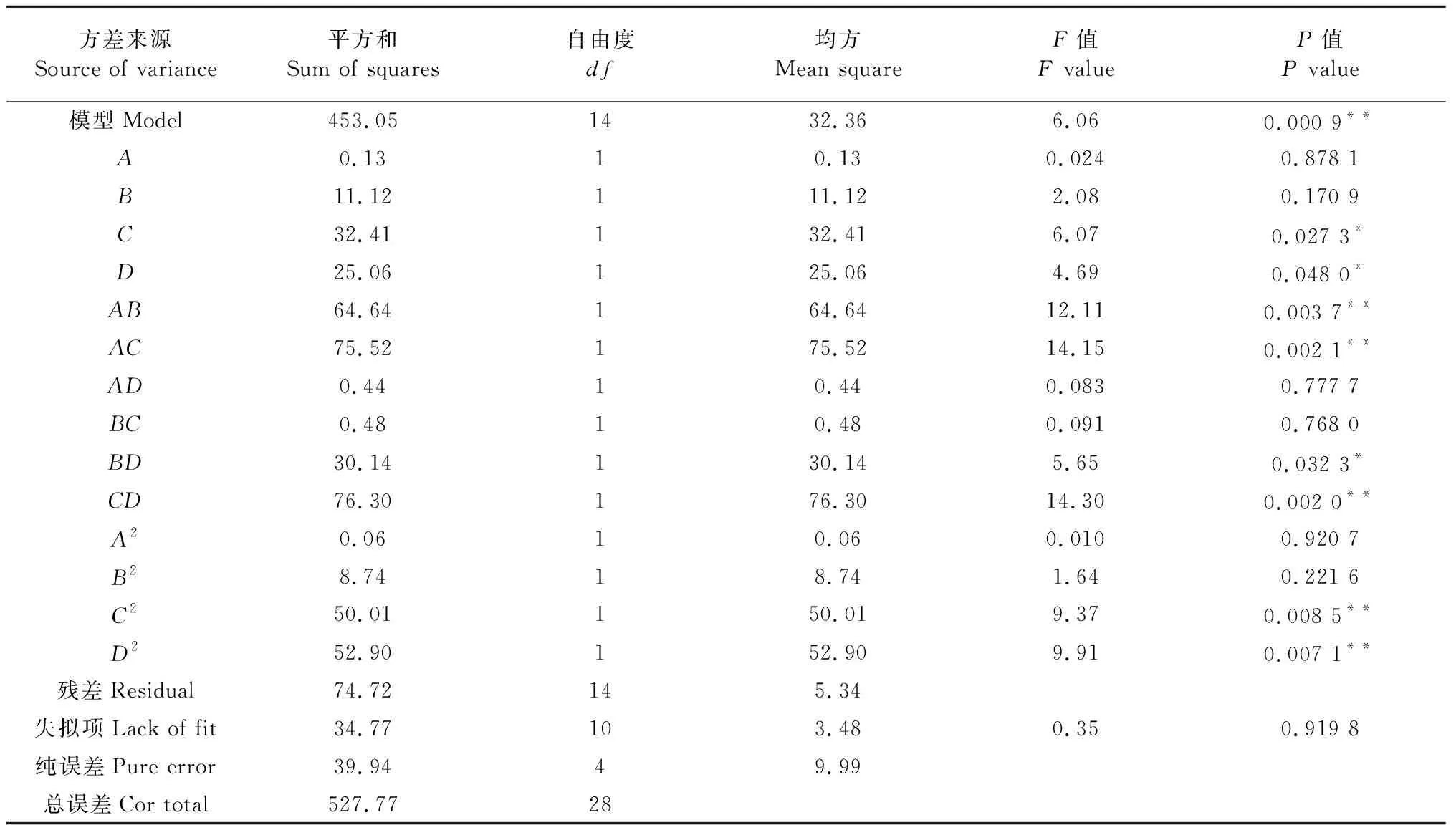
表3 回归模型方差分析Table 3 Variance analysis of regression model
响应面是一种有效的统计和优化方法,在植物源黄酮提取优化研究中的应用日趋广泛,其对数据的分析较传统的正交设计方法更为详细,可直观看出各影响因素的显著情况和两因素间的交互作用。试验与采用乙醇浸提法考察补骨脂总黄酮[18]、采用乙醇-索氏法提取胡麻籽饼粕黄酮[19]的响应面试验结果相一致。
2.2.2 最优工艺条件确定与模型验证
通过响应面软件进一步分析可知,牡蒿总黄酮提取的最佳条件为乙醇体积分数70%、乙醇用量20 mL、提取时间84.52 min、提取温度40 ℃,在此条件下总黄酮含量的预测值为33.024 mg/g。由于对条件可操作性考虑,将牡蒿总黄酮最佳提取工艺条件修正为乙醇体积分数70%、乙醇用量20 mL、提取时间85 min、提取温度40 ℃,经过3次重复试验验证,调整后工艺条件下牡蒿提取液总黄酮含量为32.68 mg/g,与预测值相偏差为0.01%,具有理想的实际应用价值。试验条件下牡蒿总黄酮的提取效率与以85%甲醇溶液索式提取2 h的效率基本相同,但甲醇对人体有害不适于工业和食品生产,而乙醇则原料易得,安全性较高,且本方法耗能较低,设备需求简单,操作控制容易,稳定性好[8]。
2.3 大孔树脂纯化条件的优化
2.3.1 大孔树脂的筛选
重结晶法、树脂法、膜分离法、高速离心分离法等是常见的黄酮类化合物分离纯化方法,大孔树脂因具有较好的选择性,而且成本低、吸附量大、吸附速度快、再生处理方便,被广泛应用于黄酮化合物的初步纯化[20]。
不同树脂对牡蒿提取液总黄酮的吸附性能测定结果如表4所示。在相同条件下,大孔树脂的种类不同,吸附和解吸能力也不同。综合比较,AB-8的吸附率和解吸率都较高,为74.36%和85.32%,是理想的适用于吸附分离牡蒿总黄酮的大孔树脂。

表4 不同树脂对牡蒿总黄酮的吸附性能Table 4 Adsorption properties of different resins on total flavonoids from A.japonica
2.3.2 AB-8树脂的静态吸附及静态解吸的动力学曲线
AB-8树脂的静态吸附动力学曲线如图6所示。AB-8树脂对牡蒿总黄酮的吸附率随吸附时间先快速上升后停滞。在吸附开始1 h内,AB-8树脂吸附呈指数上升,达到49.30%;之后1~2 h增速逐步减慢;在吸附2 h后,AB-8树脂的静态吸附开始停滞,最后整体趋于稳定。说明AB-8树脂静态吸附牡蒿提取液总黄酮的时间控制在2 h为宜,静态吸附率为65.47%。

图6 AB-8树脂的静态吸附动力学曲线Fig.6 Static adsorption kinetics curve of AB-8 resin
AB-8树脂对牡蒿总黄酮的静态解吸曲线如图7所示,解吸率随吸附时间先快速上升后停滞。在解吸开始后的1.5 h内,AB-8树脂解吸率随时间整体呈线性关系;之后AB-8树脂解吸停滞,整体在长时间范围内变化不大。说明AB-8树脂静态解吸牡蒿提取液总黄酮的时间控制在1.5 h为宜,静态解吸率为74.63%。
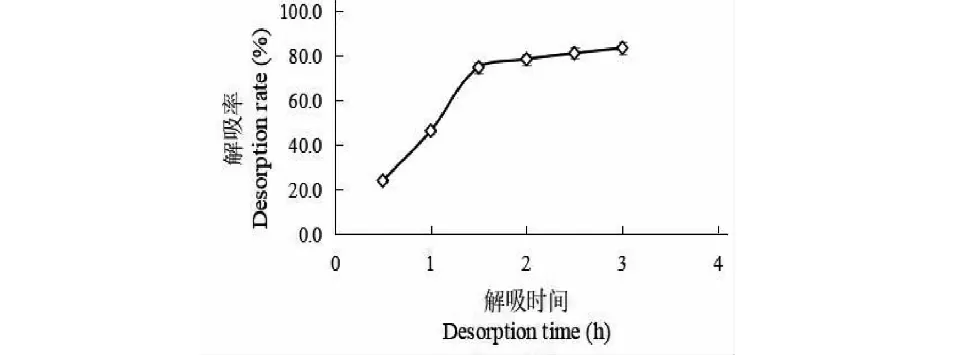
图7 AB-8树脂的静态解吸动力学曲线Fig.7 Static desorption kinetics curve of AB-8 resin
2.3.3 AB-8树脂的静态吸附及静态解吸的影响因素
AB-8树脂静态吸附牡蒿提取液总黄酮随溶液质量浓度呈上升趋势,且在0.4~0.6 mg/mL范围上升显著,溶液质量浓度在1.2 mg/mL时AB-8树脂吸附率达到最大,为72.41%,之后有略下降趋势(见图8)。综合比较可知,牡蒿总黄酮提取液质量浓度在1.2 mg/mL时为AB-8树脂的静态吸附的最佳浓度。
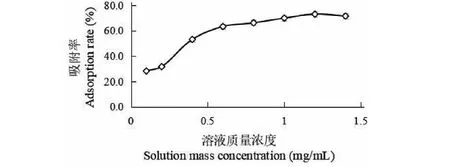
图8 溶液质量浓度对AB-8树脂静态吸附率的影响Fig.8 Effect of solution mass concentration on static adsorption rate of AB-8 resin
AB-8树脂静态解吸率随乙醇浓度呈先上升后下降趋势,且不同乙醇浓度阶梯之间变化显著(见图9)。50%乙醇浓度洗脱时牡蒿总黄酮解吸率最大,为82.17%,之后迅速下降。综合比较可知,乙醇浓度在50%时为AB-8树脂的静态解吸的最佳浓度。

图9 乙醇浓度对AB-8树脂静态解吸率的影响Fig.9 Effect of ethanol concentration on static desorption rate of AB-8 resin
2.3.4 纯化后牡蒿总黄酮纯度的测定
经AB-8树脂吸附纯化后,牡蒿总黄酮精制品的纯度为56.17%,其结果较为理想。
2.4 牡蒿总黄酮的抗氧化活性
2.4.1 牡蒿总黄酮的还原能力
试验条件下,在一定浓度范围内,牡蒿总黄酮粗提物(crude extract of total flavonoids fromA.japonica,CFAJ)和大孔树脂纯化物(purified product of total flavonoids fromA.japonica,PFAJ)还原能力的强弱与其浓度表现出剂量效应,提取物总黄酮浓度越高,则反应体系700 nm处的吸光度越高,还原能力越强(见图10)。吸光度值达到0.5时,所需的牡蒿总黄酮粗提物、纯化物和VC的质量浓度分别为0.30、0.20、0.14 mg/mL,牡蒿总黄酮粗提物和纯化物的还原力均低于对照物VC。各阶段浓度下,牡蒿总黄酮纯化物的还原力均大于粗提物,且随着浓度的增大,二者差异也呈明显趋势。说明牡蒿总黄酮提取物经过纯化后还原能力增强,可能由于牡蒿总黄酮提取物内的杂质在反应中影响了其还原力,且杂质的影响随浓度的上升而增大。

图10 牡蒿总黄酮的还原力Fig.10 Reducing power of total flavonoids from A.japonica
2.4.2 牡蒿总黄酮对ABTS+·清除率的测定
牡蒿总黄酮对ABTS+·清除率的测定如图11所示。试验条件下,牡蒿总黄酮对ABTS+·清除能力的强弱与其浓度成表现出一定的正相关性,浓度越高,清除率越大。牡蒿总黄酮粗提物、纯化物和VC对ABTS+·清除作用的IC50值分别为49.87、25.11、19.49 μg/mL,表明牡蒿总黄酮粗提物和纯化物对ABTS+·清除率均低于对照物VC。分析发现,各阶段浓度下,牡蒿总黄酮纯化物对ABTS+·清除率均大于粗提物,且变化趋势近似,说明牡蒿总黄酮提取物经过纯化后对ABTS+·清除能力增强。

图11 牡蒿总黄酮对ABTS+·清除率Fig.11 Scavenging effect of flavonoids from A.japonica on ABTS+·
2.4.3 牡蒿总黄酮对DPPH·清除率的测定
牡蒿总黄酮对DPPH·清除率的测定如图12。试验条件下,随着牡蒿总黄酮浓度的增大,其对DPPH·清除能力逐渐增强。牡蒿总黄酮粗提物、纯化物和VC对DPPH·清除作用的IC50值分别为51.70、16.48、29.37 μg/mL,表明三组处理对DPPH·清除能力的强弱大小关系为牡蒿总黄酮纯化物>VC>牡蒿总黄酮粗提物,说明牡蒿总黄酮提取物经过纯化后对DPPH·清除能力增强,且超过了对照VC。
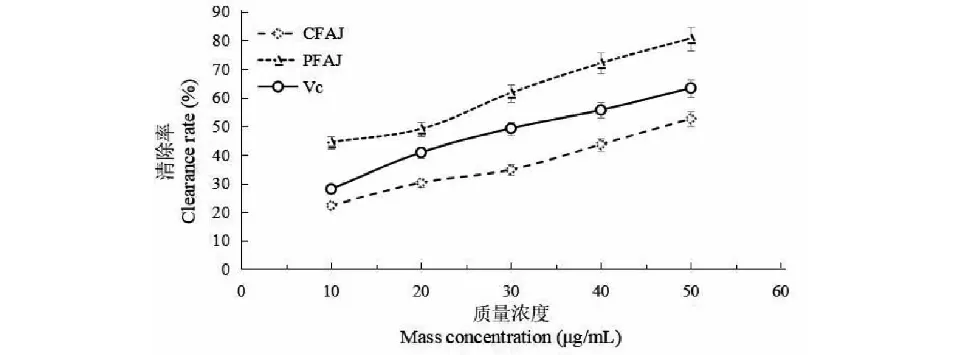
图12 牡蒿总黄酮对DPPH·清除率Fig.12 Scavenging effect of flavonoids from A.japonica on DPPH·
2.4.4 牡蒿总黄酮对·OH清除率的测定
试验条件下,牡蒿总黄酮对·OH有明显的清除作用,且随着质量浓度的增加,其清除能力逐渐增强(见图13)。牡蒿总黄酮粗提物、纯化物和VC对·OH清除作用的IC50值分别0.31、0.24、0.18 mg/mL,牡蒿总黄酮粗提物和纯化物对·OH清除率均低于对照物VC,但牡蒿总黄酮纯化物对·OH清除率大于粗提物。

图13 牡蒿总黄酮对·OH的清除率Fig.13 Scavenging effect of flavonoids from A.japonica on ·OH

图14 牡蒿总黄酮对清除率Fig.14 Scavenging effect of flavonoids from A.japonica on
3 讨论与结论
研究以采自安徽省肥西县境内的牡蒿地上部为材料,利用响应面法分析乙醇体积分数、乙醇用量、提取时间、提取温度对牡蒿总黄酮提取含量的影响,确定了牡蒿总黄酮乙醇浸提法最佳工艺条件为乙醇体积分数70%、乙醇用量20 mL、提取时间85 min、提取温度40 ℃。与传统的乙醇浸提法相比,本试验所得最佳提取工艺条件在一定程度上缩短提取时间,避免长时间提取对活性成分的影响,提高了牡蒿总黄酮的提取量和效率[21]。
大孔树脂对牡蒿总黄酮纯化效果试验发现,AB-8对牡蒿总黄酮的吸附率和解吸率都较高,为74.36%和85.32%,是理想的适用于吸附分离牡蒿总黄酮的大孔树脂。纯化过程中,AB-8树脂静态吸附牡蒿总黄酮的时间控制在2 h为宜,静态吸附率为65.47%;静态解吸牡蒿总黄酮的时间控制在1.5 h较佳,静态解吸率为74.63%;牡蒿总黄酮提取液质量浓度在1.2 mg/mL时为AB-8树脂的静态吸附的适宜浓度;乙醇浓度在50%时为AB-8树脂的静态解吸的较佳浓度。

