基于Akt/mTOR/NF-κB信号通路研究地龙提取物对病理性心肌肥厚大鼠的保护作用
2023-03-15张侍玉梁天鸣朱家峰张兰娥
张侍玉,梁天鸣,方 柳,姚 倩,朱家峰,李 倩,张兰娥*
1潍坊医学院护理学院;2潍坊医学院生命科学与技术学院;3潍坊医学院临床医学院,潍坊 261053
病理性心肌肥厚是心脏应对负荷超载等病理性刺激时做出的一种适应性反应[1]。当心脏压力超负荷时,心肌细胞无法增殖以支持负荷增加的需求,左心室代偿性肥厚以维持心输出量,而持续的心肌肥厚最终导致心力衰竭甚至猝死[2]。药用蚯蚓(lumbricus或earthworm),即地龙,钜蚓科动物参环毛蚓或缟蚯蚓的干燥体,含多肽、氨基酸、核苷酸和蛋白质类化合物等活性成分[3],有抗炎、抗纤维化、调节细胞凋亡等多种药理活性[4,5]。课题组前期研究发现,地龙可通过降低Ang Ⅱ,抑制血管紧张素转化酶活性降低血压[6]。然而,地龙对压力负荷诱导的病理性心肌肥厚的作用及机制仍未明确。
1 材料与方法
1.1 材料与仪器
Vevo 3100 LT超高分辨率超声系统(Visual sonics,加拿大);qRT-PCR引物钠尿肽(ANP)、脑钠肽(BNP)、β-肌球蛋白重链(β-MHC)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)均由上海生工生物合成;SYBR Green Realtime PCR Master Mix(TOYOBO,日本);Cycler 480 System PCR仪(Roche,瑞士);UV-2501紫外分光光度计(岛津,日本);p-NF-κB p65(8242S)、NF-κB p65(3033S)、IκB(9242S)、p-Akt(4060S)、Akt(4691S)、p-mTOR(9411S)和mTOR(2972S)均购自美国Cell Signaling Technology公司;GAPDH(TA-08,中杉金桥,中国);化学发光Fluor Chem FC3系统(Protein Simple,加拿大)。
1.2 方法
1.2.1 地龙提取物的制备
干燥地龙匀浆后,60 ℃水浴浸泡1 h,4 ℃离心取上清液。脱盐和纯化使用KTA蛋白分析仪和Sephadex G-50 Desalting TM(3.2 cm×50 cm)柱进行凝胶过滤,0.1 mol/L磷酸盐缓冲液(pH:7.0)平衡。1 g地龙提取物相当于10 g地龙生药材。具体制备方法见既往报道[3]。
1.2.2 动物分组、模型建立与给药方法
30只雄性Wistar大鼠购自济南鹏悦实验动物有限公司,饲养于SPF级环境中。随机分为假手术组(S组)、模型组(M组)、模型+地龙低剂量组(M + L组)、模型+高剂量组(M + H组)和模型+卡托普利组(M + C组),每组6只。采用AAC的方法建立病理性心肌肥厚模型。20%乌拉坦麻醉下切开腹腔,在肾动脉分支上1 cm处结扎将5号注射器针头与腹主动脉共同结扎,造成腹主动脉环形缩窄,假手术不结扎。AAC手术后给予1周青霉素防治手术切口感染,地龙低剂量组和地龙高剂量组分别给予地龙400 mg/kg和800 mg/kg[11]腹腔注射,同时使用卡托普利(50 mg/kg)作为阳性对照药[3,12],假手术组和模型组则给予等体积生理盐水,每天1次,连续21 d。
1.2.3 细胞分组及给药
在SD大鼠出生48 h内取出心脏,使用0.1%胰蛋白酶和0.03%胶原酶酶解得到新生大鼠原代心肌细胞[13]。除对照组给予完全培养基外,经50 μmol/L的苯肾上腺素(phenylephrine,PE)[13]处理24 h的原代心肌细胞,被分为PE组、地龙低剂量组(4 mg/mL)、地龙高剂量组(8 mg/mL)和卡托普利组(10 μmol/L)。
1.2.4 小动物超声心动图检查
首先,应用型民办本科高校应聘请一些具有丰富教学经验的老教师,让这些老教师对青年教师传授经验,使其尽快成长。其次,应用型民办本科高校应加强与相关企业的合作,培养学生的实践能力。最后,应用型民办本科高校应举办相关的专业报告会,可邀请企业优秀人员到本校进行演讲,这对开拓教师视野来说很有帮助。
大鼠在1.5%异氟烷吸入麻醉下进行心脏超声检测。大鼠心率维持在350~450次/min,使用Visual sonics Vevo 3100 LT超高分辨率超声系统进行B超、M型超声检测,检测大鼠心脏射血分数(ejection fraction,EF)和短轴缩短率(short axis shortening rate,FS)[14]。
1.2.5 心脏质量指数检测
大鼠称量体重(body weight,BW),使用二氧化碳安乐死后快速取出心脏。分别测量心脏重量(heart weight,HW)和左心室重量(left ventricular weight,LVW),计算HW/BW及LVW/BW[15]。
1.2.6 心脏组织学染色
4%多聚甲醛固定后的心肌组织流水冲洗,乙醇梯度脱水,二甲苯透明后石蜡渗透,温度保持在62 ℃。将包埋的组织块切为厚度4 μm的切片,脱蜡后进行HE染色,观察拍照。
1.2.7 qRT-PCR
Trizol提取心脏组织总RNA,使用逆转录试剂盒(TOYOBO,日本)逆转录为cDNA。采用SYBR Green Realtime PCR Master Mix(TOYOBO,日本)和基因引物进行实时定量PCR(见表1)。mRNA表达的相对定量采用2-ΔΔCt法计算结果,使用GAPDH表达将数据标准化。

表1 qRT-PCR扩增引物序列Table 1 Primers amplified by qRT-PCR
1.2.8 ELISA检测
按ELISA试剂盒(西唐生物技术,中国)说明书,测定大鼠血清TNF-α蛋白水平。
1.2.9 Western blot
RIPA裂解液提取心脏组织蛋白,BCA法测定蛋白浓度。加入5 × Loading Buffer后在95 ℃下5 min使蛋白变性。使用10% SDS-PAGE分离胶电泳,随后恒流电转将蛋白转至PVDF膜上。5%脱脂牛奶封闭后,分别敷一抗(p-Akt、Akt、p-mTOR、mTOR、p-NF-κB p65、NF-κB p65、IκB、GAPDH)4 ℃下过夜,二抗室温孵育2 h后显色。
1.2.10 统计学方法
2 结果
2.1 地龙提取物对AAC诱导的大鼠心脏的影响
为了观察地龙提取物对AAC诱导的大鼠心脏的影响,本研究对各组大鼠进行了小动物超声检测,还评估了心脏质量指数(HW、HW/BW及LVW/BW)的变化。如图1所示,与假手术组相比,模型组大鼠EF、FS降低(P<0.01),表明模型组大鼠心脏收缩功能显著下降;同时,HW、HW/BW及LVW/BW显著高于假手术组(P<0.01),提示AAC诱导的大鼠心脏出现心功能障碍,说明病理性心肌肥厚模型构建成功。有趣的是,与模型组比较,地龙提取物治疗后的AAC大鼠的EF、FS显著升高(P<0.05),而HW、HW/BW及LVW/BW显著下降(P<0.05),并且效果与卡托普利相当。这些数据表明地龙提取物对AAC诱导的大鼠心脏功能障碍有显著改善作用。

图1 地龙处理对病理性心肌肥厚大鼠心脏超声指标及心脏质量指数的影响Fig.1 Effects of earthworm treatment on echocardiographic indicators and heart mass index in rats with pathological cardiac hypertrophy 注:S:假手术组;M:模型组;M+L:模型+地龙低剂量组;M+H:模型+地龙高剂量组;M+C:模型+卡托普利组。与假手术组比较,#P<0.05,## P<0.01,### P<0.001;与模型组比较,* P<0.05,** P<0.01,*** P<0.001,下同。Note:S:Sham group;M:Model group;M+L:Model+earthworm low-dose group;M+H:Model+earthworm high-dose group;M+C:Model+Captopril group.#P<0.05,## P<0.01,###P<0.001 vs sham group; * P<0.05,** P<0.01,*** P<0.001 vs model group,the same below.
2.2 地龙提取物对AAC诱导的大鼠心肌肥厚的影响
为了研究地龙提取物对各组大鼠心脏组织学变化的影响,本研究通过HE染色观察各组大鼠心脏组织形态学,结果显示,与假手术组比较,模型组大鼠心肌细胞横截面积明显增大(P<0.001),单位面积心肌细胞数目减少。与模型组比较,地龙低剂量组与高剂量组心肌细胞横截面积明显减小(P<0.05),单位面积心肌细胞数目增多,与卡托普利阳性对照组大鼠心肌细胞病理改变结果一致(见图2)。为了探究地龙提取物对病理性心肌肥厚基因标志物的影响,本研究通过qRT-PCR检测了肥大基因标志物ANP、BNP及β-MHC的mRNA表达水平。由图3显示,与假手术组相比,模型组大鼠心脏组织中的ANP、BNP及β-MHC mRNA水平显著升高(P<0.05)。与模型组比较,地龙治疗可显著降低ANP、BNP和β-MHC mRNA表达水平(P<0.05),地龙低剂量组的治疗效果优于卡托普利。以上说明地龙提取物可以抑制AAC诱导的病理性心肌肥厚。
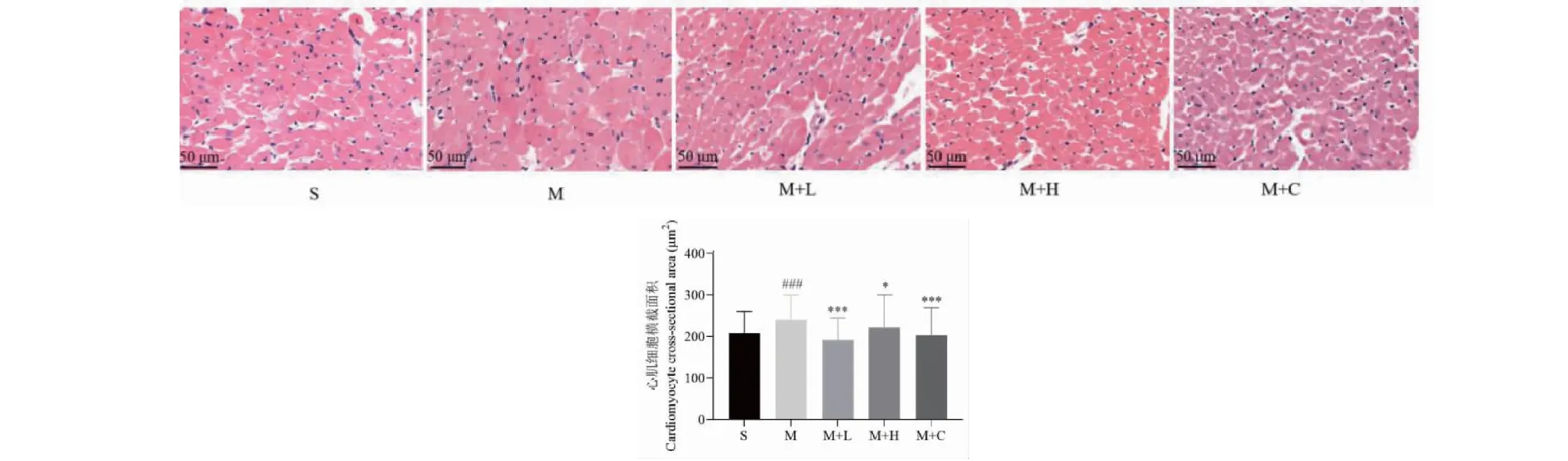
图2 各组大鼠心脏组织HE染色Fig.2 The representative images of HE staining in each group

图3 地龙处理对病理性心肌肥厚大鼠ANP、BNP及β-MHC基因表达的影响Fig.3 Effects of earthworm treatment on expression of mRNA ANP,BNP,and β-MHC in rats with pathological cardiac hypertrophy s,n=4)
2.3 地龙提取物对AAC诱导的心肌炎症的影响
为了证明地龙提取物在AAC诱导的心肌炎症反应中发挥重要作用,我们研究了促炎因子在各组大鼠心脏中的表达。如图4所示,与假手术组相比,模型组大鼠炎症相关基因TNF-α、IL-6表达水平和血清TNF-α含量显著升高(P<0.05),而地龙各剂量治疗组TNF-α、IL-6的基因表达和血清TNF-α含量显著下降(P<0.05),值得注意的是,地龙提取物呈现与卡托普利相当的治疗效果,这表明地龙提取物的抗心肌肥厚作用与其抑制心脏促炎因子表达密切相关。

图4 地龙处理对病理性心肌肥厚大鼠TNF-α、IL-6 mRNA和血清TNF-α蛋白表达的影响Fig.4 Effects of earthworm treatment on TNF-α,IL-6 mRNA and TNF-α protein expression in rats with pathological cardiac hypertrophy
2.4 地龙提取物对Akt/mTOR/NF-κB信号通路蛋白表达的影响
为了检验地龙提取物是否通过Akt/mTOR/NF-κB信号通路改善病理性心肌肥厚,本研究通过Western blot检测了大鼠心脏和原代心肌细胞Akt/mTOR/NF-κB通路相关蛋白的表达变化。与假手术组相比,模型组大鼠心脏组织中p-Akt、p-mTOR蛋白表达水平显著升高(P<0.01)。与模型组相比,地龙各剂量组和卡托普利组大鼠心脏组织中p-Akt、p-mTOR蛋白表达水平显著下调(P<0.05)(见图5)。此外,与假手术组相比,模型组大鼠心脏组织中 p-NF-κB p65蛋白表达水平上调(P<0.001),IκB蛋白水平下降(P<0.001)。与模型组相比,地龙各剂量组和卡托普利组心脏组织中p-NF-κB p65蛋白表达水平降低(P<0.001),IκB蛋白上升至对照水平(P<0.01)(见图6)。另外,PE诱导的原代心肌细胞肥大模型中,地龙提取物对Akt/mTOR/NF-κB通路相关蛋白表达的影响与AAC诱导的大鼠实验结果一致(见图7和图8)。以上结果表明,地龙提取物可能通过Akt/mTOR/NF-κB通路的抑制而改善大鼠病理性心肌肥厚。
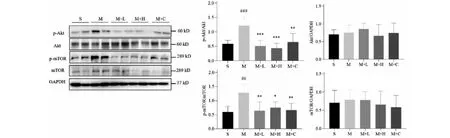
图5 地龙处理对病理性心肌肥厚大鼠心脏组织中Akt、mTOR蛋白表达的影响Fig.5 Effects of earthworm treatment on expression of Akt and mTOR proteins in heart tissues of rats with pathological cardiac hypertrophy
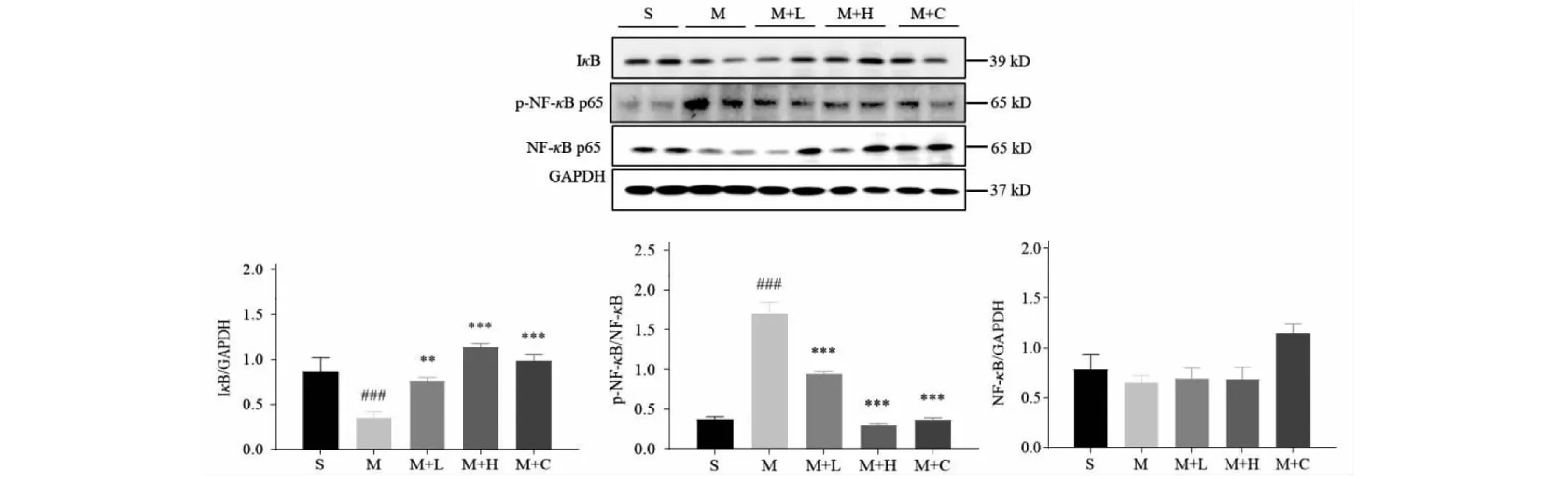
图6 地龙处理对病理性心肌肥厚大鼠心脏组织中NF-κB、IκB蛋白表达的影响Fig.6 Effects of earthworm treatment on expression of NF-κB and IκB proteins in heart tissues of rats with pathological cardiac hypertrophy

图7 地龙处理对原代心肌细胞Akt、mTOR蛋白表达的影响Fig.7 Effects of earthworm treatment on expression of Akt and mTOR proteins in primary cardiomyocytes 注:Con:对照组;PE:PE模型组;PE+L:PE模型+地龙低剂量组;PE+H:PE模型+地龙高剂量组;PE+C:PE模型+卡托普利组。与对照组比较,#P<0.05,## P<0.01,### P<0.001;与PE组比较,*P<0.05,** P<0.01,*** P<0.001,下同。Note:Con:Control group;PE:PE model group;PE+L:PE model+earthworm low-dose group;PE+H:PE model+earthworm high-dose group;PE+C:PE model+Captopril group.#P<0.05,## P<0.01,### P<0.001 vs control group; * P<0.05,** P<0.01,*** P<0.001 vs PE model group,the same below.

图8 地龙处理对原代心肌细胞NF-κB、IκB蛋白表达的影响Fig.8 Effects of earthworm treatment on expression of NF-κB and IκB proteins in primary cardiomyocytes
3 讨论与结论
地龙以其天然的抗炎、抗纤维化、调节凋亡等特性,在治疗高血压、糖尿病等方面发挥了显著作用[4,5]。病理性心肌肥厚是心血管系统疾病发生发展的高危因素,是多种心血管疾病的共同病理过程[16];持续的病理性心肌肥厚触发严重的心肌重构,导致心衰、猝死等[17]。近年来,大量研究表明,中药提取物在心血管系统疾病发生发展中具有明显的保护作用[18,19]。课题组在既往研究中发现地龙可能通过降低Ang Ⅱ,抑制血管紧张素转化酶活性来降血压[3,6]。本研究进一步探究了地龙提取物在AAC诱导的病理性心肌肥厚模型中的作用及其作用机制。因此,本研究采用经典的AAC方法建立病理性心肌肥厚模型,并以卡托普利为阳性对照[3,12]。
病理性心肌肥厚主要表现为心肌细胞肥大、胚胎基因表达上调及炎症反应增强[10,20]。与既往研究报道一致[7],本研究结果显示AAC模型组大鼠心脏功能受损,EF和FS值降低,大鼠心脏质量指数HW、HW/BW、和LVW/BW明显提高。进一步,组织病理学染色结果发现,AAC导致心肌细胞横截面积增大,心肌肥厚相关基因ANP、BNP、β-MHC表达显著升高。这说明AAC成功诱导了大鼠的病理性心肌肥厚。有趣的是,本研究发现,地龙提取物治疗后大鼠的心脏收缩功能得到明显改善,AAC诱发的心脏质量指数增高和组织形态学改变被显著抑制,心肌肥厚标志物也恢复至正常水平,且地龙低剂量的治疗效果优于卡托普利,表明地龙提取物可以抑制AAC 诱导的病理性心肌肥厚。此外,炎症也参与病理性心肌肥厚的发生发展过程,促炎因子IL-6、TNF-α在心肌炎症反应中发挥重要作用[10]。在本研究中,AAC诱发了心肌炎症反应,IL-6、TNF-αmRNA表达水平显著增高,而地龙提取物治疗几乎可以将炎症因子的表达恢复至正常水平,且治疗效果与卡托普利相当,提示地龙提取物可以抑制炎症反应从而改善AAC诱导的心肌肥厚。
大量研究发现,Akt/mTOR/NF-κB信号通路在病理性心肌肥厚的发生发展中发挥重要作用[16],心肌细胞特异性Akt、mTOR过表达可能导致心肌肥厚[21]。NF-κB在病理性心肌肥厚中,受多种因素的刺激,可激活TNF-α、IL-6等各种炎症因子[22,23]。本研究结果显示,AAC大鼠心肌肥厚程度明显增加,心肌炎症反应明显增加。然而,在Akt/mTOR信号通路中,地龙治疗组p-Akt和p-mTOR蛋白的表达明显低于模型组。在NF-κB信号通路中,p-NF-κB p65的表达量降低,但IκB的表达量显著增加。因此,Akt/mTOR/NF-κB信号通路可能在地龙治疗病理性心肌肥厚过程中被抑制。另外,地龙提取物还可以抑制PE诱导的肥大心肌细胞中Akt、mTOR和NF-κB p65的磷酸化蛋白表达的升高。由此可见,地龙提取物可能通过抑制Akt/mTOR/NF-κB信号通路在病理性心肌肥厚中发挥保护作用,但具体的级联反应及靶点有待进一步研究。
综上所述,本研究首次发现地龙对压力负荷诱导的病理性心肌肥厚有一定的保护作用,其机制可能与抑制AAC诱导的心肌肥大和心肌炎症有关,并通过Akt/mTOR/NF-κB信号通路发挥作用。本研究为地龙的进一步临床应用提供了实验依据,也为病理性心肌肥厚和心衰的防治提供了新的思路。然而,地龙抑制病理性心肌肥厚有效成分的一级结构尚未阐明,有待进一步研究。本课题将进一步探究地龙防治心衰的有效成分及其作用机制。
