全程局部同步推量调强放疗治疗局部晚期食管癌的效果及对3年生存率的影响
2023-03-15任丽丽杨文影
张 伟,任丽丽,江 超,杨文影
食管癌是一种发病率和病死率都很高的恶性肿瘤[1]。据统计,全世界每年约有40万新发食管癌病例,其中我国新发病例数约占50%。有研究报道,同步放化疗已成为局部晚期食管癌患者的标准治疗手段[2]。理论上,较高的辐射剂量可能有助于提高实体瘤的局部控制率。然而,Ⅲ期临床试验(RTOG94-05)显示,提高放射剂量并没有提高食管癌患者的生存率和局部控制率[3]。此外,放射剂量的增加以及靶区的扩大会使正常组织暴露于更高的剂量,从而导致更大的毒性。全程局部同步推量调强放疗(SIB-IMRT)是一种在化疗的同时进行分割剂量放疗的方法,其可保证不同靶区的不同剂量,有效减少邻近正常组织的辐射暴露,并且还可缩短治疗时间[4]。基于此,本研究比较SIB-IMRT与序贯加量调强放疗(IMRT)治疗局部晚期食管癌的临床疗效、3年生存率、血清肿瘤标志物、免疫功能指标及毒副反应。现报告如下。
1 资料与方法
1.1一般资料 回顾性分析2018年8月—2019年6月本院收治的局部晚期食管癌108例作为研究对象。纳入标准:符合局部晚期食管癌诊断标准[5];鳞状细胞癌;无远处转移;KPS评分>70分;临床资料完整。排除标准:有放疗禁忌证;预计生存时间<3个月;急慢性感染者;免疫功能障碍者;严重心、肝、肾功能不全者。108例根据治疗方法分为研究组和对照组各54例。2组性别、年龄等方面比较无统计学意义(P>0.05),具有可比性。
1.2方法 2组均实施顺铂联合紫杉醇化疗,紫杉醇135 mg/m2d1静脉滴注,顺铂20 mg/m2d1~3静脉滴注,21 d为1个疗程。所有患者使用Synergy直线加速器(瑞典医科达)进行放疗,取仰卧位,使用热塑膜固定体位,平静呼吸时采用CT定位扫描全颈和胸部,扫描层厚5 mm,并进行三维重建。参考CT图像,由主治医师、物理师共同参与靶区勾画,临床靶区(CTV)为食管原发灶及转移淋巴结轴向外扩0.8~1.0 cm,计划靶区(PTV)为在CTV的基础上向外扩0.5~0.8 cm,PTV1为食管区域淋巴结引流区的基础上向外扩0.5~1.0 cm。危及器官剂量体积限制:双肺V5Gy≤60%,V20Gy≤28%,V30Gy≤20%;心脏Dmean≤30 Gy,V30≤40%,V40≤30%;脊髓Dmax≤45 Gy。对照组采用序贯加量IMRT治疗:患者在全身化疗2个疗程后进行放疗,单次剂量1.8~2.0 Gy,前程95% PTV1给予46~54 Gy/23~30次,后程缩野针对PTV局部推量使PTV总剂量达到60~64 Gy/30~35次,每周5次,放疗结束后再进行全身化疗2个疗程。研究组采用SIB-IMRT:患者在放疗的第1天开始进行化疗2个疗程,95% PTV1接受48.6~54 Gy/28~30次,95% PTV接受60~64 Gy/28~30次,每周5次。同步放化疗2个疗程结束后再给予2个疗程的化疗。
1.3观察指标 ①2组治疗3个月后临床疗效采用实体瘤疗效评价标准(RECIST)[6]评估。②肿瘤标志物:采用酶联免疫吸附试验检测2组治疗前后糖类抗原125(CA125)、癌胚抗原(CEA)、细胞角化素蛋白片段19(CYFRA21-1)水平。③免疫功能:应用Attune NxT流式细胞仪检测2组治疗前后外周血CD3+、CD4+、CD8+,计算CD4+/CD8+。④3年生存率:记录2组治疗后3年的生存情况,并采用Kaplan-Meier生存分析3年生存率。⑤记录2组毒副反应发生情况。
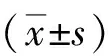
2 结果
2.1近期疗效 2组近期客观缓解率比较差异无统计学意义(P>0.05),见表1。
2.2肿瘤标志物水平 治疗后,研究组CA125、CEA、CYFRA21-1水平低于对照组(P<0.01)。见表2。
2.3免疫功能比较 治疗后,研究组CD3+、CD4+、CD4+/CD8+水平均高于对照组,CD8+水平低于对照组(P<0.05,P<0.01)。见表3。

表1 2组局部晚期食管癌近期疗效比较[例(%)]

表2 2组局部晚期食管癌治疗前后肿瘤标志物水平比较

表3 2组局部晚期食管癌治疗前后免疫功能比较
2.43年生存率 研究组3年生存率为51.85%(28/54),对照组为30.36%(17/54)。研究组3年生存率高于对照组(P<0.05)。见图1。
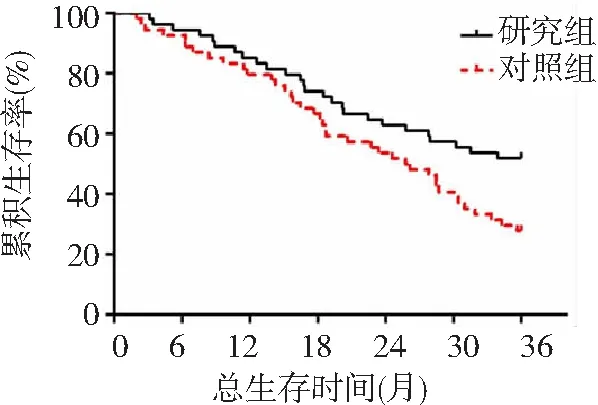
图1 2组局部晚期食管癌3年生存曲线
2.5毒副反应发生情况 研究组放射性食管炎、放射性肺炎发生率低于对照组(P<0.05)。见表4。
3 讨论
目前,放化疗是控制肿瘤细胞增殖、转移,改善晚期食管癌患者预后的重要方法[7]。然而,食管癌的复发通常发生在原位,因此化疗需要通过血液循环到达肿瘤组织。由于放疗后食管血供减少,生存获益降低[8]。临床研究显示,常规分割外照射治疗食管癌的效果不显著,且随着放疗时间的推移,肿瘤细胞可能会存在加速增殖的现象[9]。此外,放射剂量的增加会导致毒副反应显著增加,并使机体出现耐受现象。
SIB-IMRT指在放疗的同时一次将不同剂量分别给予CTV和亚临床病灶,符合高量减时要求[10]。研究显示,早期疗效反映了肿瘤对放疗的敏感性,对放疗更敏感的食管癌患者有更高的客观缓解率,从而获得更好的预后[11]。本研究结果发现,2组近期客观缓解率比较差异无统计学意义,与以往的研究结果一致[12]。究其原因,可能与本研究病例数较少,肿瘤进入晚期,体积增大,肿瘤血运较差等相关。进一步观察远期生存率发现,研究组3年生存率高于对照组,提示SIB-IMRT可提高食管癌患者的远期生存率。据报道,同步化疗可以增加对肿瘤微转移的控制,这可能会提供生存益处[13]。CA125是一种糖原蛋白,在多种恶性肿瘤中均异常高表达;CEA为消化系统肿瘤标志物,可用于肿瘤治疗效果观察和预后评估[14];CYFRA21-1是种结构蛋白,维持单层上皮细胞的结构完整,其与肿瘤增殖、侵袭和转移具有一定的相关性[15]。
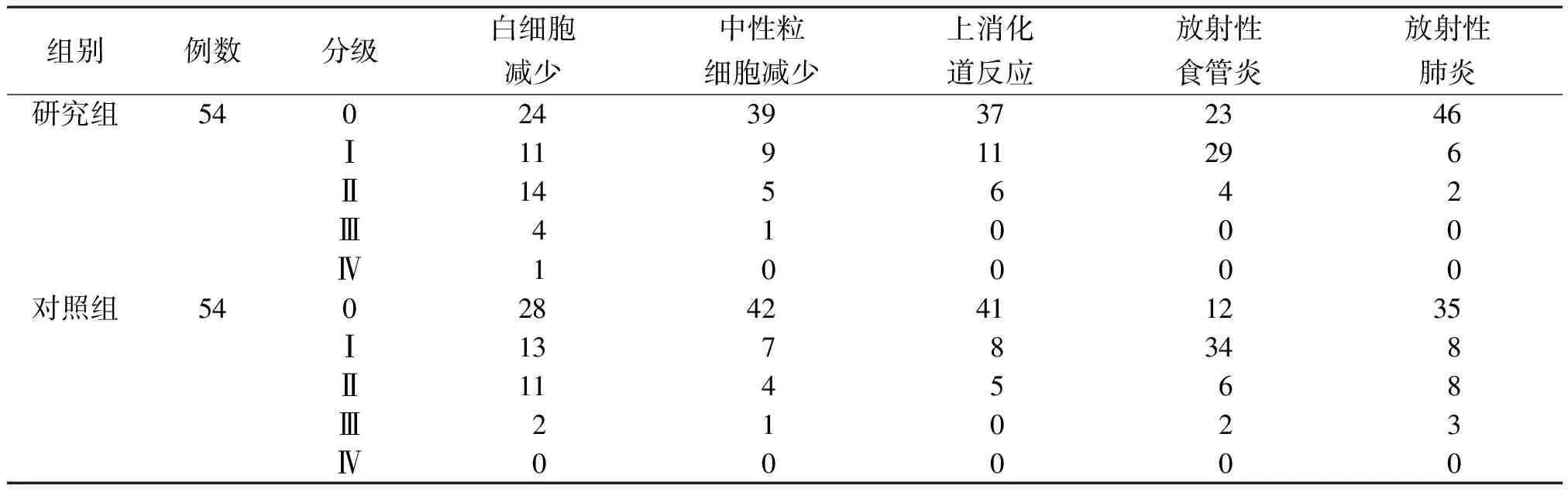
表4 2组局部晚期食管癌毒副反应发生情况比较(例)
本研究中,研究组CA125、CEA、CYFRA21-1水平低于对照组,表明SIB-IMRT可降低血清肿瘤标志物水平。分析其原因,可能是因为SIB-IMRT通过增加对CTV和亚临床病灶的照射剂量,有助于精准杀灭病灶的肿瘤细胞,进而显著降低血清肿瘤标志物水平。
T细胞亚群在维持机体免疫状态、抑制肿瘤细胞增殖方面具有重要作用。但多数研究指出,在放化疗治疗食管癌的同时,不可避免的对正常组织造成损伤,使免疫功能下降,进而导致放疗失败[16]。本研究中,研究组CD3+、CD4+、CD4+/CD8+水平高于对照组,CD8+水平低于对照组,提示SIB-IMRT可有效减少对免疫功能的影响。究其原因,可能为SIB-IMRT有效减少了对周围正常组织、器官的照射剂量,进而对机体免疫功能影响较小。本研究发现,研究组放射性肺炎发生率低于对照组,提示SIB-IMRT可有效减少对肺部的放射损伤。究其原因,可能与SIB-IMRT可有效限制对肺部的照射剂量有关。
综上所述,SIB-IMRT与序贯加量IMRT治疗晚期食管癌的近期疗效相当,但SIB-IMRT在降低血清肿瘤标志物水平和放射性肺炎发生率,减少对免疫功能的影响,提高远期生存率方面效果更佳。
