高龄与非高龄复发性流产患者行胚胎植入前非整倍体检测的可行性分析
2023-03-14蒲艳郑爱燕廖桂芝偶建王馥新王玮丁洁
蒲艳,郑爱燕,廖桂芝,偶建,王馥新,王玮,丁洁
2017年欧洲生殖年会将胚胎植入前遗传学检测(preimplantation genetic testing,PGT)的概念引入国际不孕不育与生育保健术语汇编,取代了以往的胚胎移植前基因诊断(preimplantation genetic diagnosis,PGD)、胚胎植入前遗传学筛查(preimplantation genetic screen,PGS)。PGT包括3个方面:胚胎植入前非整倍体检测(PGT for aneuploidies,PGT-A)、单基因遗传病的检测 (PGT for monogenic/single gene defects,PGT-M)、染色体结构重排的检测 (PGT for chromosomal structural rearrangements,PGT-SR)[1]。在国内PGT-A目前主要应用于高龄(≥38岁)、不明原因的复发性流产(recurrent spontaneous abortion,RSA),即反复自然流产两次及以上、不明原因反复种植失败 (recurrent implantation failure,RIF),即移植≥3次或移植高评分卵裂期胚胎数 4~6个或高评分囊胚数≥3个均失败;严重畸精症[2]。这部分患者通过常规的助孕方法很难得到满意的结果,而PGT-A技术应用至今仍存在争议。本中心PGT-A周期中大多数为高龄及非高龄RSA患者,本研究拟对这两组患者进行分析,探讨高龄和非高龄RSA患者胚胎染色体的整倍体性以及PGT-A在这两组患者中的临床应用价值,以为不同适应证患者应用PGT-A技术提供参考。
1 资料与方法
1.1 研究对象
纳入2016年1月至2021年1月苏州市立医院生殖与遗传中心共195个PGT-A周期,考虑到年龄对胚胎染色体的影响,分为两组。纳入标准:① 高龄组(排除子宫畸形及夫妇双方染色体异常因素),年龄≥38岁,有或无RSA病史(96个活检周期,259枚囊胚);② 非高龄RSA组,患者反复自然流产两次及以上(排除子宫畸形、免疫因素、内分泌因素及夫妇双方染色体异常因素),年龄<38岁(99个活检周期,429枚囊胚)。分别分析两组患者胚胎染色体的整倍性。将胚胎冻融移植周期(frozen-thawed embryo transfer,FET)中行PGT-A的高龄RSA患者与同期未行PGT-A的高龄RSA患者进行比较,分析PGT-A在两组患者中的临床应用价值;将FET中行PGT-A的非高龄RSA患者与同期未行PGT-A的非高龄RSA患者进行比较,分析PGT-A在两组患者中的临床应用价值。
1.2 研究方法
1.2.1 取卵及受精 根据本中心常规方案行促排卵,患者在扳机后34~36 h行阴道B超引导下取卵,2~4 h后卵丘复合物在透明质酸酶中脱颗粒细胞,成熟卵子采用单精子显微注射方式受精。
1.2.2 胚胎培养及活检 胚胎在G-1 PLUS和G-2PLUS(Vitrolife,瑞典)培养液中序贯培养成囊胚,根据囊胚生长情况于第5日或第6日对囊胚滋养外胚层进行活检取样。囊胚评级根据Gardner评分法[3],内细胞团和滋养外胚层均在B级以上为优质囊胚。
1.2.3 二代测序技术 (next generation sequencing,NGS) 对所有活检样本进行全基因组扩增后建库。等温扩增和富集后,使用PGM测序仪(ABI Ion Torrent PGM,美国)进行测序。使用Ion Reporter software进行测序结果解读,通过界面分析数据或后台linux界面分析数据进行染色体分析,以此判断胚胎的染色体是否正常[4]。
1.2.4 囊胚冷冻与复苏 囊胚冷冻解冻均采用玻璃化冷冻,所用冷冻解冻液及载杆购自日本 KITAZATO公司。
1.2.5 临床结局 移植后第14日测血β-hCG确认是否妊娠,阳性者于移植后4~6周B超检查,见孕囊者为临床妊娠,孕12周内自然流产为早期流产。
1.3 统计学方法
采用SPSS 16.0软件进行统计学分析,组间均数比较采用方差分析,率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 高龄组胚胎PGT-A检测结果
高龄组共96个活检周期,活检259枚囊胚,非整倍体率高达76.1%,主要为整条染色体整倍性的异常(83.8%),详见下页表1。根据囊胚发育的天数分组,D6囊胚的非整倍体率高于D5囊胚(P<0.05),按囊胚的质量分组后显示,D6非优质囊胚的非整倍体率高于D5优质囊胚(P<0.05),由于D7囊胚数量较少,未纳入分组统计范围,余组间比较差异无统计学意义(P>0.05),详见下页表2,表3。
2.2 非高龄RSA组胚胎PGT-A检测结果
非高龄RSA组共99个活检周期,429枚囊胚,非整倍体率为45.7%,详见下页表4。根据囊胚发育的天数分组(排除D7囊胚数),D6囊胚的非整倍体率显著高于D5囊胚(P<0.05);按囊胚的质量分组后显示,D6非优质囊胚的非整倍体率显著高于其余3组(P<0.05),各组间非整倍体类型差异无统计学意义(P>0.05),详见表5,表6。
2.3 PGT-A高龄组与未行PGT-A高龄组FET周期临床结局比较
比较同期FET周期中,PGT-A高龄组与未行PGT-A高龄组(考虑到比较对象的一致性,未行PGT-A高龄组均为新鲜周期全冷冻后的囊胚解冻移植周期)临床基本资料比较,差异无统计学意义。PGT-A高龄组仅移植1枚胚胎,胚胎移植数量显著低于未行PGT-A高龄组,PGT-A高龄组临床妊娠率、种植率及活产率高于未行PGT-A高龄组患者(P<0.05),早期流产率差异无统计学意义(P>0.05),详见下页表7。
2.4 非高龄RSA患者行PGT-A组与未行PGT-A组FET周期临床结局的比较
本研究还比较了同期FET周期中非高龄RSA行PGT-A组与非高龄组RSA未行PGT-A组的临床结局。两组患者的临床基本资料中,非高龄RSA行PGT-A组的不孕年限显著增长(P<0.05),其余一般资料比较差异无统计学意义(P>0.05)。本中心非高龄组RSA未行PGT-A组在新鲜周期均行囊胚培养,故FET周期同PGT-A周期均移植1枚囊胚。其临床妊娠率、种植率及早期流产率比较,差异均无统计学意义(P>0.05),详见下页表8。

表1 高龄组胚胎PGT-A检测结果
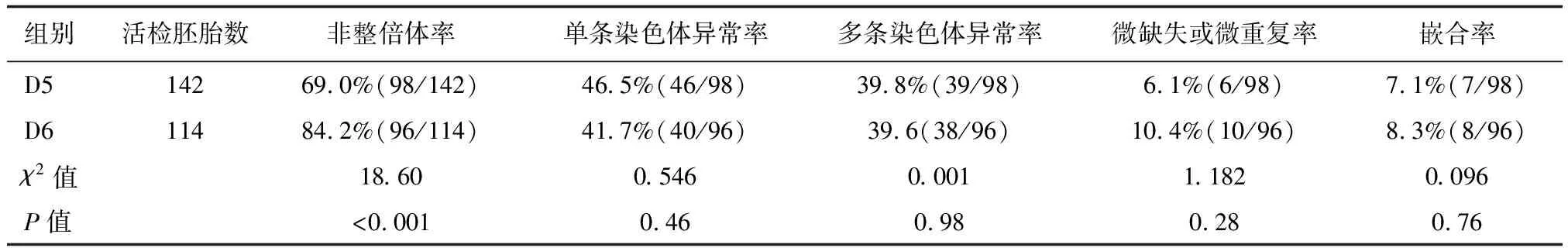
表2 高龄组不同发育天数胚胎整倍性比较

表3 高龄组不同发育天数及不同质量胚胎整倍性比较

表4 非高龄RSA组胚胎PGT-A检测结果
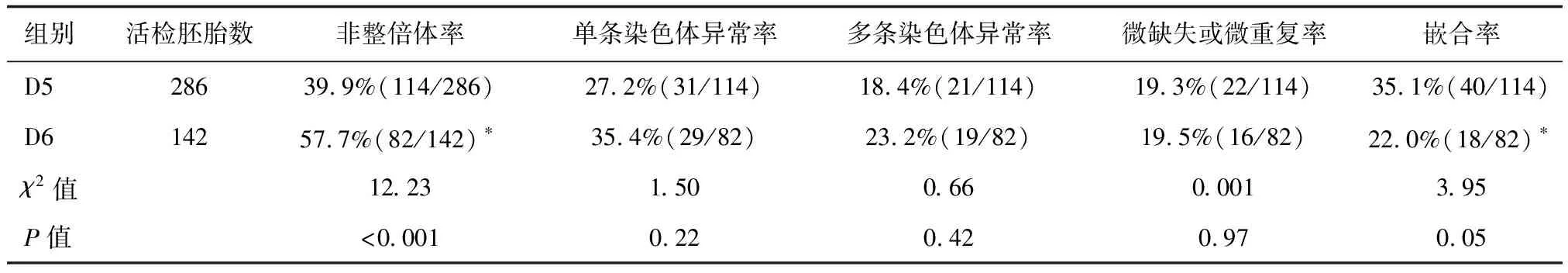
表5 非高龄RSA组不同发育天数胚胎整倍性比较
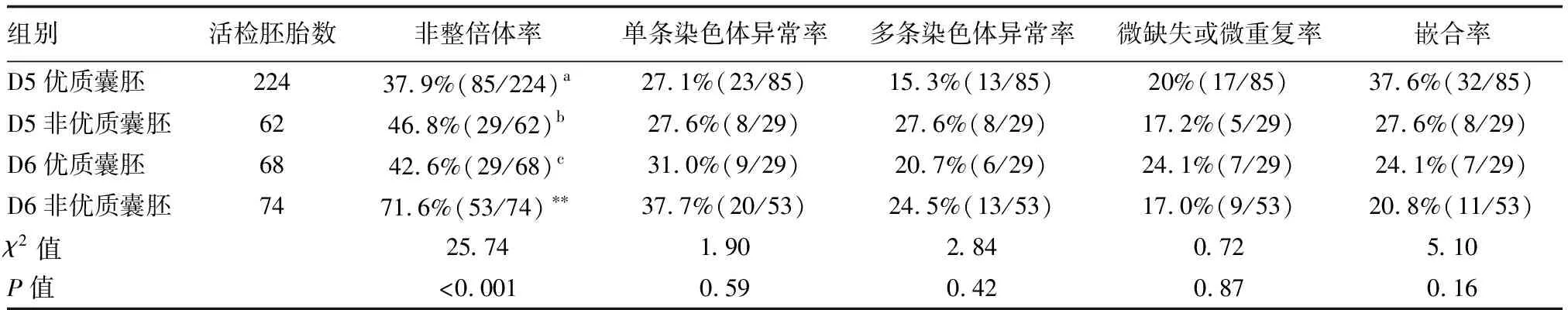
表6 非高龄RSA组不同发育天数及不同质量胚胎整倍性比较

表7 PGT-A高龄组与未行PGT-A高龄组FET周期临床结局比较
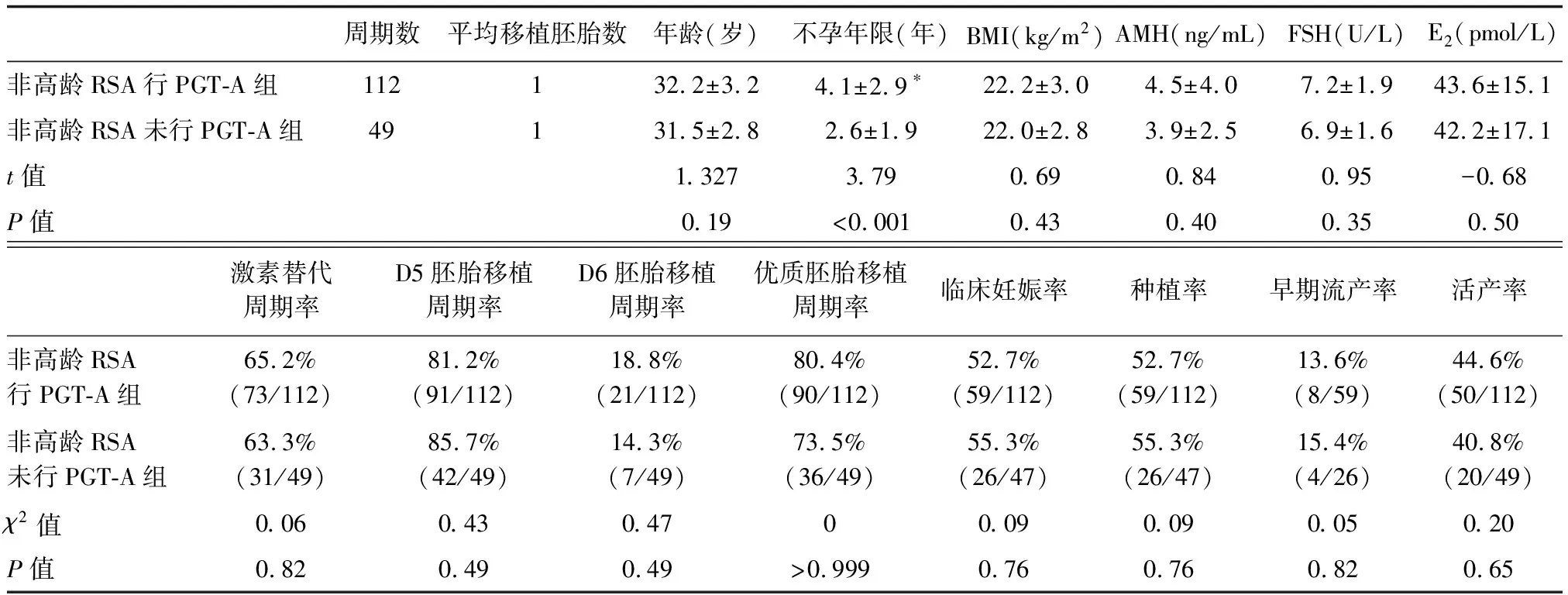
表8 非高龄RSA患者行PGT-A组与未行PGT-A组FET周期临床结局的比较
3 讨论
PGT的活检时机经历了从极体活检、卵裂球活检,再到现在普遍采用的囊胚活检3个阶段。囊胚滋养层细胞活检能够得到较多数目的胚胎细胞,最大限度地获得胚胎的遗传信息,且对胚胎的损伤相对较小[5]。而随着NGS的广泛应用,PGT检测结果的精确性也大大地提高[6],本研究从囊胚的发育速度和胚胎质量两方面比较不同PGT适应证患者胚胎的整倍性,并分析了PGT技术对其妊娠结局的影响。
研究表明随着女性年龄的增加,其卵子染色体非整倍体率随之增加,这也是高龄女性妊娠成功率下降的原因之一[7],本研究对高龄女性患者的259枚囊胚活检后的PGT-A结果进行了分析,发现胚胎染色体非整倍体率高达76.1%,进一步验证了高龄女性胚胎染色体的高异常率。高龄组胚胎主要为整条染色体的整倍性异常,其中包括多条染色体和单条染色体的整倍性异常。将所有囊胚根据发育天数分组比较发现,高龄患者D6囊胚的非整倍体率显著高于D5囊胚。不同发育天数的囊胚根据胚胎质量分组,D6非优质囊胚组胚胎的非整倍体率高于D5优质囊胚组,差异有统计学意义,D5非优质囊胚组与D6优质囊胚组非整倍体率相近,略高于D5优质囊胚组,低于D6非优质囊胚组,组间比较差异均无统计学意义。由此可见,高龄患者的胚胎非整倍体率较高,特别是生长发育较慢的囊胚,根据胚胎学评分选择胚胎无法达到较高的筛选作用。此外,从本研究对同期FET周期中,PGT-A高龄组与未行PGT-A高龄组的临床结局比较发现,两组患者D5、D6胚胎移植周期率及优质囊移植周期率差异均无统计学意义,PGT-A高龄组虽然仅移植1枚胚胎,移植数量显著低于未行PGT-A高龄组,但临床妊娠率、种植率及活产率均显著提高,早期流产率差异无统计学意义,进一步说明对于高龄患者,根据胚胎形态学评分选择胚胎移植并无优势,通过PGT-A筛选出整倍体胚胎后移植,能显著改善高龄患者的临床结局,减少患者移植的频率。
本中心PGT-A周期患者主要为高龄患者、RSA患者(排除子宫畸形、免疫因素、内分泌因素及夫妇双方染色体异常因素),余为反复种植失败的患者,后者例数较少,未进行统计分析。研究发现大约50%的早期流产是由于染色体异常导致的,在辅助生殖技术中发现,有大部分形态学评分较高的胚胎是非整倍体[8],不明原因的RSA,也与胚胎染色体整倍性相关[9]。本研究非高龄RSA组胚胎的非整倍体率为45.7%,4种类型的非整倍体比例相差较小,主要为单条染色体异常和嵌合体。根据囊胚发育天数分组比较,D5囊胚的非整倍体率低于D6囊胚,与高龄患者结果一致。按囊胚的质量分组后显示D6非优质囊胚的非整倍体率显著高于其余3组。不同组别间不同类型非整倍体率的比较差异无统计学意义。不同于高龄患者,对比同期FET周期中行PGT-A的非高龄RSA组与未行PGT-A的非高龄RSA组,两组的临床妊娠率、种植率、活产率和早期流产率差异均无统计学意义。两组移植的胚胎中D5、D6胚胎移植周期率及优质胚胎移植周期率差异均无统计学意义,提示在移植囊胚形态学评分及发育天数无差异的前提下,通过PGT-A选择整倍体胚胎移植,并无明显优势。
囊胚培养的过程也是胚胎筛选的过程,本研究中高龄组与非高龄RSA组D5囊胚的整倍性都显著高于D6囊胚,与多数研究结果一致[10-12]。线粒体的数量、纺锤体异常都会导致囊胚发育缓慢,从而影响胚胎的整倍体率[13-15]。但也有部分研究认为囊胚的整倍性与胚胎质量有关,与发育天数无关[16-17]。本研究的结果还提示,D6非优质囊胚的非整倍体率最高,但D5囊胚组与D6优质囊胚组的非整倍体差异不明显。值得注意的是,本研究未行PGT-A检测的非高龄RSA组患者,在遵循优先选择D5优质囊胚的前提下,能够达到和PGT-A组相近的活产率和流产率。多数研究发现PGT-A对RSA患者临床结局的改善是有限的,移植PGT-A检测后的整倍体囊胚并没有增加活产率,也没有降低流产率[18-20]。有研究认为PGT-A对于流产物基因检测结果异常的RSA患者是有效的,而对于流产物为整倍体的患者,应积极考虑胚胎以外的因素[21-22]。但Zhou T等[19]的研究发现对于<38岁有不良妊娠史的患者,PGT-A检测并没有改善其活产率和流产率,因此对于PGT-A在RSA患者的应用还需要更多随机对照实验证明。
综上,由于高龄患者胚胎的非整倍体率较高,通过PGT-A检测能够筛选出整倍体胚胎移植,改善临床结局,而对于年轻的RSA患者,由于本中心数据提示PGT-A技术无明显优势,可选择囊胚培养,优先选择D5、D6优质囊胚移植,PGT-A的应用还需要更多的证据。
