大鲵皮胶原抗氧化肽的制备及分离纯化
2023-03-13周艳华郏修齐王建文罗庆华
周艳华,郏修齐,李 涛,王建文,罗庆华
(1.长沙环境保护职业技术学院,湖南 长沙 410004;2.张家界金鲵生物产品开发有限公司,湖南 张家界 427000;3.湖南省产商品质量检验研究院,湖南 长沙 410111;4.长沙学院生物与化学工程学院,湖南 长沙 410022)
中国大鲵(Andrias davidianus)俗称娃娃鱼,是国家二级保护动物[1]。大鲵营养价值高,我国在20世纪60年代开始对大鲵进行人工养殖[2],在过去数十年间,大鲵养殖数量得到了空前发展。大鲵养殖数量的增长,促进了大鲵的精深加工,同时也产生了大量加工副产物大鲵皮。大鲵皮大量丢弃不仅会对环境造成污染,也是对资源的极度浪费。大鲵皮富含胶原蛋白,关于从大鲵皮中提取胶原蛋白的研究已有报道,周艳华等[3-4]采用胃蛋白酶从干制大鲵皮中提取胶原蛋白,采用干制粉碎、匀浆等工艺,大大地提高了大鲵皮胶原蛋白的提取率,其提取率可高达86.7%,提取得到的胶原蛋白具有较为完整的三股螺旋结构。顾赛麒等[5]采用乙酸、胃蛋白酶提取大鲵皮分别得到了酸溶性和酶溶性胶原蛋白,结果发现均为Ⅰ型胶原蛋白。杨碧仙等[6]采用盐酸提取大鲵皮中的胶原蛋白,其得率为40.2%。这些研究都为大鲵皮胶原蛋白的后续开发利用提供了可能。
自由基是存在于人体内的一种有害基团,当自由基在人体中不断累积达到一定量时,就会引发感冒、衰老、癌症等[7],因此需要不断清除人体内的自由基。抗氧化活性一般是指人体清除自由基的能力[8],目前,抗氧化活性的研究主要集中在生物活性肽[9-12]、黄酮类化合物[13]、酚类化合物[14]以及其他物质[15-16]的抗氧化活性研究。
大鲵皮中富含胶原蛋白,目前从大鲵皮中提取胶原蛋白研究其肽的抗氧化活性的报道较少,且关于大鲵皮胶原蛋白肽分离纯化和抗氧化机理等方面的研究也存在不足。因此,本研究从大鲵皮中提取胶原蛋白,并对胶原抗氧化肽的制备工艺进行研究,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为评价指标评价其抗氧化活性,在单因素分析基础上,采用正交试验进一步优化大鲵皮胶原蛋白制备抗氧化肽的工艺条件。在此基础上,进一步采用超滤、凝胶色谱等技术对大鲵皮胶原抗氧化肽进行分离纯化,分析其抗氧化活性与氨基酸组成之间的关系,以探寻大鲵皮胶原抗氧化肽的抗氧化机理。
1 材料与方法
1.1 材料与试剂
大鲵皮 张家界金鲵生物股份有限公司;羟脯氨酸标准品、DPPH、胃蛋白酶(250 U/mg) 美国Sigma公司;透析袋 上海源叶生物科技有限公司;碱性蛋白酶(20 万U/g) 南宁庞博生物工程有限公司;中空纤维超滤膜(分子质量分别为6、3 kDa)、葡聚糖凝胶树脂Sephadex G-25 美国Pharmacia公司;乙酸、氢氧化钠、正丁醇 国药集团化学试剂有限公司。
1.2 仪器与设备
AR-2140电子分析天平 奥豪斯仪器(上海)有限公司;1-4LD型冷冻干燥机 德国Alpha公司;Avanti J-26XP冷冻离心机 美国Beckman Coulter公司;PHS-3C型精密pH计 上海雷磁仪器厂;DK-98-11A恒温水浴锅、FW100万能粉碎机 天津市泰斯特仪器有限公司;SHA-B水浴恒温振荡器 常州国华电器有限公司;FYL-C020E料理机 九阳股份有限公司;UV1800紫外-可见分光光度计 上海美谱达仪器有限公司;HDB-7L核酸蛋白检测仪、CBS-A程控多功能全自动部分收集器上海沪西分析仪器有限公司;L-8800型氨基酸分析仪日本Hitachi公司。
1.3 方法
1.3.1 大鲵皮胶原蛋白制备
参考周艳华等[3]的方法,具体工艺流程如下:大鲵皮→剪成小块→60 ℃烘干→粉碎→加入0.1 mol/L NaOH去除杂蛋白→加入10%正丁醇去除脂肪→加入0.5 mol/L乙酸溶胀24 h→捣碎→大鲵皮匀浆液→加入胃蛋白酶→酶解液→盐析→胶原蛋白粗品→透析→胶原蛋白提取液→冷冻干燥→大鲵皮胶原蛋白成品。
1.3.2 大鲵皮胶原肽的制备
参考文献[17]的方法,具体操作流程如下:取5 g大鲵皮胶原蛋白加入100 mL蒸馏水制成悬浮液→调节pH值→加入碱性蛋白酶→恒温水浴酶解→灭酶(90 ℃,10 min)→离心(5 000 r/min,10 min)→取上清液→浓缩→冷冻干燥→大鲵皮胶原肽。
1.3.3 单因素试验
在底物质量浓度5 g/100 mL条件下,分别考察酶添加量(5 000、6 000、7 000、8 000、9 000 U/g)、pH值(7.5、8.0、8.5、9.0、9.5)、酶解时间(1、2、3、4、5、6 h)、酶解温度(40、45、50、55、60 ℃)对DPPH自由基清除率的影响,确定最适制备条件。
1.3.4 正交试验
在单因素试验的基础上,以DPPH自由基清除率为评价指标,对酶添加量、酶解pH值、酶解温度和酶解时间4 个因素设计L9(34)正交试验,确定酶解的最佳工艺条件,各因素及水平表如表1所示。
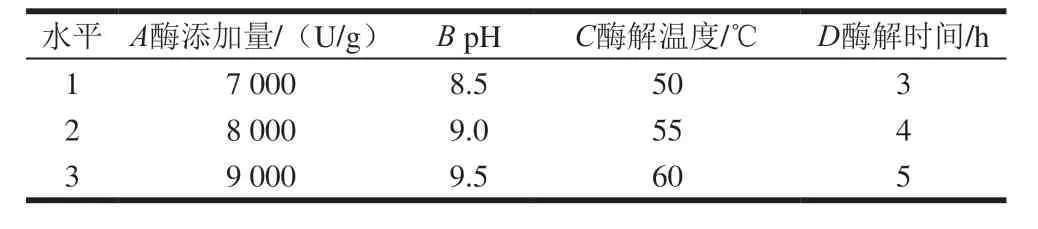
表1 正交试验因素水平Table 1 Code and level of independent variables used for orthogonal array design
1.3.5 大鲵皮胶原抗氧化肽超滤分离纯化
采用不同分子质量(6、3 kDa)的超滤膜对大鲵皮胶原肽进行超滤,分别收集不同分子质量(>6、3~6、<3 kDa)的组分,并命名为组分P1、P2、P3。将收集的3 个不同分子质量的组分经浓缩后冷冻干燥,保存备用。将组分P1、P2、P3溶解(质量浓度为5 mg/mL,下同),以DPPH自由基清除率为指标评价其抗氧化活性,分别测定其抗氧化活性。
1.3.6 大鲵皮胶原抗氧化肽凝胶色谱分离纯化
采用凝胶色谱技术,通过Sephadex G-25分离纯化,以去离子水为洗脱液洗脱样品,每5 min收集一管样品,采用核酸蛋白检测仪在220 nm处测定样品的吸光度,得到样品洗脱曲线,根据样品洗脱曲线收集不同组分的样品,经浓缩后冷冻干燥。以DPPH自由基清除率为评价指标,进一步测定经Sephadex G-25分离纯化后各组分的抗氧化活性。
1.3.7 大鲵皮胶原抗氧化肽氨基酸组成分析
将经凝胶色谱分离纯化后抗氧化活性最强的大鲵胶原抗氧化目标肽按照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》方法,采用氨基酸自动分析仪测定其氨基酸组成。
1.3.8 大鲵皮胶原蛋白提取率的测定
参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》进行羟脯胺酸含量测定。胶原蛋白质量(g)由其所含的羟脯氨酸质量乘以换算系数(11.1)得到。大鲵皮胶原蛋白提取率按下式计算。
式中:m1为酶解液中羟脯氨酸质量/g;m2为大鲵皮中胶原蛋白质量/g;n为稀释倍数。
1.3.9 大鲵皮胶原肽抗氧化活性的测定
以DPPH自由基清除率为指标评价其抗氧化活性。DPPH自由基清除率测定方法参照GB/T 39100—2020《多肽抗氧化性测定DPPH和ABTS法》。
1.4 数据处理
实验数据以平均数±标准差表示,采用SPSS 19.0软件进行单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。所有实验均重复3 次。
2 结果与分析
2.1 最佳碱性蛋白酶添加量的确定
由图1可知,当碱性蛋白酶添加量为5 000~8 000 U/g时,随着酶添加量的增加,大鲵皮胶原肽抗氧化活性增长较快,差异显著(P<0.05)。当酶添加量达到8 000 U/g之后,其抗氧化活性增长趋于平缓。这是由于在酶解过程中,随着酶添加量的增加,酶与大鲵皮胶原蛋白不断反应,产生小分子肽,随着小分子肽数量的增加,其抗氧化活性也逐渐增强[18]。然而,当酶添加量达到8 000 U/g之后,由于碱性蛋白酶与大鲵皮胶原蛋白基本反应完全,因此,当酶添加量继续增加时,其抗氧化活性的增长亦趋于平稳。从经济因素考虑,选择酶添加量为8 000 U/g为宜。
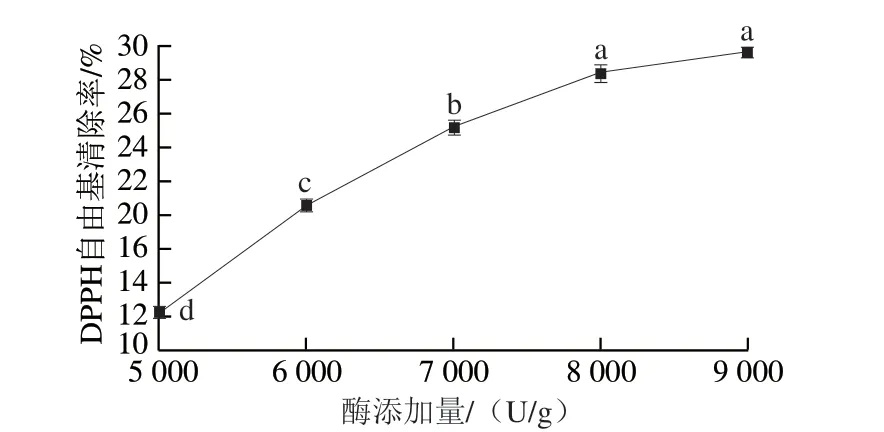
图1 碱性蛋白酶添加量对大鲵皮胶原肽抗氧化活性的影响Fig. 1 Effect of alkaline protease dosage on the DPPH radical scavenging activity of antioxidant peptides from giant salamander skin collagen
2.2 最佳酶解pH值的确定
由图2 可知,随着酶解液p H 值的增加,大鲵皮胶原肽抗氧化活性呈现先升后降的趋势。酶解pH值为7.5~8.0时,DPPH自由基清除率显著上升(P<0.05);pH 8.0~9.0时,DPPH自由基清除率显著上升(P<0.05);当酶解液pH 9.0时,其抗氧化活性最高。这可能与碱性蛋白酶在pH 9.0时酶活性高有关。当酶活性较高时,其作用于大鲵皮胶原蛋白的位点较多,产生的大鲵皮胶原小分子肽数量增多,其清除DPPH自由基的活性增强,因此,抗氧化活性也增强[17]。

图2 pH值对大鲵皮胶原肽抗氧化活性的影响Fig. 2 Effect of pH on the DPPH radical scavenging activity of antioxidant peptides from giant salamander skin collagen
2.3 最佳酶解时间的确定
由图3可知,酶解1~4 h时,随着酶解时间的延长,大鲵皮胶原肽抗氧化活性显著增加(P<0.05);当酶解时间达到4 h后,抗氧化活性增长趋于平缓。这是由于在酶解过程中,随着酶解时间延长,酶与底物大鲵皮胶原蛋白不断反应,产生小分子肽,随着小分子肽数量的增加,其抗氧化活性也逐渐增强[19]。此外,当酶解时间达到4 h之后,由于碱性蛋白酶与大鲵皮胶原蛋白基本反应完全,因此,当酶解时间继续延长时,抗氧化活性的增长亦趋于平稳。因此,从经济因素考虑,选择酶解时间4 h为宜。
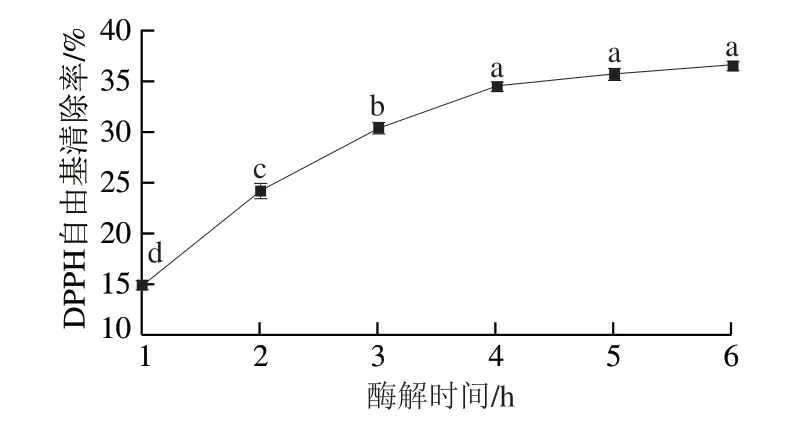
图3 酶解时间对大鲵皮胶原肽抗氧化活性的影响Fig. 3 Effect of enzymatic hydrolysis time on the DPPH radical scavenging activity of antioxidant peptides from giant salamander skin collagen
2.4 最佳酶解温度的确定
由图4可知,随着酶解温度的增加,大鲵皮胶原肽抗氧化活性先升后降。根据单因素方差分析可知,在温度为40~55 ℃时,DPPH自由基清除率显著上升;当酶解温度为55 ℃时,DPPH自由基清除率最高,抗氧化活性最高。这可能与碱性蛋白酶在温度为55 ℃时其酶活性高有关。当酶活性高时,产生的小分子肽数量增多,其清除DPPH自由基的活性也随之增强,因此,其抗氧化活性也增加[20]。

图4 酶解温度对大鲵皮胶原肽抗氧化活性的影响Fig. 4 Effect of enzymatic hydrolysis temperature on the DPPH radical scavenging activity of antioxidant peptides from giant salamander skin collagen
2.5 碱性蛋白酶酶解大鲵皮胶原蛋白制备抗氧化肽工艺条件正交试验结果
在单因素的基础上,根据上述制定的因素和水平表,以DPPH自由基清除率为评价指标,对酶添加量(A)、酶解pH值(B)、酶解温度(C)和酶解时间(D)4 个因素设计L9(34)正交试验,结果如表2所示。

表2 正交试验结果Table 2 Orthogonal array design and experimental results
由正交试验极差值可知,影响DPPH自由基清除率各因素的主次关系为:酶解时间>酶解温度>酶添加量>酶解pH值,酶解时间对大鲵皮胶原肽抗氧化活性影响最显著。由表2可知,大鲵皮胶原抗氧化肽酶解的最佳条件组合为A3B2C2D3,即酶添加量9 000 U/g、酶解pH 9.0、酶解温度55 ℃、酶解时间5 h,在此工艺条件下进行验证试验,最终得到大鲵皮胶原肽DPPH自由基清除率为42.5%。此外,从环保和节能的角度考虑,进一步优化酶解条件组合,即A2B2C2D2(酶添加量8 000U/g、酶解pH 9.0、酶解温度55 ℃、时间4 h),在此基础下进行验证试验,结果表明大鲵皮胶原肽DPPH自由基清除率为40.2%。
大鲵皮胶原蛋白肽具有较强的抗氧化活性。周艳华等[17]的研究中,大鲵皮胶原肽抗氧化活性以羟自由基为评价指标,对酶解工艺进行了研究,但未对其他自由基进行评价,且研究只对初步酶解进行研究,并未涉猎后续分离纯化,因此对其清除羟自由基的作用机理尚不清晰。本研究进一步以DPPH自由基清除能力为评价指标研究了大鲵皮胶原蛋白肽抗氧化活性,得到最适酶解工艺。
2.6 大鲵皮胶原抗氧化肽超滤分离纯化
超滤是一种根据被分离物分子质量大小不同而实现分离纯化的技术[21]。通过试验优化,在酶添加量8 000 U/g、酶解pH 9.0、酶解温度55 ℃、酶解时间4 h条件下制备大鲵皮胶原抗氧化肽,其清除DPPH自由基的活性较高。将其通过不同分子质量(6、3 kDa)的超滤膜,得到3 个组分P1(>6 kDa)、P2(3~6 kDa)、P3(<3 kDa)。以DPPH自由基清除率为评价指标,分别测定组分P1、P2、P3的抗氧化活性。由表3可知,P3具有较强的抗氧化活性,其抗氧化活性明显高于原酶解液和其他2 个组分。P1、P2、P3抗氧化活性存在差异,这可能与碱性蛋白酶作用于不同的酶切位点,其酶解产物暴露出不同的氨基酸残基有关[22]。经对比,P3的抗氧化活性比原酶解液提高16.5%。表明通过超滤,大鲵皮胶原小分子肽具有更高的抗氧化活性。这一结果与先前研究结果相符,小分子肽具有更强的抗氧化活性[23-25]。因此,将超滤组分P3继续进行下一步的分离纯化。
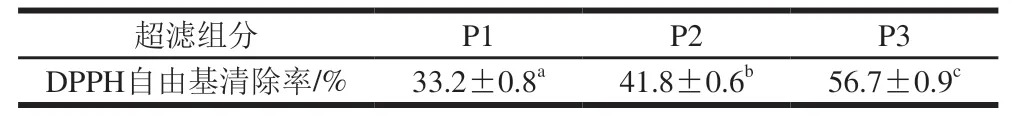
表3 超滤组分的抗氧化活性Table 3 Antioxidant activity of ultrafiltration filtrations
2.7 大鲵皮胶原抗氧化肽凝胶色谱分离纯化
采用凝胶色谱技术分离,通过Sephadex G-25分离纯化P3,得到3 个组分SP1、SP2、SP3,以DPPH自由基清除率为评价指标,分别测定组分SP1、SP2、SP3的抗氧化活性。由表4可知,SP3具有较强的抗氧化活性,DPPH自由基清除率为72.3%,高于纯化前的P3。表明通过凝胶色谱分离纯化技术,大鲵皮胶原小分子肽进一步得到纯化,具有更高的抗氧化活性。肽是介于蛋白质与氨基酸的中间产物,肽的分子质量不同,其生理活性也存在差异。一般认为,小分子肽具有更强的生理活性。凝胶色谱分离技术根据分子质量大小对不同对物质进行分离,分子质量大的物质先出峰,分子质量小则后出锋。根据凝胶色谱图可以看出SP3相对分子质量更小(图5)。通过测定抗氧化活性,发现其抗氧化活性更高,与小分子肽具有更强的抗氧化活性的结果一致。
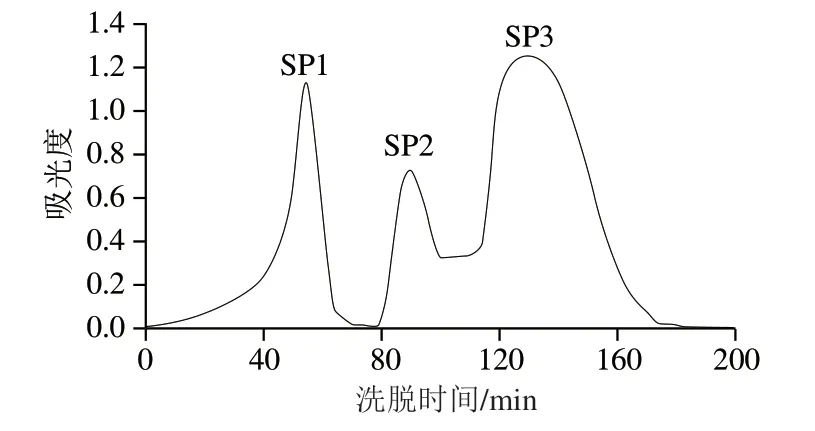
图5 大鲵皮胶原抗氧化肽凝胶色谱分离纯化Fig. 5 Gel permeation chromatogram of antioxidant peptides from giant salamander skin collagen

表4 凝胶色谱组分的抗氧化活性Table 4 Antioxidant activity of gel chromatography fractions
2.8 大鲵皮胶原抗氧化肽氨基酸组成分析
采用氨基酸自动分析仪技术进一步分析SP3的氨基酸组成。由表5可知,大鲵皮胶原抗氧化肽氨基酸组成中,甘氨酸、脯氨酸含量较高,胱氨酸含量较低,这一特征符合胶原抗氧化肽的氨基酸组成特征[26]。除甘氨酸、脯氨酸含量较高外,大鲵皮胶原蛋白抗氧化肽中还含有较高含量的丙氨酸、精氨酸、谷氨酸、亮氨酸等氨基酸。据报道,具有疏水性氨基酸(亮氨酸、缬氨酸、丙氨酸、脯氨酸、苯丙氨酸、甘氨酸、异亮氨酸、苯丙氨酸)、芳香族氨基酸(酪氨酸、色氨酸,组氨酸)、含硫氨基酸(胱氨酸、甲硫氨酸)、酸性氨基酸(谷氨酸、天冬氨酸)和碱性氨基酸(赖氨酸、精氨酸)的肽具有较强的抗氧化活性[27-31]。这可能是大鲵皮胶原抗氧化肽SP3具有较高抗氧化活性的原因。

表5 大鲵皮胶原抗氧化肽SP3的氨基酸组成分析Table 5 Analysis of amino acid composition of antioxidant peptide SP3
3 结 论
本研究以DPPH自由基清除率为指标评价大鲵皮胶原抗氧化肽抗氧化活性,确定了制备大鲵皮胶原抗氧化肽的最适工艺条件:酶添加量8 000 U/g、酶解pH 9.0、酶解温度55 ℃、酶解时间4 h。在此工艺条件下,大鲵皮胶原抗氧化肽DPPH自由基清除率为40.2%。采用超滤分离得到3 个分子质量不同的组分,结果表明,P3(<3 kDa)具有较强的抗氧化活性,其DPPH自由基清除率为56.7%。在此基础上,进一步采用凝胶色谱技术分离,通过Sephadex G-25分离纯化P3,得到3 个不同分子质量大小的组分,其中SP3具有较强的抗氧化活性,其DPPH自由基清除率为72.3%。最后采用氨基酸自动分析仪技术进一步分析SP3的氨基酸组成,探寻大鲵皮胶原肽抗氧化活性与其氨基酸组成之间的内在联系,结果表明大鲵皮胶原抗氧化肽氨基酸组成中,甘氨酸、脯氨酸含量较高,胱氨酸含量较低,这一特征符合胶原抗氧化肽的氨基酸组成特征。除了甘氨酸、脯氨酸含量较高外,大鲵皮胶原蛋白抗氧化肽中还含有较高含量的具有明显抗氧化活性的丙氨酸、精氨酸、谷氨酸、亮氨酸等氨基酸,这可能是大鲵皮胶原抗氧化肽SP3具有较高抗氧化活性的原因。后续研究可采用DNA翻译、肽测序仪、电喷雾电离和基质辅助激光解吸电离飞行时间质谱等技术[32]分析SP3的肽序列,以进一步探寻大鲵皮胶原抗氧化肽的抗氧化机理。
