不同年龄近视儿童使用0.01%阿托品滴眼液的有效性观察
2023-03-13吉成玉
胡 兰,林 静,李 杰,吉成玉,徐 玲
0 引言
近视是全球范围内被广泛关注的公共卫生问题。近年来,全球近视患病率显著增加,Holden等[1]研究表明,预计到2050年,近视患者会占全球总人口的50%,其中高度近视的患病率可达10%。我国2020年的调查显示儿童青少年近视患病率为52.7%,其中小学生为35.6%,初中生为71.1%,高中生为80.5%[2],由此数据我们可以看出中国青少年近视现况非常严峻,呈现着高发性、低龄化的趋势。
阿托品作为非选择性M受体拮抗剂,其控制近视的作用机制尚不明确,可能是通过视网膜脉络膜和巩膜的抗毒蕈碱受体来控制近视。目前我国0.01%阿托品滴眼液在近视治疗中的使用也日益广泛,虽然大量临床研究表明0.01%阿托品可以有效缓解近视进展,并且减少了高浓度阿托品引起的调节麻痹等副作用和停药后的反弹效应[3-7]。但LAMP研究表明0.01%阿托品和安慰剂组相比,没有明显的延缓眼轴增长的作用,建议使用0.05%阿托品控制近视进展[8-9]。本试验进一步观察了0.01%阿托品在近视控制方面的有效性,并检查其对眼压、调节功能、泪膜相关参数的影响,进一步明确用药的安全性。除此之外,我们对不同年龄儿童的屈光度、眼轴控制效果进行了对比,试图寻找0.01%阿托品滴眼液的最佳使用年龄。
1 对象和方法
1.1对象本研究为随机、双盲、安慰剂平行对照、单中心临床研究。纳入2019-05/2020-05就诊于本院的近视儿童295例。纳入标准:(1)年龄6~13周岁,性别不限;(2)有近视防控需求者;(3)双眼近视球镜度数-0.5~-6.00D,散光度数≤2.0D;(4)已获得受试者的法定监护人(父母)同意并签署知情同意书,且儿童本人已经口头表达愿意参与研究的意愿。排除标准:(1)伴有其他眼病,如弱视、恒定性斜视、急性角结膜炎、先天性青光眼或其他眼底疾病等;(2)眼部及全身病变需局部或全身使用阿托品或吡嗪类药物者;(3)对阿托品过敏,或患有全身性疾病(如心脏或呼吸系统疾病);(4)筛选前3mo内使用过、正在使用或计划在研究期间使用角膜塑形镜、RGP、周边离焦及渐进多焦点眼镜等其他近视防控手段者;(5)存在研究者认为不适合参加本研究的其他情况。本研究已获得沈阳何氏眼科医院医学伦理委员会批准,所有程序遵循《赫尔辛基宣言》,所有受试者及其法定监护人均签署知情同意书。
1.2方法
1.2.1治疗方法试验组每晚睡前双眼结膜囊内滴入0.01%阿托品滴眼液,对照组滴入安慰剂(等渗赋形剂)各1滴,每晚用药1次,连续用药12mo。本研究中的药物使用均在医生的指导下进行,试验药物不同分组的外包装保持一致,并使用同一名称:“硫酸阿托品滴眼液临床研究用药”。
1.2.2观察指标以右眼为目标眼,记录两组患者治疗前,治疗3、6、9及12mo屈光度、眼轴、眼压、调节幅度、最佳矫正远视力(best corrected distance visual acuity,BCDVA)、最佳矫正近视力(best corrected near visual acuity,BCNVA)、瞳孔直径、泪膜相关参数及不良反应。用药2wk仅记录眼压、调节幅度、BCDVA、BCNVA、瞳孔直径及泪膜相关参数及不良反应;其中治疗前、治疗6及12mo需行睫状肌麻痹验光。
1.2.2.1视力应用远近标准对数视力表进行BCDVA及BCNVA的检查,远视力检查距离为5m,近视力检查距离为40cm。
1.2.2.2眼压应用非接触眼压计进行眼压测量3次,取平均值。
1.2.2.3瞳孔直径采用Pentacam眼前节分析仪测量亮瞳直径。
1.2.2.4调节幅度采用移近法测量调节幅度,完全矫正屈光后,注视近视力表上最佳视力的上一行单个视标,视标缓慢向被检者移近,直至视标变模糊。视标卡与眼镜平面距离的倒数即为调节幅度,重复测量3次,取平均值。
1.2.2.5眼轴采用NIDEK AL-Scan光学生物测量仪测量眼轴,重复测量6次,取平均值。
1.2.2.6泪膜相关参数采用OCULUS Keratograph眼表综合分析仪测量泪河高度、平均泪膜破裂时间(tear break-up time,BUT)及睑板腺照相。
1.2.2.7睫状肌麻痹验光采用1%盐酸环喷托酯滴眼液每10min 1次,连续3次,30min后电脑自动验光测定双眼等效球镜度数并进行睫状肌麻痹后验光。
1.2.2.8不良反应观察两组患者治疗期间不良反应的发生情况。
统计学分析:采用SPSS23.0进行分析,对不同组别间的分类资料进行卡方检验,当四格表中存在理论频数小于5的单元格时,采用Fisher确切概率法检验。定量指标的组间比较方差齐时采用独立样本t检验,方差不齐时采用t’检验,除治疗后各时点两组瞳孔直径方差不齐外,其余指标方差齐。重复测量数据采用重复测量方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1两组患者治疗前基线资料比较共纳入患者295例,以2∶1的比例随机分配到试验组(197例)及对照组(98例)进行治疗,所有患者均完成随访。两组患者治疗前基线资料比较差异均无统计学意义(P>0.05),见表1。
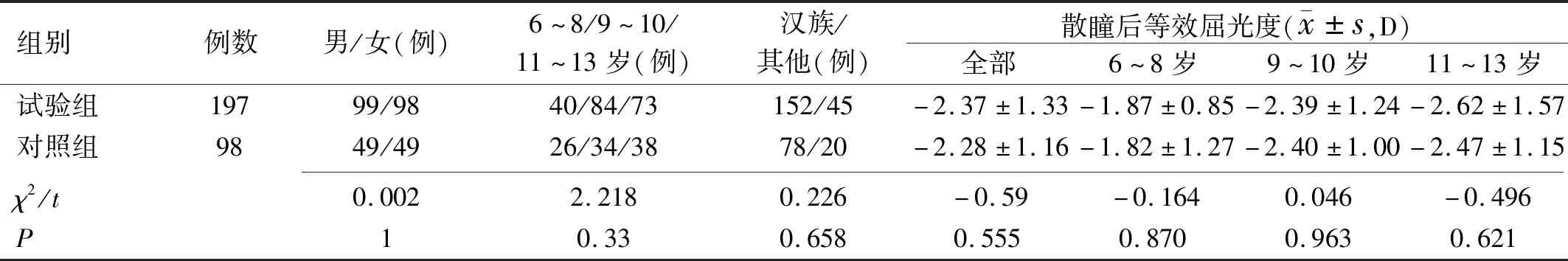
表1 两组患者治疗前基线资料比较
2.2两组患者治疗后有效性观察
2.2.1两组患者治疗前后等效屈光度比较两组患者治疗前后等效屈光度比较组间差异无统计学意义(F组间=0,P组间=0.983);时间和交互作用差异均有统计学意义(F时间=81.101,P时间<0.001;F交互=4.572,P交互=0.013)。两组患者治疗6及12mo散瞳后等效屈光度与治疗前比较差异均有统计学意义(P<0.001),治疗6mo与治疗12mo比较差异有统计学意义(P<0.001),见表2。用药12mo后,试验组及对照组年等效屈光度增长≤0.5D患者分别为141例(71.6%)及50例(51.0%),差异有统计学意义(χ2=12.112,P=0.001),试验组及对照组年等效屈光度增长≥1.0D患者分别为30例(15.2%)及26例(26.5%),差异有统计学意义(χ2=5.533,P=0.027)。

表2 两组患者治疗前后等效屈光度比较
2.2.2两组患者治疗前后眼轴比较两组患者治疗前后眼轴比较组间差异无统计学意义(F组间=0.727,P组间=0.394);时间和交互作用差异有统计学意义(F时间=199.025,P时间<0.001;F交互=4.928,P交互=0.002)。两组患者治疗3、6、9及12mo眼轴与治疗前比较差异均有统计学意义(P<0.001),治疗6、9及12mo与治疗3mo比较差异均有统计学意义(P<0.001),治疗9、12mo与治疗6mo比较差异均有统计学意义(P<0.001),治疗9mo与治疗12mo比较差异有统计学意义(P<0.001),见表3。
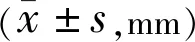
表3 两组患者治疗前后眼轴比较
2.2.3两组间不同年龄段患者等效屈光度变化比较治疗12mo后,试验组等效屈光度变化为-0.37±0.69D,对照组为-0.59±0.65D,两组患者比较差异有统计学意义(t=-2.667,P=0.008)。两组间不同年龄段患者等效屈光度变化比较:6~8岁差异无统计学意义(t=0.054,P=0.957);9~10岁差异有统计学意义(t=2.056,P=0.042);11~13岁差异有统计学意义(t=2.33,P=0.022),见表4。

表4 两组间不同年龄段患者等效屈光度变化比较
2.2.4两组间不同年龄段患者眼轴变化比较治疗12mo后试验组眼轴变化为0.29±0.24mm,对照组为0.37±0.23mm,两组间眼轴变化比较差异有统计学意义(t=2.760,P=0.006)。两组间不同年龄段患者眼轴变化比较:6~8岁差异无统计学意义(t=-0.623,P=0.536);9~10岁差异有统计学意义(t=-2.057,P=0.042);11~13岁差异有统计学意义(t=-2.424,P=0.017),见表5。
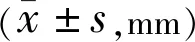
表5 两组间不同年龄段患者眼轴变化比较
2.3安全性观察
2.3.1两组患者治疗前后调节幅度比较两组患者治疗前后调节幅度比较组间差异无统计学意义(F组间=0.878,P组间=0.349);时间和交互作用差异有统计学意义(F时间=3.34,P时间=0.014;F交互=3.607,P交互=0.009)。试验组患者治疗2wk,3、6、9、12mo调节幅度与治疗前比较差异均有统计学意义(P<0.001),治疗2wk与治疗12mo比较差异有统计学意义(P<0.001),其余各时间点两两比较差异无统计学意义(P>0.05),试验组调节幅度呈现轻度下降表现。对照组患者治疗前后各时间点两两比较差异均无统计学意义(P>0.05),见表6。

表6 两组患者治疗前后调节幅度比较
2.3.2两组患者治疗前后瞳孔直径比较两组患者治疗前后瞳孔比较组间、时间和交互作用差异均有统计学意义(F组间=110.344,P组间<0.001;F时间=28.42,P时间<0.001;F交互=32.294,P交互=0.013)。试验组患者治疗2wk,3、6、9、12 mo瞳孔直径与治疗前比较差异均有统计学意义(P<0.001),治疗3、6、9、12mo与治疗2wk比较差异均有统计学意义(P<0.001),治疗后3mo与9mo比较差异有统计学意义(P<0.05),其余各时间点两两比较差异均无统计学意义(P>0.05)。对照组治疗前后各时间点两两比较差异均无统计学意义(P>0.05),见表7。
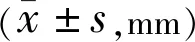
表7 两组患者治疗前后瞳孔直径比较
2.3.3两组患者治疗前后BCNVA比较两组患者治疗前后BCNVA比较组间、时间和交互作用差异均无统计学意义(F组间=3.465,P组间=0.064;F时间=2.541,P时间=0.058;F交互=0.669,P交互=0.565),见表8。
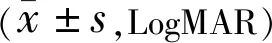
表8 两组患者治疗前后BCNVA比较
2.3.4两组患者治疗前后眼压比较两组患者治疗前后眼压比较,组间和交互作用差异均无统计学意义(F组间=1.275,P组间=0.26;F交互=0.751,P交互=0.58),时间差异有统计学意义(F时间=11.602,P时间<0.001)。试验组患者治疗3、6、9、12mo眼压与治疗前比较差异均有统计学意义(P<0.05),治疗12mo与治疗2wk比较差异有统计学意义(P<0.05),其余各时间点两两比较差异均无统计学意义(P>0.05);对照组患者治疗后6、9、12mo与治疗前比较差异均有统计学意义(P<0.05),其余各时间点两两比较差异均无统计学意义(P>0.05),见表9。
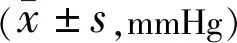
表9 两组患者治疗前后眼压比较
2.3.5两组患者治疗前后泪河高度比较两组患者治疗前后泪河高度比较组间和交互作用差异均无统计学意义(F组间=0.272,P组间=0.602;F交互=0.489,P交互=0.785),时间差异有统计学意义(F时间=3.375,P时间=0.005),试验组患者治疗6mo与治疗前、治疗2wk比较差异均有统计学意义(P<0.05),其余各时间点两两比较差异均无统计学意义(P>0.05);对照组患者治疗3、6、9mo与治疗前比较差异均有统计学意义(P<0.05),其余各时间点两两比较差异均无统计学意义(P>0.05),见表10。
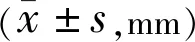
表10 两组患者治疗前后泪河高度比较
2.3.6两组患者治疗前后泪膜破裂时间比较两组患者治疗前后泪膜破裂时间比较组间和交互作用差异均无统计学意义(F组间=0.775,P组间=0.379;F交互=0.14,P交互=0.983),时间差异有统计学意义(F时间=3.37,P时间=0.005),试验组患者治疗后6mo与治疗前比较差异有统计学意义(P<0.05),其余各时间点两两比较差异均无统计学意义(P>0.05);对照组患者治疗后6mo与治疗前比较差异有统计学意义(P<0.05),其余各时间点两两比较差异均无统计学意义(P>0.05),见表11。
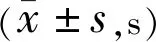
表11 两组患者治疗前后泪膜破裂时间比较
2.4两组患者不良事件发生情况比较治疗过程中,两组患者不良事件发生情况比较差异均无统计学意义(P>0.05),见表12。
3 讨论
近年我国近视呈现高发、低龄化趋势,角膜塑形镜、离焦镜片是我国目前控制近视的主要光学矫正方法,但并不是所有患者的近视控制效果都理想。阿托品滴眼液在近视方面的应用可追溯到20世纪六七十年代,多项研究证明阿托品在控制近视方面有显著效果,可作为近视防控的又一辅助手段。高浓度(1%、0.5%及0.1%)阿托品滴眼液抑制近视度数及眼轴的增长作用明显,但其容易引起明显的不良反应,如畏光、视近模糊等,因此不适合长期应用[10-12]。而低浓度阿托品滴眼(0.01%、0.025%及0.05%)不但具有有效的近视控制作用,不良反应也相对较轻[3-7],因此患者接受度较高。不同浓度的低浓度阿托品如何选择?是否和年龄相关?目前还不清楚,因此本研究不但观察了0.01%阿托品滴眼液的有效性及安全性,还观察了不同年龄儿童的近视控制效果。
本研究结果显示,随着用药时间的延长,0.01%阿托品滴眼液控制屈光度及眼轴增长的有效性优于对照组,两组等效屈光度变化分别为-0.37±0.69、-0.59±0.65D(P=0.008),眼轴变化分别为0.29±0.24、0.37±0.23mm(P=0.006)。试验组与对照组间屈光度及眼轴变化量差异分别为0.22D及-0.08mm,研究结果与Yam等[8]研究结果相似,其研究结果显示使用0.01%阿托品12mo后,试验组与对照组间屈光度及眼轴变化量差异分别为0.22D及-0.05mm。Wei等[3]结果显示0.01%组51%儿童近视进展<0.5D,13.2%儿童近视进展>1.0D,这与我们的研究结果也类似,试验组及对照组年等效屈光度增长≤0.5D的受试者比率分别为71.6%及51.0%(P=0.001),年等效屈光度增长≥1.0D的受试者比率分别为15.2%及26.5%(P=0.027)。本研究还发现,与对照组相比,低龄组(6~8岁)使用0.01%阿托品滴眼液控制屈光度及眼轴变化作用不明显(P=0.957及P=0.536);相对高龄组使用0.01%阿托品滴眼液控制屈光度及眼轴变化作用明显(P9~10 岁=0.042及P9~10岁=0.042;P11~13岁=0.022及P11~13岁=0.017)。关于年龄与0.01%阿托品使用效果的研究并不多,Wang等[13]研究发现6岁儿童使用0.05%阿托品滴眼液2a等效屈光度平均变化为-0.90D,这个结果和8岁儿童使用0.025%阿托品滴眼液及10岁儿童使用0.01%阿托品滴眼液的2a等效屈光度变化相似(分别为-0.89D及-0.99D)。因此我们考虑尽管0.01%阿托品滴眼液有良好的近视度数及眼轴控制作用,但低龄儿童用药的控制效果并不理想,初期可尝试使用0.025%或0.05%阿托品滴眼液。近视早发是近视进展快速的一个主要危险因素[14],这可能是低龄儿童使用0.01%阿托品控制效果不佳的原因。
国内外多项研究已证明0.01%阿托品对调节及瞳孔的影响[15-17],用药后平均调节幅度下降约1.50~3.00D,瞳孔散大约0.5~1mm。本研究用药12mo后,阿托品组调节幅度轻度下降,亮瞳直径轻度散大,瞳孔散大程度在用药2wk时最为明显(4.28±0.79mm),随着用药时间延长,散大的瞳孔出现轻微回退表现,用药3mo后趋于稳定。阿托品组仅6%受试者出现畏光,1%受试者出现视近模糊现象,且多在用药2w时报告,后期症状缓解,这可能与早期瞳孔散大最为明显相关。除此之外,本研究还关注了阿托品对泪膜的影响。尽管有报道显示抗胆碱能药物能抑制腺体分泌,使黏蛋白层和水样液层分泌受影响[18],但有研究发现低浓度阿托品3~6mo的连续应用不会引起泪膜损伤[19-21],这与本研究结果一致,0.01%阿托品滴眼液对角膜荧光素染色、泪河高度、泪膜破裂时间无显著影响,耐受性良好。
综上所述,本研究发现0.01%硫酸阿托品滴眼液的使用有助于控制儿童近视的进展,尽管药物可以引起瞳孔轻度散大,调节幅度降低,但近视儿童耐受性良好。6~8岁低龄儿童使用0.01%阿托品滴眼液控制近视的效果并不显著,针对这种患者,可考虑提升阿托品使用浓度。本研究仍存在一定局限性,近视控制需要长期评估,最好进行2a以上的观察,而本研究随访时间仅1a,随访时间相对较短。其次,本研究并没有对户外活动时间、近距离用眼时间、生长发育速度及遗传等因素进行分析,不能排除混杂因素的影响。更加科学、合理的应用阿托品防控近视仍然是当前研究的主要方向,最佳浓度、使用方法、联合应用策略仍需进一步研究讨论。
