腹腔镜下低位前切除术中保留左结肠动脉对直肠癌患者疗效及预后的影响
2023-03-13陈小保梅天明柳长青
陈小保, 梅天明, 魏 俊, 柳长青, 章 涛
(安徽医科大学附属宿州医院胃肠外科, 安徽 宿州 234000)
2018年一项调查显示,我国结直肠癌的发病率及死亡率约占全部恶性肿瘤的第3及第5位[1]。腹腔镜下全直肠系膜切除术(TME)具有术后复发率低的特点,逐渐成为治疗直肠癌的主流术式。近年来,TME治疗的疗效及安全性已被临床认可,成为中低位直肠癌手术中贯彻的原则,但该术中对肠系膜下动脉(IMA)的结扎部位及淋巴结清扫方式,尚有争议[2]。IMA的离断方式主要包括不保留左结肠动脉(LCA)及保留LCA两种,以往普遍认为前者可保证IMA根部淋巴结彻底清除,避免疾病复发。但越来越多研究显示,保留LCA不仅可保障患者左半结肠血供,且对生存期无明显影响[3]。目前关于上述两种IMA离断方式的疗效差异仍需大量临床资料支持。本研究旨在探究腹腔镜下低位前切除术中保留或不保留LCA对患者胃肠功能及复发转移的影响,现报道如下。
1 资料与方法
1.1一般资料:回顾性分析2018年4月至2021年2月收治的85例患者的临床资料。根据治疗方式不同分为观察组(术中保留LCA,n=40例)和对照组(术中不保留LCA,n=45例)。病例纳入标准:①符合直肠癌诊疗标准[4]:患者排便习惯改变,腹痛、腹部肿块或现肠梗阻相关症状,肠镜、磁共振等检查发现直肠肿瘤,组织病理学诊断提示癌变;②年龄29~76岁之间,均顺利完成手术,无中转开腹;③直肠癌TNM分期Ⅰ~Ⅲ期,肿瘤下缘距离肛缘4~8cm[5];④无远端转移;⑤术前未行新辅助治疗;⑥自愿参加研究者。排除标准:①直肠癌复发或合并其他恶性肿瘤者;②术后标本组织学检查近端、远端或环周边缘(+)者;③重要脏器功能异常者;④合并血液系统疾病、染色体疾病或全身传染性疾病者;⑤临床资料不全者。本研究符合赫尔辛基人体试验准则,经医院伦理委员会批准(A2020006)。两组一般资料比较差异无统计学意义(P>0.05),见表1。
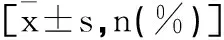
表1 两组一般资料比较
1.2方法:患者静脉麻醉,常规五孔法穿刺,人工气腹后分别于脐部(10mm)、脐旁左右腹直肌外缘(5mm)、右侧下腹(12mm)及左下腹(5mm)做操作孔;以骶骨岬下方直肠系膜薄弱处为手术入路,两组均按照直肠癌TME原则完成直肠低位前切除术:①观察组保留LCA:于脐部置入腹腔镜探查IMA及静脉解剖结构,沿Toldt间隙游离乙状结肠系膜,向上游离至IMA根部,并解剖使其骨骼化,打开根部血管鞘,裸化IMA暴露分支LCA、乙状结肠动脉及直肠上动脉,分离过程中注意保护腹下神经;于LCA下方1cm处切断IMA,保留LCA;在IMA根部外侧1cm处结扎并切断肠系膜下静脉根部,同时完成血管周围脂肪及第253组淋巴结清扫,系膜根部淋巴结清扫应由近及远行整块切除;而后以TME原则完成直肠肿瘤切除,肠管吻合,消化道重建等操作。②对照组不保留LCA:解剖出IMA,清扫周围脂肪及淋巴结后,于IMA根部1cm处结扎切断,继续分离肠系膜下静脉,清扫周围淋巴结;后续肿瘤切除等操作同观察组。根据术后组织病理学结果,TNM分期为Ⅱ~Ⅲ期的患者接受mFOLFOX6方案辅助化疗。本研究中所有患者由同组医师施术。
1.3观察指标:①比较两组术中出血量、淋巴结总清扫数、手术时间、第253组淋巴结清扫数目、术中残端缺血性改变、预防性造口例数;②比较两组术后首次排气时间、进食流质时间、住院时间;③比较两组手术前后肠胃动力及肛门功能(Wexner便秘评分):分别于两组患者术前1d及术后3d留取其清晨空腹外周静脉血,运用全自动生化分析仪以放射免疫法检测胃动素(motilin,MTL)及胃泌素(gastrin,GAS)水平;Wexner便秘评分[6]包括排便完整性、在厕所时间等评估内容,总分0~30分,分值越高表示肛门功能越差,本研究中所有患者的Wexner评分均由同一名医护人员记录;④叮嘱患者术后定期行门诊CT(胸部+全腹+盆腔增强扫描)复检,观察肠壁增厚、淋巴结肿大及外血管侵犯情况,记录复发转移率;⑤记录两组随访期间吻合口漏、切口感染、尿潴留等并发症发生情况。
2 结 果
2.1两组手术相关指标比较:对照组的手术时间显著短于观察组(P<0.05),两组术中出血量、淋巴结总清扫数目、第253组淋巴结清扫数目、术中残端缺血性改变数及预防性造口数比较差异无统计学意义(P>0.05),见表2。
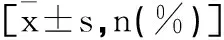
表2 两组手术相关指标比较
2.2两组术后恢复情况比较:观察组的术后首次排气时间及住院时间显著短于对照组(P<0.05),两组进食流质时间比较差异无统计学意义(P>0.05),见表3。
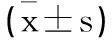
表3 两组术后恢复情况比较
2.3两组手术前后胃肠动力及肛门功能比较:术后两组血清MTL、GAS水平较术前明显降低(P<0.05),Wexner便秘评分较术前明显升高(P<0.05),但两组上述指标治疗前后的差值比较差异均无统计学意义(P>0.05),见表4。
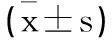
表4 两组手术前后胃肠动力及肛门功能比较
2.4两组复发转移情况比较:随访12个月时,观察组局部复发1例(2.50%),对照组局部复发3例(6.67%),组间比较差异无统计学意义(χ2=0.154,P>0.05);观察组肝脏转移2例(5.00%),对照组肝脏转移3例(6.67%),组间比较差异无统计学意义(χ2=0.018,P>0.05)。
2.5两组并发症比较:随访12个月期间,两组吻合口漏、吻合口出血、泌尿系统感染等并发症发生率比较差异无统计学意义(P>0.05),见表5。

表5 两组并发症比较n(%)
3 讨 论
肿瘤的TME治疗遵循根治性切除原则,对于中低位直肠癌患者除保证直肠系膜的完整性之外,IMA根部淋巴结彻底清扫也是评价手术疗效的重要因素。IMA根部淋巴结,既中央区淋巴结,日本大肠癌病理规约将其命名为第253组淋巴结,该组织位于IMA起始部及LCA起始处之间,是直肠癌细胞向远处转移的最后一道屏障[7]。故以往治疗中,多数专家认为于IMA根部结扎可整块清除第253组淋巴结,对术后生存期有益[8]。但随着临床不断研究发现,IMA的不同处理方式与淋巴结清扫数目之间无明显相关性,且国内学者更推荐保留LCA治疗,以更好的保证吻合口血供[9]。本研究中85例直肠癌患者,分别接受保留或不保留LCA的腹腔镜下低位前切除术治疗,结果显示,两组患者的淋巴结总清扫数目及第253组淋巴结清扫数目比较无明显差异。说明保留LCA可较好的清扫中央区淋巴结,可行性良好。
比较两组患者的手术相关指标,发现观察组的手术时间较对照组明显延长,而两组术中出血量比较差异无统计学意义。这是由于观察组术中既要保留LCA,又要行周围淋巴结清扫,故一定程度上延长手术时间。本研究中施术医生经验丰富,技术娴熟,故可有效控制术中出血量。姜慧员等[10]研究表明,技术娴熟的腹腔镜外科医师在直肠癌保留LCA术中不会增加术中出血量,与本研究结论相符。吻合口血供不足可引发术中残端缺血性改变,传统IMA高位结扎后的吻合口血供主要来源于结肠中动脉的边缘支,而保留LCA及其上升支可增加近端结肠残端血供,降低术中残端缺血性改变。早在2011年Komen等[11]采用激光多普勒血流仪系统证实,保留LCA的肠管残端血供显著优于不保留组。而本研究显示,观察组的术中残端缺血性改变数及预防性造口数虽少于对照组,但组间比较差异无统计学意义。这可能与研究样本量较小有关,有待后续进一步验证。
直肠癌前切除术后,部分患者会因肠蠕动减弱,导致排便困难,还有部分患者出现腹泻、里急后重等症状。本研究中于两组患者治疗前后采用血清MTL、GAS水平、Wexner便秘评分评估其胃肠动力及肛门功能,显示两组术后的血清MTL、GAS水平较术前明显降低,Wexner便秘评分较术前明显升高,但手术前后的上述指标差值比较差异无统计学意义。提示,腹腔镜下直肠癌前切除术保留或不保留LCA对患者胃肠及肛门功能的影响相当。另外,本研究还显示观察组住院时间、术后排气时间明显缩短。这可能与保留结肠血管可降低肠胃损伤,保护IMA根部神经丛的作用相关。
中低位直肠癌由于近端残管较长,血运压力较大,仅靠中结肠动脉边缘的血管弓,无法保证吻合口充足的血供,易引发吻合口漏、切口感染等术后并发症,尤其对于免疫力下降的老年患者,术后并发率更高。此前有研究显示,保留LCA可分担吻合口血运压力,促进肠道功能恢复,从而减少吻合口漏发生率[12],这与本研究结论不一,这可能受患者病情、样本量等因素影响,有待探究。关于两组术后肿瘤复发及转移情况,随访12个月时观察组局部复发1例,转移2例,对照组局部复发3例,转移3例,均为肝转移,两组间复发及转移发生率比较无显著差异。说明,保留LCA不会增加直肠癌术后复发及转移风险,但仍需长期精确随访以提高结论可靠性。
总之,腹腔镜下直肠癌低位前切除术保留LCA安全可行,与不保留LCA相较,既不影响术中淋巴结清扫,又不增加术中出血量及术后转移复发风险,还具有缩短术后排气时间及总体住院时间的优势。未来随着高清腹腔镜技术的发展,将更多直肠癌患者受益。但本研究存在不足:为单中心临床设计,未对两组患者的远期预后进行比较,部分结论存在偏倚。
