微小免疫磁珠法制备神经干细胞治疗脊髓损伤的动物实验研究
2023-03-13田振吴文涛陈锦鸿娄朝晖
田振,吴文涛,陈锦鸿,娄朝晖
(郑州大学第一附属医院 骨科,河南 郑州 450000)
脊髓损伤(spinal cord injury,SCI)患者可出现神经功能障碍,丧失独立性,出现呼吸衰竭甚至死亡。全球每年新增SCI患者约50万例[1-2]。以往认为中枢神经系统是难以再生的,只有康复治疗能在一定程度上缓解SCI症状。近年来,干细胞因其具有多能性、更新能力及富含营养因子等优势[3]受到人们的关注。不同类型的干细胞已被广泛应用于SCI的各项临床试验中[4-8]。神经干细胞(neural stem cell,NSC)作为SCI治疗的移植种子细胞,其分离培养及规模化扩增一直是组织工程面临的重要课题。在实验方面,NSC的纯度和活性对实验结果的影响很大。在临床治疗方面,只有获得纯度较高的NSC,才能对NSC的功能开展更加广泛的试验研究。但不论是直接由动物脐血、人骨髓等途径所诱导获得的NSC,还是直接由胚胎及成熟动物脑组织中分离的NSC,其纯度都较低[9-11]。免疫磁珠法通过磁珠与细胞表面的物质结合,使靶细胞或杂质细胞具有磁性,继而在磁场的作用下对细胞进行筛选,实现纯化富集的目的。这一技术如今已在细菌与分子生物学领域被广泛使用,其纯化和富集的作用也获得了免疫荧光、PCR、FISH和FACS等分析方法的证明[12]。本研究通过微小免疫磁珠分离纯化得到NSC,并将其移植到SCI的大鼠模型中,对纯化效果和实验结果进行探讨。
1 材料与方法
1.1 实验动物、主要试剂与仪器郑州大学第一附属医院实验动物中心提供10只孕龄为12~18 d的Wistar大鼠胎鼠,用于NSC的获得;提供30只10周龄的Wister大鼠,体质量280~300 g,用于SCI模型的构建。每只大鼠被置于温度和湿度控制的12 h光-暗循环环境中清洁级饲养。本研究中的外科手术和动物试验操作,均遵守医学院动物试验伦理委员会的规定。本研究使用了DMEM/F12、B-27、胎牛血清(ThermoFisher)、碱性成纤维生长因子、表皮生长因子(Peprotech)、小鼠抗大鼠nestin单克隆抗体、包被羊抗小鼠IgG的赛默飞微小免疫磁珠(直径≤50 nm)、FITC标记的羊抗鼠IgG、Anti-GFAP、Anti-βⅢ-tubulin、NSC培养基(ThermoFisher)、微量注射器(Smiths Medical)、流式检测仪(Thermofisher AttuneNxT)、倒置相差显微镜(DMIRE2型)和恒温CO2培养箱(Thermofisher Midi40)。
1.2 获取、培养原代NSC对10只Wister孕鼠实施吸入异氟烷麻醉后,将其固定在铺有冰袋的解剖平台上,从腹部正中切口取出胚胎,在立体显微镜下去除结缔组织和微细血管,使用碎块机将取出的脑组织碎成体积约为1 mm3的碎块,并迅速收集于离心管中,在0 ℃以下的冰袋上使用D-Hanks液清洗 3次,然后将100 μL 0.25%的trypsin-EDTA和DNAase加入离心管中,于常温下静置20 min,加入胎牛血清终止消化,使组织稳定,用玻璃吸管重复轻柔敲打20次后,得到单细胞悬浮液。
1.3 NSC的体外纯化将获取的细胞悬液在体外进一步纯化:将获取的原代细胞培养液从400目筛网滤过,将细胞浓度调整为1×106mL-1后,在室温下静置30 min,待细胞浓度稳定后进行细胞活力测定。
1.4 NSC的磁化将预处理过的小鼠抗大鼠nestin单克隆抗体的浓度调整为4 μg·mL-1,添加到获取的单细胞悬浮液中,使用玻璃吸管搅拌混合均匀,在24 ℃下孵化30 min,用PBS液冲洗悬浮液2次,以去除未结合的单克隆抗体和单细胞,羊抗小鼠抗体包被的IgG免疫磁珠经PBS冲洗2次得到纯化后的磁化磁珠。将纯化后磁珠的浓度调整为20 μg·mL-1,加入小鼠抗大鼠nestin结合的细胞悬浮液中,用玻璃吸管轻轻搅拌均匀后,置于24 ℃下遮光静置1 h使其充分结合。
1.5 磁化NSC的筛选与富集将磁化后的细胞悬液转移至试管中,将试管固定于电磁场中,静置30 min后将试管内的液体用玻璃吸管缓慢移出,此过程中尽量不触碰试管管壁,避免吸附在试管壁的细胞脱落。然后使用PBS溶液冲洗试管壁2遍,将贴附在试管管壁上的细胞冲洗掉,至此获得了纯化后的NSC悬液。将细胞悬液置于离心机中 ,以600 r·min-1的速度离心,将上清液去除后加入NSC培养基,然后在37 ℃、5% CO2条件下静置培养1 h。
1.6 Nestin阳性细胞分析将磁化和富集过的原代细胞置于50 mL的烧瓶中,通过细胞计数板计算细胞浓度,将细胞浓度调整为1×105mL-1,取200 μL细胞悬液,平均分为10份置入4 ℃的冰箱中静置10 min,取25 μL已被FITC标记成功的IgG(0.1 mg·mL-1)加入每份悬浮液中,继续静置20 min后,使用PBS溶液洗涤2次。再取5 mL 10 g·L-1的多聚甲醛加入20 mL的PBS中,混合均匀后加入细胞悬液中。选取同类型的无关抗体取代单一抗(nestin抗体)设为对照。使用流式细胞仪分析标本。
1.7 诱导NSC分化及其鉴定将传代培养的NSC解离成单细胞悬浮液,分为3份,接种于(细胞浓度为1×106L-1)共聚焦培养皿中,加入10 g·L-1的胎牛血清,在室温下培育5 d。使用PBS清洗1遍后进行MBP、GFAP和βⅢ-微管蛋白免疫荧光染色。将未经处理的单克隆抗体稀释200倍后按同样的染色方法进行培养、染色,在电子焦显微镜下观察对比。
1.8 细胞活性的鉴定纯化前后的所有细胞均用10 g·L-1的健那绿在30~40 ℃下染色,细胞质呈蓝绿色即为阳性,纯化前后分别计数100个细胞,对其活力进行判断。细胞活力为健那绿阳性细胞数占100个细胞的百分比。
1.9 实验分组及方法取30只健康的雌性大鼠随机分为实验组、空白对照组、培养液组。对大鼠实施吸入异氟醚进行麻醉诱导,麻醉后沿着背部的腰椎和胸椎表面剃毛,用碘伏清洁皮肤,在以T10为中心的棘突上进行中线切口,切口从尾端暴露到腰椎。将椎旁肌肉从脊柱抬高。使用微型器械将T10椎板切除,暴露底层脊髓。SCI操作:使用改良Allen SCI撞击器,以10 g重的冲击棒从25 mm的高度自由落体撞击暴露的脊髓。操作完成后立即缝合上覆肌肉,用创口夹封闭皮肤。在麻醉恢复期间,大鼠被放置在温度可控的房间里,直到体温调节重新建立。待麻醉苏醒后大鼠表现为双下肢瘫痪则证明SCI模型构建成功,术后人为辅助大鼠排便、排尿。干细胞移植的时机对于受损脊髓功能的成功恢复非常重要。在SCI慢性期,损伤部位会逐步形成胶质瘢痕,不利于神经元轴突的再生。Okano等[13]报道NSC移植的最佳时机为SCI后1~2周。所以在大鼠SCI后14 d,对实验组大鼠腰椎尾侧椎板切开处注射含有5×105个NSC的4 μL培养液至SCI水平;对培养液组通过腰椎尾侧椎板切开处注射4 μL培养液至SCI水平;对空白对照组通过腰椎尾侧椎板切开处注射4 μL生理盐水至SCI水平。注射装置为微型操作器配套微量注射泵,在5 min内将液体缓慢注入。注射完成后,用2-0丝线缝合手术切口。
1.10 大鼠行为学观察(1)运动能力。通过运动能力评定量表(Basso,Beattie,Bresnahan,BBB)[14-15]评估。术后10周连续观察各组大鼠后肢运动功能,每周1次。大鼠被放在1个长100 cm、宽50 cm、高20 cm的纸盒中活动4 min,尽量减少外界因素对大鼠产生的影响。BBS总分0~9分,0分表示后肢运动功能完全丧失,9分表示后肢运动功能完全恢复正常。2名对实验设计毫不知情观察者分别独立记录功能评分。如果评分存在差异,经过分析讨论后统一分数。(2)斜板实验:术后每周将大鼠置于斜板上测试1次以评估大鼠的运动功能,连续10周,记录大鼠在斜板上停留超过5 s的最大斜板倾斜角度,测试过程中要保证周围环境完全安静,避免大鼠受到外界刺激,影响实验结果。
1.11 组织学观察术后10周后,所有的运动分析已经完成,注射过量戊巴比妥钠处死大鼠。沿着原切口切开,切取损伤部位脊髓组织,测量脊髓组织的直径并记录。将脊髓组织置入配好的组织固定液中,使细胞保持原有的组织结构。使用乙醇做脱水处理,脱水成功后加入二甲苯,取代脊髓组织中的乙醇,然后进行浸蜡、包埋、切片(8 μm厚)。使用苏木精水溶液加酒精伊红染色后,在倒置相差显微镜下观察。

2 结果
2.1 NSC的分离培养观察Wister胎鼠大脑皮层组织细胞的体外生长情况,倒置相差显微镜下新接种细胞的细胞悬液折光性较强呈椭圆形;原代培养24 h后,大部分细胞在内镜下贴壁,少量细胞悬浮为单细胞,折光性降低。48 h后细胞开始出现死亡,剩余细胞大多数聚集成大小不同的细胞簇并开始分裂(图1A);5 d后细胞分裂趋于稳定,随着细胞的生长形成了大小不一的球状细胞丛(5~10个细胞),镜下观察其胞体比例较大,胞浆颜色较暗,胞质占比较小,形态规则,界限清晰,折光性较强,在光镜下符合NSC的特征。原代克隆传代后,细胞分裂生长能力较强,4~5 d后生长出体积大、数量多的二代克隆球(图1B)。在实验过程中发现原代细胞具备很强的分裂增殖能力,即使在连续分裂传代20代以上,仍然保持着分裂增殖和克隆的能力,符合NSC的特征。不过在传代次数达到30次以上后,细胞分裂增殖的速度下降,其原因有待研究。

A为经过体外培养48 h胎鼠大脑皮层细胞(×100);B为经过体外培养7 d的胎鼠大脑皮层细胞(×100);C为未进行磁珠分选的胎鼠大脑皮层细胞(×400);D为进行磁珠分选后的胎鼠大脑皮层细胞(×400)。
2.2 nestin阳性细胞表达结果分析将纯化后得到的细胞悬浮液经流式细胞仪测定,小鼠抗大鼠nestin表达阳性的细胞占所有样本细胞的(90.5±2.5)%(图2)。细胞活性测定出细胞活力为(96.3±1.8)%。上述分析的结果显示微小免疫磁珠纯化的NSC活性并未受到影响且纯度较高,符合该实验的基本要求。

2.3 NSC的诱导分化与鉴定免疫荧光检测结果显示GFAP反应阳性细胞占所有细胞的75%左右。电镜下细胞质大而淡绿色,细胞壁有较多的突起,对比星型胶质细胞形态特点(图3A)可知大部分NSC细胞具备分化为星型胶质细胞的能力;MBP反应阳性细胞仅占所有细胞的20%左右,其在电镜下呈绿色,由此可知少数 NSC细胞分化为少突胶质细胞(图3B);电镜下仅有3%的细胞呈红色,这类细胞突起较少但较长,表明βtubulinⅢ 反应阳性细胞占所有细胞的3%左右,可以认为少量NSC已分化为神经元(图3C、3D)。该分化和鉴定结果进一步证明了通过微小免疫磁珠法分离培养获取的细胞是NSC,其具有一般NSC增殖和多向分化的能力。
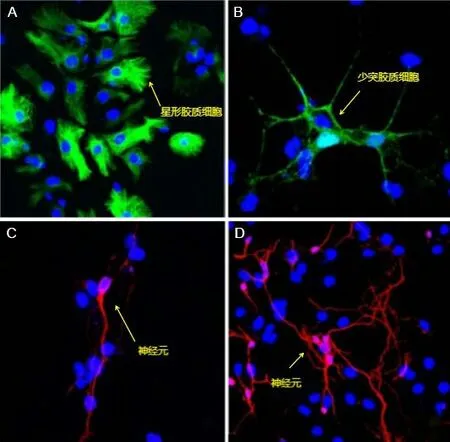
图3 免疫荧光镜下观察NSC的分化能力
2.4 组织学观察术后10周取材,肉眼可见对照组损伤节段脊髓及其周围组织破坏程度高于实验组,空白对照组和培养液组肉眼下观察无明显区别。HE染色后于镜下观察:干细胞移植的实验组镜下可见有大量梭形细胞生长(见图4B)、脊髓直径大于对照组(见图4A);对照组(图4C、4D)可见大量脊髓组织坏死,镜下可见单核细胞浸润,组织形态结构紊乱,组织坏死程度大于实验组。
2.5 动物实验观察大鼠行为学检测结果如下。(1)SCI模型构建14 d后3组大鼠的BBB评分符合SCI。实验组28~70 d的BBB评分高于空白对照组、培养液组(P<0.05)。空白对照组和培养液组BBB评分全程组间比较,差异无统计学意义(P>0.05)(见图5)。(2)实验组大鼠28~70 d在斜板上停留5 s的平均最大角度均大于空白对照组和培养液组(P<0.05)。空白对照组和培养液组大鼠 28~70 d在斜板上停留5 s的平均最大角度比较,差异无统计学意义(P>0.05)。见表1。

A、B为实验组HE染色(光镜,×400);C、D为对照组HE染色(光镜,×400)。

表1 斜板实验数据

图5 SCI后干细胞移植后的运动功能分析
3 讨论
尽管对神经退行性病变和神经保护机制已经进行了几十年的基础和临床研究,但目前SCI的预后仍然较差[15]。SCI的机制复杂,有研究表明组织炎症和细胞凋亡是脊髓继发性损伤的主要过程[16]。即使在原发创伤性损伤中存活下来的神经元也可能在随后的继发性损伤中死亡。这种二次损伤往往是导致不可逆损伤和功能丧失的主要原因。科学研究已经证实,使用干细胞用作种子细胞治疗SCI时,可以通过抑制局部炎症反应、促进分泌生长因子、改善局部微环境等途径促进受损神经再生[17]。而大多数神经系统病变均与NSC数量及功能失调直接相关[18]。运用NSC移植治疗SCI时,为了促进功能恢复,必须抑制炎症反应、神经元凋亡和坏死,改善受损组织的微环境,以增强神经元的再生,促进轴突再生和重建[19]。为了阐明干细胞移植在治疗SCI中的作用模式,研究者做出了大量的努力,并发表了多篇文献[20-21]。移植细胞在SCI的不同阶段发挥多种神经和血管保护作用已经得到证实。这些细胞不仅能重组神经网络,还能减少局部和全身炎症,支持轴突再生和突触发芽,减少胶质瘢痕。其机制可细分为3种不同的机制:细胞替代、功能多能性和干细胞再生。细胞替代可通过将移植细胞分化为神经元或血管细胞,以促进组织和功能恢复[22]。功能多能性描述了移植细胞分泌各种营养因子,这些因子有助于改善神经损伤和促进神经回路的再生[23]。干细胞再生发生在脊髓中,移植细胞可激活宿主NSC的再生[24]。目前在SCI治疗领域,干细胞移植治疗可用于实现2个主要目标。(1)再生:寻求替代丢失或受损的神经元,并诱导轴突再生或可塑性。(2)修复:替代支持细胞,如少突胶质细胞,以诱导髓鞘形成和防止进行性髓鞘丢失,使内源性细胞免受进一步继发性损伤[25]。近年来种种研究也表明,使用干细胞治疗可以改善急性SCI[26-28]。Schira等[29]将不受限制的干细胞移植到胸水平的背侧半切损伤附近,结果病变减轻,组织保留、轴突再生增强,运动功能改善。Shinozaki等[30]解释了干细胞治疗SCI的策略,一些动物研究和临床研究证明了干细胞可以促进细胞再生和功能恢复[31]。这让人们有理由认为干细胞移植在SCI治疗领域存在广泛前景。而进行干细胞移植治疗的前提是获得高度均一的NSC,这一直以来是细胞生物学研究的热点和难点。
本研究采用间接阳性法纯化NSC,利用抗原抗体特异性结合的生物原理和磁珠在磁场中受电磁力影响的物理原理,在不影响NSC活力与功能的前提下提高了NSC的提纯率。与传统免疫磁珠法制备NSC的方法不同,本实验所使用的磁珠为微小磁珠(一般直径≤30 nm),其最为重要的特点是体积为普通磁珠的千分之一,对NSC功能的影响可以忽略不计,可直接用于实验研究或临床治疗[32],提高效率的同时降低了出现NSC污染的概率,解决了NSC移植治疗SCI种子细胞获取的问题。
本实验充分利用微小免疫磁珠法制备的NSC的优点,将NSC直接移植到SCI的大鼠模型中,实验组功能改善优于对照组,这为NSC移植治疗SCI提供了实验依据,也为移植治疗SCI提供种子细胞获取的方法。从组织学的角度分析,实验组与对照组相比具有较多的梭形细胞,损伤恢复倾向较为明显,组织结构也较为稳定,进一步证实了NSC移植用于治疗SCI的可行性。然而,将干细胞成功移植到靶组织并发挥作用仍然具有很多挑战。例如,细胞去分化、免疫排斥和肿瘤形成等尚未解决的问题,进一步限制了干细胞移植治疗SCI的临床应用[33-34],这需要进一步深度研究。本实验为运用微小免疫磁珠法制备的NSC用于实验研究或移植治疗提供了实验依据,为后续SCI治疗打下了基础。
