肠道菌群在痛风病变过程中的作用机制及治疗研究进展
2023-03-13章晓云李华南李时斌王伟伟陈锋甘斌刘永钱
章晓云,李华南,李时斌,王伟伟,陈锋,甘斌,刘永钱
1江西中医药大学临床医学院,江西 南昌 330004;2广西中医药大学附属瑞康医院骨科,广西 南宁 530011
痛风是一种由于嘌呤代谢紊乱、尿酸排泄减少或产生过多导致体内血尿酸水平升高,尿酸结晶在关节及其他结缔组织中沉积所引起的炎性疾病[1],以关节红肿、疼痛为典型临床表现,多在夜间突然发作,并随着疾病的进展呈逐渐加重的趋势,不仅会造成关节畸形,且可累及肾脏、引发心脑血管疾病等,严重影响患者的生活质量[2]。痛风的发生发展与体内血尿酸水平直接相关,而尿酸是嘌呤化合物的最终代谢产物[3],因此,调节嘌呤代谢对于痛风的发病及治疗至关重要。研究发现,体内嘌呤包括外源性和内源性两种,前者由体内合成,后者则主要来源于摄取的食物,具有可控性,因此合理调整饮食结构以减少外源性嘌呤的摄入是目前临床上控制痛风急性发作的有效手段[4]。肠道作为消化与吸收食物的重要器官,主要功能为肠道菌群将食物分解成单糖后再由小肠上皮细胞吸收入血。若肠道微环境发生紊乱,肠道菌群将直接迁移至肠外组织,产生小分子并进入血液循环,最终通过肠道Toll样受体导致风湿免疫性疾病的发生[5-6]。因此,肠道菌群通过参与嘌呤代谢酶的合成以及炎性因子的释放,在痛风的发生发展中发挥了重要作用。有研究证实,与健康人相比,痛风患者体内肠道菌群的丰度明显降低[7]。本文从肠道微生态的组成及功能,痛风患者肠道菌群的结构特点,肠道菌群在痛风发病中的作用机制,以及益生菌、中药和粪便微生物移植治疗等方面展开综述,以期为痛风的微生态研究提供新思路。
1 肠道微生态的组成及功能
肠道菌群是一类定植于人体肠道中重要且复杂的微生态系统[8],由原核微生物、真核微生物及病毒等构成[9],被称为“代谢器官”。目前发现,健康人体内约有10万亿个肠道细菌,是宿主细胞总数的10倍[10],根据作用机制的不同可分为三种[11]:(1)生理性菌群,如双歧杆菌与乳酸杆菌等。该菌群是一种优势菌群,通常与宿主构成互利共生的关系,可对机体产生有益的影响。(2)机会致病菌,如肠球菌、肠杆菌等。该菌群常驻于体内,在正常情况下无害,但在肠道微生态失衡时可致病。(3)过路菌,如假单胞菌、金黄色葡萄球菌等。该菌群短暂停留于体内,在肠道微生态发生紊乱时可大量繁殖从而引发疾病。生理性菌群及其代谢产物不仅参与维生素K、叶酸、生物素等的合成,还能促进钙、铁等营养物质的吸收,可显著增强宿主的免疫及代谢能力,在消化与吸收食物方面起着重要的作用[12]。若在饮食、环境以及药物等因素的作用下,肠道稳态失衡,机会致病菌及过路菌则通过改变肠道通透性、影响能量的吸收、分泌短链脂肪酸干预脑-肠轴等途径对机体健康产生负面的影响。Jackson等[13]对人类38种常见疾病以及51种药物与肠道菌群的关系进行宏基因组关联分析,发现包括骨关节炎、炎症性肠病、胆石症等在内的17种疾病与肠道菌群密切相关。Gilbert等[14]应用宏基因组关联分析肠道菌群及其代谢产物与人类常见疾病的关系,发现肥胖、类风湿关节炎、炎症性肠病等与多种肠道菌群存在密切关系。
2 痛风患者肠道菌群的结构特点
肠道宏基因组作为调控人体健康的重要基因组,对机体的免疫与代谢功能具有重要影响,尤其是与代谢性疾病关系密切。目前多项研究发现,痛风患者体内的肠道菌群与健康人群差异显著。任科雨等[15]研究发现,高尿酸血症患者体内存在肠道菌群失衡的情况,主要表现为生理性菌群数量减少,而肠杆菌、总需厌氧菌等数量明显增多,表明血尿酸升高可能与双歧杆菌、乳酸杆菌等益生菌减少有关。Guo等[16]研究发现,痛风患者体内粪拟杆菌和解木聚糖拟杆菌数量明显增多,而双歧杆菌及柔嫩梭菌群较为缺乏。Shao等[17]研究发现,大多数痛风患者体内肠道菌群的多样性呈下降趋势,以厌氧菌及拟杆菌等机会致病菌变化为主。此外,Xing等[18]使用变性梯度凝胶电泳(denaturing gradient gelelectrophoresis,DGGE)分别获得健康人群及原发性痛风患者的分子指纹图谱,对其相似性及多样性进行比较,发现痛风患者的梭状芽孢杆菌数量较健康人群明显减少。也有学者使用1H-NMR及Illumina Miseq技术对痛风患者和健康人群粪便提取物的代谢谱及微生物群落进行研究,发现痛风患者体内厌氧菌科、类杆菌及卟啉单胞菌科等机会致病菌明显增多[19]。总之,痛风患者肠道菌群失调主要表现为抗炎性因子产生菌、益生菌减少,以及机会致病菌增多两个方面,这些变化可引起机体嘌呤代谢失调,从而促使血尿酸升高并释放大量炎性因子,最终诱发痛风的发生。
3 肠道菌群在痛风发病中的作用机制
3.1 肠道菌群影响尿酸、嘌呤的生成及排泄 嘌呤在人体内主要以嘌呤核苷酸的形式存在,可在水解作用下形成腺嘌呤和鸟嘌呤,并经过脱氨生成黄嘌呤,最后经过氧化形成尿酸,而尿酸水平升高被认为是痛风发作的最直接原因。随着人们对肠道菌群与痛风认识的不断加深,越来越多的研究证实肠道菌群可通过促进尿酸分解及排泄来影响痛风的发作。
健康人体内约有2/3的尿酸经过肾脏代谢后随尿液一起排出,剩余1/3则经过肠道排出。在这个过程中,由肠道菌群分泌的乳腺耐药蛋白(ATPbinding cassette subfamily G member 2,ABCG2)、溶质载体家族16成员9(solute carrier family 16 member 9,SLC16A9)及溶质载体家族17成员4(solute carrier family 17 member 4,SLC17A4)等尿酸转运蛋白将尿酸从血液中运输至肠腔,经肠腔直接排出体外或由乳杆菌属和假单胞菌属等分解[20]。某些由肠道菌群分泌产生的活性酶在尿酸的分解及代谢中也发挥着重要作用。例如,乳酸杆菌及假单胞菌属通过产生短链脂肪酸而促进肠内尿酸的分解及排泄[21],大肠埃希菌通过分泌黄嘌呤脱氢酶参与嘌呤氧化代谢来加快尿酸的生成等[22]。因此,肠道菌群发生紊乱时可对嘌呤及尿酸的代谢造成影响,引起尿酸生成过多或排泄减少,最终导致痛风发作。Yu等[23]的研究发现,高尿酸血症大鼠的肠道菌群结构发生了改变,主要表现为具有吸收、分解嘌呤及尿酸作用的乳杆菌、链球菌等菌属明显减少,而可将嘌呤转变为尿酸的变形杆菌明显增多。另有研究发现,短链脂肪酸可通过调节肠道慢性炎症而加快肠道上皮细胞的修复及再生,促使肠道菌群分解代谢出更多的尿酸转运蛋白,以加快尿酸的排泄;而当ABCG2、SLC16A9及SLC17A4等尿酸转运蛋白发生突变时,可直接导致尿酸排泄障碍[24-25]。Ichida等[26]也发现,ABCG2在回肠中呈高表达的趋势,当富含嘌呤及核苷酸的食物转运至肠道时,大肠埃希菌通过分解代谢出黄嘌呤脱氢酶将食物进一步转化成尿酸,此时若阻断尿酸进入肠道将引起血尿酸浓度升高,表明微生物群的改变对尿酸的调控至关重要,具体机制如图1所示。
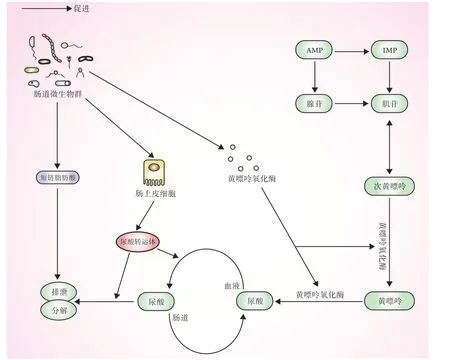
图1 肠道菌群影响尿酸、嘌呤的生成及排泄Fig.1 Intestinal flora affects the production and excretion of uric acid and purine
3.2 高嘌呤、果糖饮食破坏肠道菌群稳态 80%的尿酸由内源性嘌呤降解而成,剩余20%则由食物等外源性嘌呤产生。相关研究发现,高嘌呤饮食如海鲜、动物内脏等可导致外周血中脂多糖及黄嘌呤氧化酶的表达水平增高,从而诱发高尿酸血症、痛风等[27]。果糖作为各种蔬果中的天然糖分,通常被用作食品及饮料的含糖添加剂。不同于葡萄糖的分解代谢,果糖不受负反馈调节控制。过多摄入果糖后细胞内磷酸盐及三磷酸腺苷的表达明显受到抑制,此时磷酸腺苷脱氨酶的活性增强,进一步催化磷酸腺苷转化为黄嘌呤,并最终生成尿酸,目前这被认为是引发代谢性综合征的主要原因之一[28-29]。因此,饮食是胃肠道微生物群改变的重要原因,高嘌呤或高果糖饮食已被众多研究证实可促使肠道菌群结构发生改变,从而造成体内尿酸水平升高。黄胜男等[30]研究发现,高嘌呤饮食可引起双歧杆菌及乳杆菌数量减少,使肠道菌群结构发生改变,造成外周血中内毒素及黄嘌呤氧化酶水平升高,从而导致高尿酸血症及痛风的发生。高果糖饮食可打破肠道菌群的稳态,导致机体代谢异常。有研究发现,经高果糖饮食喂养后,大鼠体内主要有三种菌群出现紊乱:梭杆菌属增多,拟杆菌属、乳杆菌属明显减少;而经双歧杆菌饲养后,大鼠血浆中脂多糖、肿瘤坏死因子(tumor necrosis factor,TNF)-α表达下调,上述菌属紊乱情况得到改善[31]。Kaneko等[32]指出,大量食用果糖可激活NADPH氧化酶,进一步阻止尿酸经回肠排出,从而造成体内血尿酸水平增高。此外,果糖的高消耗在加快嘌呤降解的同时,还可促使肠道营养不良及脂多糖相关炎症的发生[33-34]。总之,饮食是胃肠道微生物群的重要影响因素,针对高果糖、高嘌呤饮食诱发肠道微生态失衡的机制以调节肠道菌群,可能是防治高尿酸血症及痛风的有效手段(图2)。
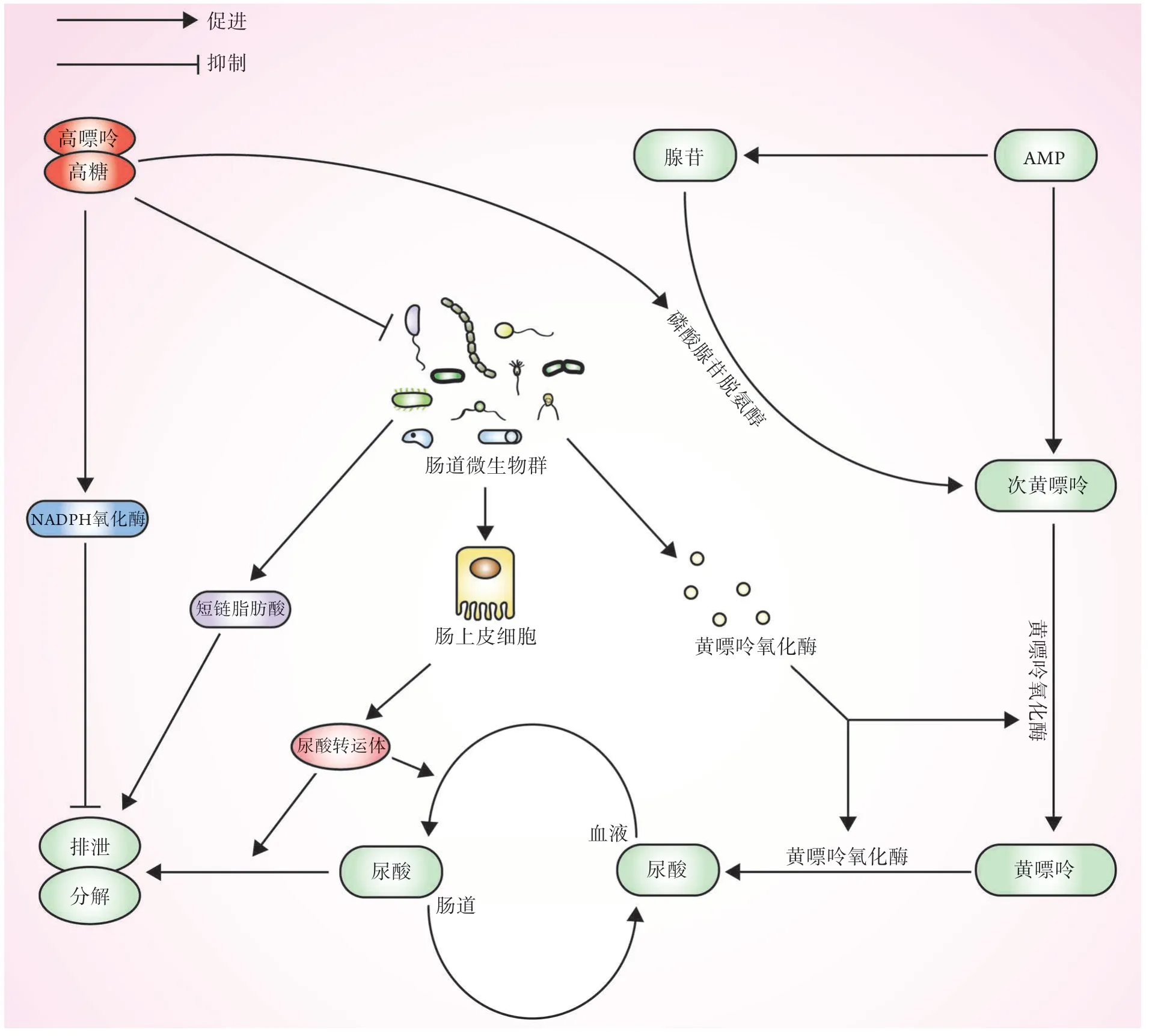
图2 高嘌呤、果糖饮食与肠道菌群的关系Fig.2 Relationship of high purine and fructose diet to the intestinal flora
3.3 肠道菌群紊乱诱发机体免疫炎症反应 痛风急性发作是一种早期诱导的免疫应答反应,多伴有细胞因子刺激的中性粒细胞数量增多,与高尿酸血症直接相关。目前研究发现,由尿酸生成的尿酸钠结晶是诱发、支持及加重炎症反应的关键介质,其能诱使白细胞趋化以及炎性物质的大量释放,最终引起痛风的急性发作。在调控人体对尿酸单钠结晶引起的炎症反应过程中,肠道菌群紊乱导致的短链脂肪酸及脂多糖含量改变发挥着重要作用,近年来受到了广泛关注。
短链脂肪酸主要包括醋酸盐、丙酸盐及丁酸盐等,可调节体液代谢、增强肠道屏障功能以及抑制肠道炎症反应,在维持机体健康中发挥着重要作用[35]。Cleophas等[36]证实,丁酸盐能够通过抑制组蛋白脱乙酰基酶的表达而发挥减少白细胞介素(interleukin,IL)-1β合成及释放的作用,可有效减轻炎症反应。另有研究发现,丁酸盐可调控G蛋白偶联受体、核转录因子κB(nuclear factor kappa-B,NF-κB)、酪氨酸激酶/信号转导及转录激活因子(Janus kinase/signal transducers and activators of transcription,JAK/STAT)等炎症信号通路的活性,从而抑制促炎细胞因子的释放,而当肠道菌群紊乱造成丁酸盐减少时,可显著加快炎症反应的发生[37]。张和平[38]的研究发现,痛风患者体内丁酸盐的合成明显减少,而服用益生菌改善肠道菌群不仅能促进尿酸的排泄,还能够提升肠道黏膜抵抗感染的能力,有效促进丁酸盐的生成,抑制组蛋白脱乙酰基酶的活性,从而减少痛风的急性发作。
脂多糖由脂质和多糖构成,是肠道菌群中革兰阴性菌细胞壁的组成成分。肠道微环境紊乱可明显抑制革兰阴性菌的活性,此时脂多糖分泌增多可促使机体产生大量的细胞因子,并增加肠壁的通透性,诱发低度慢性炎症,即“代谢性内毒素血症”。目前研究发现,脂多糖与代谢性综合征、肥胖等多种疾病密切相关。Xu等[39]研究发现,在变形菌门的作用下,痛风大鼠肠道营养条件变差,且肠上皮及肾脏内皮的通透性显著增加,这可促使脂多糖进入血液循环,显著加剧痛风的发作。另有研究发现,与正常小鼠相比,高尿酸血症小鼠体内双歧杆菌、乳杆菌等明显减少,而血清黄嘌呤氧化酶活性及脂多糖水平升高,在使用益生菌治疗后,肠道内有益菌增多,血清脂多糖、黄嘌呤氧化酶等的表达水平明显下降[40](图3)。
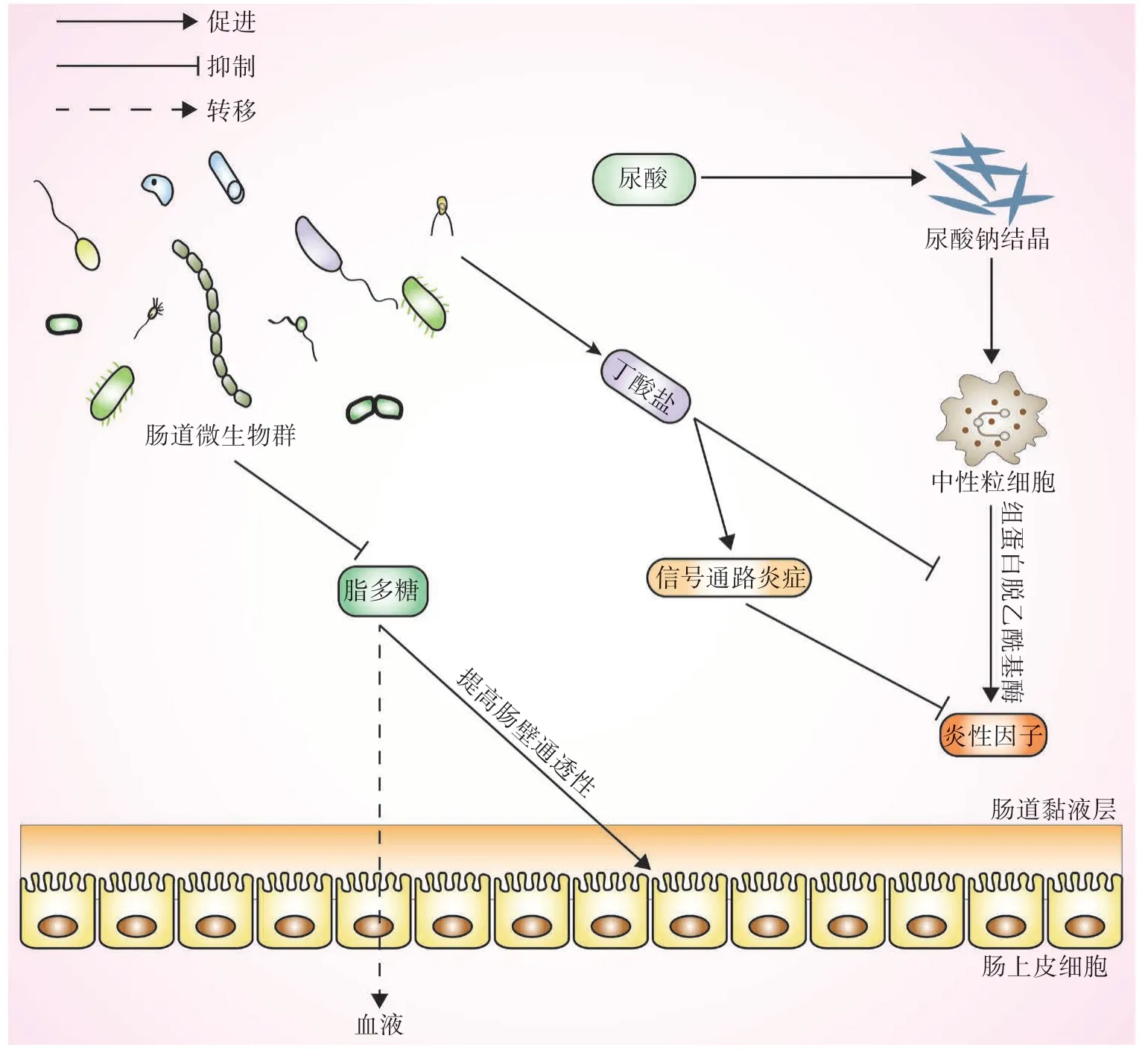
图3 肠道菌群与机体免疫炎症反应的关系Fig.3 Relationship between intestinal flora and immune inflammatory response of the body
3.4 肠道菌群改变影响肠道屏障功能的稳定 肠道微生物是维持肠道稳态的重要介质,目前发现某些特定菌株可间接影响肠道的屏障功能。肠道屏障功能障碍已被证实能加快类风湿关节炎、痛风性关节炎等疾病的进展,这可能与其引起肠道通透性增加并加重高尿酸血症有关[41]。早期研究发现,益生菌通过竞争营养物质和黏附部位、分泌抗菌肽保护肠道上皮表面,以防御病原体并限制其与肠道黏膜的直接接触,从而有效防止病原体的侵袭[42]。肠道菌群结构改变不仅能引起短链脂肪酸浓度降低,也会导致维持肠道屏障完整性的能力减弱,进一步影响肠道上皮对体内细菌毒素及病原体的抵御能力,甚至造成细菌或细菌产物如脂多糖的易位,而这势必造成高尿酸血症或痛风患者血液内毒素水平的升高。多项研究发现,脂多糖不仅能够触发先天免疫,还能激活炎性细胞,加快全身性慢性炎症以及代谢紊乱的发展。例如,外源性脂多糖可诱导全身炎症引起脂肪性肝炎,或者经过内毒素脂多糖-Toll样受体4(lipopolysaccharides-Toll-like receptor 4,LPS-TLR4)/NF-κB、胰岛素样生长因子1(insulinlike growth factor 1,IGF-1)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/前列腺素E2(prostaglandin E2,PGE2)信号通路引发软骨性关节炎[43-44]。
肠道菌群可通过干扰肠道屏障功能调节脂质代谢,从而影响疾病的发展。有研究发现,富含嘌呤的食物中脂肪酸含量较多,而脂肪酸能够提升尿酸盐晶体的促炎特性,被认为是饱食后痛风急性发作的诱导剂[45]。另外,Antharam等[46]研究发现,肠道菌群可直接影响胆固醇代谢,如双歧杆菌、乳酸菌和胃链球菌参与了胆固醇转换过程。总之,肠道菌群失稳会影响肠道屏障功能(如肠道上皮完整性)及免疫机制,从而引发代谢组织炎症,加剧代谢紊乱,这为高尿酸血症及痛风的发病机制提供了新的研究方向。然而,这一领域的研究仍存在不足,今后需重点关注微生物与机体相互作用的具体途径,确定这种机制的分子基础,有助于靶向肠道菌群调节高尿酸血症,降低痛风发作率(图4)。
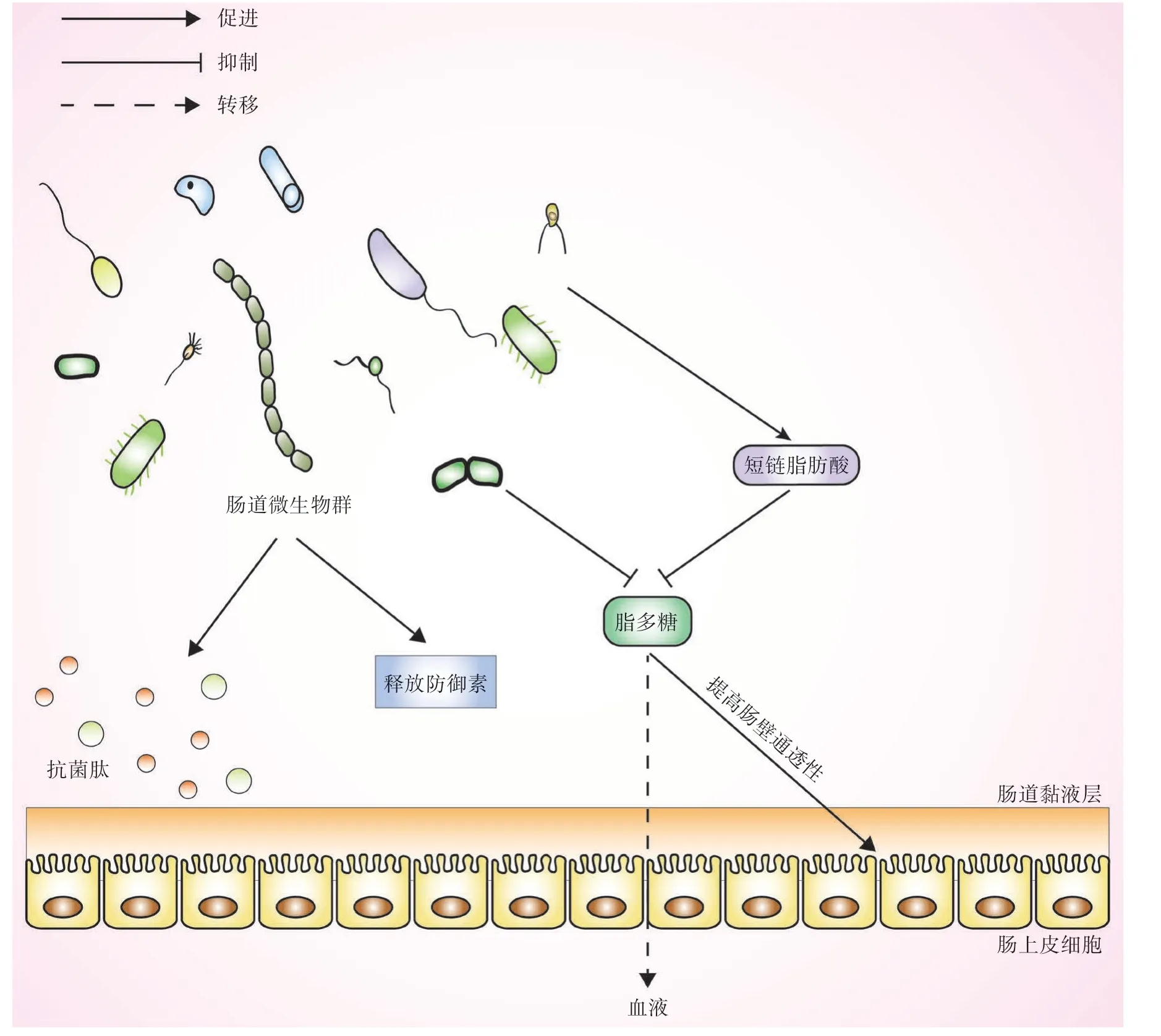
图4 肠道菌群与肠道屏障功能的关系Fig.4 Relationship between intestinal flora and the intestinal barrier function
4 肠道菌群治疗痛风性关节炎的潜在价值
现今痛风的发病率越来越高,亟需有效的干预手段,目前临床主要采用药物治疗、物理治疗、手术治疗等。非甾体抗炎药、类固醇药物等虽可缓解痛风发作,但不能阻止疾病进展,且长期口服药物存在发生消化道不适、过敏性皮疹等不良反应的风险[47-48]。随着肠道菌群与痛风相关性研究的广泛开展,痛风的发病机制正逐渐被揭示。越来越多的研究显示,益生菌、中药及粪便微生物移植等能够维持肠道菌群的稳态,促进尿酸的分解代谢[49-56],这可能为痛风急性发作的治疗带来了新的希望,尤其是对于尿酸控制较差的患者(图5)。
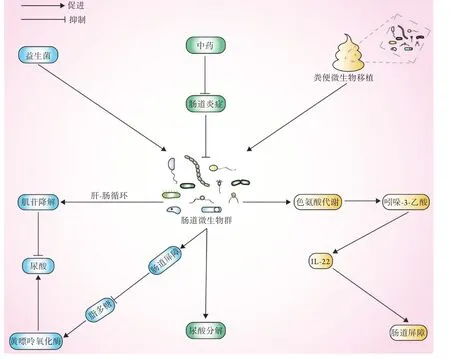
图5 调节肠道菌群治疗痛风的潜在可能机制Fig.5 Potential mechanisms of regulating intestinal flora in treatment of gout
4.1 益生菌治疗 目前有研究发现,益生菌可通过调节肠道菌群降低黄嘌呤氧化酶的活性,显著改善肠道屏障的生理功能,直接或间接调节肠道免疫应答,从而有助于降低人体内血尿酸的水平,有效防治痛风发作。Yamanaka等[49]发现,健康人、高尿酸血症患者及痛风患者在服用含有乳酸杆菌PA-3的酸奶后,体内尿酸水平均得到显著改善。邓英等[50]指出,短乳杆菌不仅可维持高尿酸血症小鼠肠道屏障正常的生理功能,有效降低脂多糖浓度,抑制黄嘌呤氧化酶的表达及活性,还可通过“肝-肠循环”加快肌苷的降解,最终降低血尿酸水平。值得注意的是,有研究发现,某些益生菌在降低高尿酸血症动物体内血尿酸水平的同时,对血压及肾脏也产生了有益的影响[51]。但也有研究提出了不同的观点,如Haghighat等[52]对75例接受血液透析的患者分别使用合成制剂、益生菌、安慰剂等进行干预,发现合成制剂组与益生菌组在细胞角蛋白18(cytokeratin 18,CK-18)、血尿酸及磷酸盐水平方面无明显差异。不同研究之间存在差异的原因可能与益生菌种类繁多、作用机制以及肠道定植能力不同有关,因此尚需要严谨可靠的数据进一步证实益生菌的作用。
4.2 中医药治疗 人体是一个复杂的网络系统,而疾病的发生常涉及这个网络系统的多个环节。目前的西药如别嘌醇抑制嘌呤生成、苯溴马隆加快尿酸排泄等,通常是针对痛风发病机制中的某个具体环节进行干预,难以有效治疗痛风。而中药单体或中药复方往往具有多途径、多靶点的特性,可通过各活性成分靶向多个环节,从而发挥协同治疗的功效。如前所述,肠道菌群在高尿酸血症及痛风发作中扮演着不同的角色,可能是治疗该疾病的靶点。因此,加强中医药调节肠道菌群的研究有助于充分发挥中医治疗痛风的优势。目前发现,某些中成药能通过缓解肠道炎症促进肠道菌群结构发生改变,从而增加尿酸分解,达到降低尿酸水平的目的。例如,菊苣水提取物是一种优质的益生元,能显著增加肠道益生菌的数量,并抑制致病菌的活性,已被众多研究证实能维持肠道屏障功能、调节肠道菌群稳态以加快体内血尿酸排泄[53]。孟博文[54]研究发现,健脾泄浊法可增强痛风患者体内乳酸杆菌、双歧杆菌的活性,下调拟杆菌水平,有效降低体内尿酸浓度。
4.3 粪便微生物移植 粪便微生物移植是一种将健康宿主的肠道微生物群经由消化道移植至患者体内以恢复其肠道微生物多样性的治疗手段,可通过个性化和精准配型粪菌移植技术有效重构肠道内竞争型菌群,是目前临床上的研究热点。粪便微生物移植能激活多种免疫途径,从而缓解肠道炎症,维持肠道菌群稳态,通过先天性和适应性免疫细胞调控IL-10的生成而发挥治疗疾病的作用,目前已被广泛应用于肠道疾病、肝硬化及肥胖等疾病的治疗中[55]。基于血尿酸浓度与肠道微生态的平衡紧密相关,使用粪便微生物移植维持高尿酸血症及痛风患者体内的肠道微生态可能是一种新的治疗手段。Geng等[56]研究发现,仔猪在接受粪便微生物移植后,不仅肠道微生物群落的α多样性及结构发生了变化,而且肠道微生物群的色氨酸代谢功能也得到明显提升,而色氨酸的代谢产物(吲哚-3-乙酸)能促进胃肠道内IL-22的产生,从而增强肠道屏障的生理功能。尽管目前粪便微生物移植对人类健康带来有益影响的证据尚不充分,但其为高尿酸血症及痛风患者提供了新的治疗选择,值得进一步深入探讨。
5 总结与展望
综上所述,肠道菌群数量庞大,各种属谱系及代谢产物均能对机体产生重要且复杂的影响。目前关于肠道菌群结构变化在痛风发病中作用机制的研究较为零散,未能更深入地从病理生理特点、分子生物学及互作机制等方面进行分析。本文对肠道菌群与痛风之间的关系进行了系统阐述:一方面,肠道菌群通过调控机体尿酸的分解代谢、干预尿酸转运蛋白在肠内的分布而影响尿酸在肠道的重吸收及排泄,从而影响机体的尿酸水平;另一方面,机体尿酸水平升高可诱使肠道发生慢性炎症,从而使肠道内环境发生改变,对菌群的种类及分布造成影响,进而破坏肠道屏障功能,最终促使体内血尿酸水平升高。基于此,益生菌治疗、中医药治疗及粪便微生物移植等在临床上迅速兴起,通过各自的靶点对肠道菌群进行干预以发挥促进尿酸分解代谢的作用。虽然目前已对肠道菌群与痛风之间的关系开展了大量研究,但具体机制仍未阐明,肠道菌群在痛风患者免疫调节、疾病演变等方面发挥着何种作用,如何恢复遭受破坏的微生态环境等仍需要更深层次的探索和研究。因此,今后仍需要更多的研究进一步明确宿主与微生物之间相互作用的机制,从而准确把握疾病,以利于更加科学、有效地指导靶向用药治疗。
