miRNA-34a通过调控SOX4/RAS/MAPK信号通路对中枢神经系统淋巴瘤进展的影响
2023-03-11潘晓冉李小娟
周 坚, 潘晓冉, 李小娟
(湖南省脑科医院/湖南省第二人民医院神经内科, 湖南 长沙 410000)
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)是一种罕见的非霍奇金淋巴瘤,仅影响包括大脑、脊髓、软脑膜和眼睛在内的中枢神经系统,占所有原发性颅内肿瘤的3-4%[1]。弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是PCNSL最常见的类型之一。与其他恶性中枢神经系统肿瘤相比,PCNSL对放疗和化疗更为敏感。但由于药物难以穿过血脑屏障,所以目前尚无最佳的治疗方法。此外,神经毒性、诊断和治疗延误导致复发,大多数PCNSL患者的预后仍然很差[2]。因此,寻找可靠的PCNSL诊断和治疗标志物已成为当务之急。微小核糖核酸(microRNAs,miRNAs)是一种长度为21-23个核苷酸的非编码RNA,通过与靶信使RNA特异结合,从而抑制转录后基因表达或者介导mRNA的降解。miRNAs参与多种生理和病理过程,例如细胞分化、增殖、细胞周期、炎症和代谢[3]。此外,在包括PCNSL在内的许多癌症中都观察到了一些miRNAs表达失调[4]。研究报道miRNA-34a与神经系统肿瘤有关。例如,过表达miR-34a抑制儿童神经母细胞瘤细胞的增殖、迁移和侵袭能力[5]。然而,miR-34a在PCNSL中的作用目前尚不清楚。性别决定区Y框蛋白4(sex-determining region Y-box 4,SOX4)是SOX转录因子家族的成员,参与多种生理过程。近来,SOX4由于与多种恶性肿瘤相关而受到了越来越多的关注。此外,研究还证实了SOX4过表达是癌症患者的恶性预后因素,SOX4具有致癌基因的功能[6]。但SOX4在PCNSL中的具体功能尚未报道。因此,本研究将探讨miR-34a与SOX4的关系以及在PCNSL中的作用,以期为PCNSL的治疗和诊断提供新的靶点和生物标志物。
1 材料与方法
1.1材料:人Burkitt's淋巴瘤细胞Raji购自中国科学院细胞库;Trizol试剂购自Invitrogen公司;逆转录试剂盒和SYBR Premix Ex TaqTMⅡ试剂盒均购自日本Takara公司;miRNA逆转录试剂盒购自美国Thermo Fisher Scientific公司;CCK-8试剂盒购自上海沪震实业有限公司;Annexin V-FITC/PI凋亡试剂盒购自北京索莱宝科技有限公司;双荧光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司;miR-34a模拟物(miR-34a mimic)、模拟物对照(NC mimic)、miR-34a抑制剂(miR-34a inhibitor)、抑制剂对照(NC inhibitor)、SOX4过表达质粒(pcDNA-SOX4)、空白质粒(Vector)均购自上海吉玛制药技术有限公司;SOX4、Raf-1、p-Raf-1、MEK、p-MEK蛋白抗体均购自美国Abcam公司。FACSCalibur流式细胞仪购自美国BD公司;光学显微镜购自日本Olympus公司;酶标仪购自美国Thermo Fisher Scientific公司。
1.2方 法
1.2.1收集患者组织样本:收集从2018年3月至2021年2月入住我院的80例PCNSL样本(PCNSL组)和40例颈部淋巴结组织(Control组),所有纳入的PCNSL患者均通过经病理活检确诊。通过手术切除或活检获得样本,并立即在液氮中冷冻。所有患者均签署了知情同意书。本研究经我院伦理委员会批准。
1.2.2细胞培养与转染:将Raji细胞在含10%胎牛血清、100U/mL青霉素和100μg/mL链霉素的RPMI 1640培养基中置于5% CO2、37℃环境下的培养箱中孵育。将Raji细胞接种至96孔板中。24h后,按照厂家说明书,使用Lipofectamine 2000转染试剂分别将miR-34a mimic、NC mimic、miR-34a inhibitor、NC inhibitor、pcDNA-SOX4、Vector转染至细胞中。48h后收集细胞进行下一步研究。
1.2.3实时荧光定量PCR实验(RT-qPCR):使用TRIzol提取试剂盒从组织和细胞中提取总RNA。使用紫外分光光度计在260和280nm处测定光密度(OD)值和RNA浓度。OD260/OD280比值为1.8-2.0被用于后续实验。用RT逆转录试剂盒或miRNA逆转录试剂盒将总RNA逆转录为cDNA。随后,使用SYBR Premix Ex TaqTMⅡ试剂盒进行qPCR反应。反应条件为:95℃预变性5min,95℃变性30s,60℃退火30s,72℃延伸1min,循环40次。使用2-ΔΔCt方法定量mRNA和miRNA的表达水平,GAPDH和U6分别作为mRNA和miRNA的内参基因。
1.2.4Western blot:收集转染后的细胞,在含蛋白酶抑制剂的裂解缓冲液中裂解细胞。在4℃、14000 rpm离心10min后,收集上清液,使用BCA蛋白检测试剂盒定量蛋白浓度。然后,在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上分离20μg蛋白质,并转至聚偏氟乙烯(PVDF)膜上,用5%脱脂牛奶封闭以阻断非特异性结合。然后在4℃下与一抗孵育过夜。用TBST洗涤膜3次,然后与辣根过氧化物酶(HRP)结合的二抗在室温下孵育2h。最后利用增强型化学发光试剂对蛋白条带进行可视化,分析条带相对灰度值,以目标条带与内参条带灰度值的比值作为蛋白的相对表达量。
1.2.5CCK-8实验:采用细胞计数试剂盒-8(CCK-8)法检测Raji细胞增殖能力。将转染后的细胞(5×104个细胞/孔)接种到96孔板中,在不同时间点(0h、24h、48h、72h)于每孔加入10μL CCK-8试剂,放入培养箱中再孵育4h。然后使用酶标仪测量波长为450nm处的吸光度值。
1.2.6克隆形成实验:将转染后的Raji细胞接种于6孔板中,每孔300个细胞。每3d更换一次培养液。培养10d后,当出现肉眼可见的克隆时,终止培养。随后用甲醇固定细胞15min,再用结晶紫溶液染色30min并干燥。在显微镜下拍照并计数菌落数量。
1.2.7流式细胞术:使用Annexin V-FITC/PI凋亡试剂盒检测Raji细胞凋亡率。收集转染后的Raji细胞,用预冷PBS洗涤2次,随后与5μL Annexin V-FITC和10μL 碘化丙啶(PI)染色液在室温下避光孵育15min。然后,流式细胞仪检测细胞凋亡情况,并使用Flowjo软件分析数据。
1.2.8双荧光素酶报告基因实验:通过生物信息学软件预测miR-34a和SOX4 mRNA之间的结合序列。为了验证miR-34a和SOX4 mRNA的结合关系,设计含有与miR-34a结合位点的SOX4 3'UTR序列,并将其插入pmirGLO报告载体以构建野生型荧光素酶载体。通过突变miR-34a和SOX4 mRNA之间的结合序列从而构建突变型荧光素酶载体。将报告载体与 miR-34a mimic或NC mimic共转染至细胞中。48h后,收集细胞,使用双荧光素酶报告基因检测试剂盒测定细胞中的荧光素酶活性。
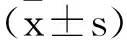
2 结 果
2.1miR-34a和SOX4在PCNSL组织中的表达:结果显示,与Control组比较,PCNSL组织中miR-34a表达水平明显降低,SOX4 mRNA和蛋白表达水平明显升高,差异均有统计学意义(P<0.05),见图1。

图1 miR-34a和SOX4在PCNSL组织中的表达注:与Control组比较,*P<0.05
2.2过表达或敲低miR-34a对PCNSL细胞增殖能力的影响:CCK-8实验和克隆形成实验结果显示,与NC mimic组比较,miR-34a mimic组细胞中miR-34a表达显著升高,细胞增殖能力显著降低;与NC inhibitor组比较,miR-34a inhibitor组细胞中miR-34a表达显著降低,细胞增殖能力显著升高,差异均有统计学意义(P<0.05),见图2。
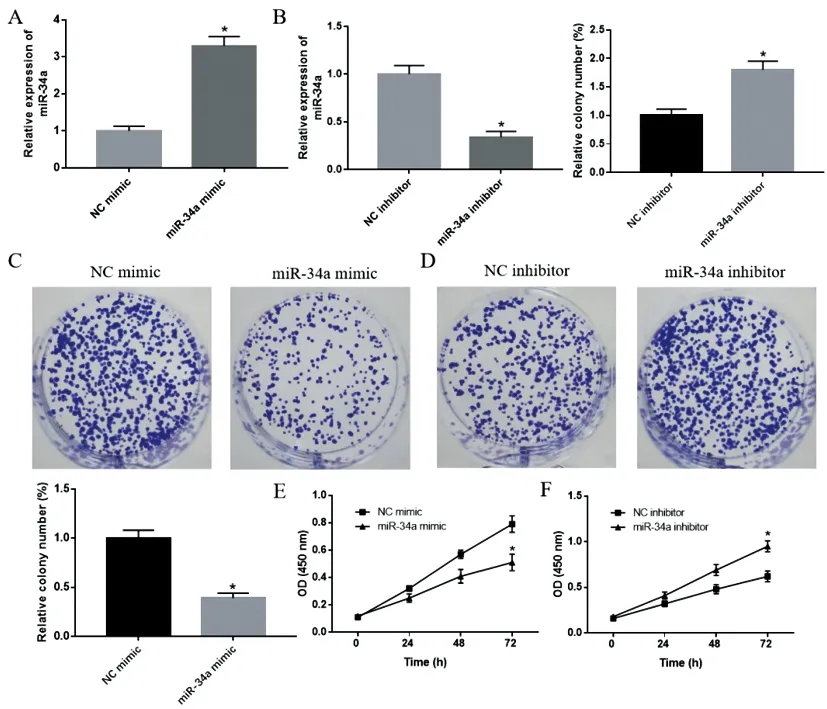
图2 过表达或敲低miR-34a对PCNSL细胞增殖能力的影响注:A-B.RT-qPCR检测各组细胞中miR-34a的表达;C-D.CCK-8实验检测;E-F.克隆形成实验。与NC mimic组、NC inhibitor组比较,*P<0.05
2.3过表达或敲低miR-34a对PCNSL细胞凋亡的影响:流式细胞术结果显示,与NC mimic组比较,miR-34a mimic组细胞凋亡率显著升高;与NC inhibitor组比较,miR-34a inhibitor组细胞凋亡率显著降低,差异均有统计学意义(P<0.05),见图3。
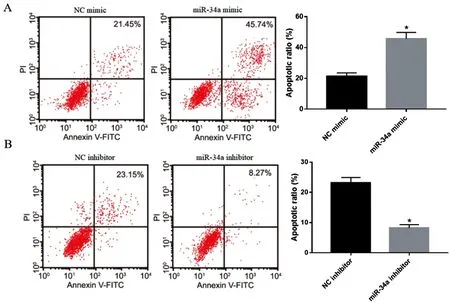
图3 过表达或敲低miR-34a对PCNSL细胞凋亡的影响注:A.流式细胞术检测过表达miR-34a对细胞凋亡率的影响;B.流式细胞术检测敲低miR-34a对细胞凋亡率的影响。与NC mimic组、NC inhibitor组比较,*P<0.05
2.4miR-34a靶向并调控SOX4的表达:生物信息学软件预测miR-34a与SOX4 3′UTR序列之间具有特殊的结合位点。双荧光素酶报告基因结果显示,与NC mimic组比较,共转染miR-34a mimic和WT-SOX4的细胞荧光素酶活性显著降低(P<0.05),而共转染miR-34a mimic和MUT-SOX4的细胞荧光素酶活性无显著性变化(P>0.05)。此外,与NC mimic组比较,miR-34a mimic组细胞中SOX4 mRNA和蛋白表达显著降低;与NC inhibitor组比较,miR-34a inhibitor组细胞中SOX4 mRNA和蛋白水平显著升高(P<0.05),见图4。
图4 miR-34a靶向并调控SOX4的表达注:A.miR-34a与SOX4 3′UTR的结合位点;B.双荧光素酶报告基因实验;C.RT-qPCR检测SOX4 mRNA的表达;D.Western blot检测SOX4蛋白的表达。与NC mimic组比较,*P<0.05;与NC inhibitor组比较,#P<0.05
2.5miR-34a通过调控SOX4对PCNSL细胞增殖、凋亡的影响:结果显示,与NC mimic组比较,miR-34a mimic组细胞中SOX4 mRNA表达显著降低,细胞增殖能力和细胞活力均显著降低,细胞凋亡率显著升高;与miR-34a mimic+Vector组比较,miR-34a mimic+pcDNA-SOX4组细胞中SOX4 mRNA表达显著升高,细胞增殖能力和细胞活力均显著升高,细胞凋亡率显著降低,差异均有统计学意义(P<0.05),见图5。
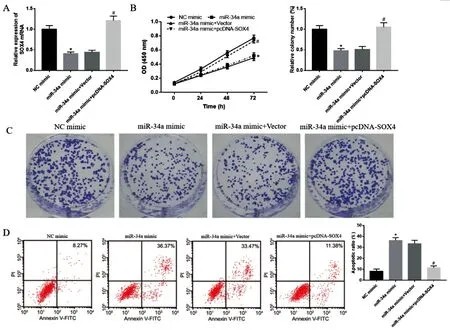
图5 miR-34a通过调控SOX4对PCNSL细胞增殖、凋亡的影响注:A.RT-qPCR检测SOX4 mRNA的表达;B-C.CCK-8和克隆形成实验检测细胞增殖能力;D.流式细胞术检测细胞凋亡率。与NC mimic组比较,*P<0.05;与miR-34a mimic+Vector组比较,#P<0.05
2.6miRNA-34a通过调控SOX4对RAS/MAPK信号通路蛋白的影响:结果显示,与NC mimic组比较,miR-34a mimic组细胞中Ras、p-Raf-1、p-MEK蛋白表达显著降低;与miR-34a mimic+Vector组比较,miR-34a mimic+pcDNA-SOX4组细胞中Ras、p-Raf-1、p-MEK蛋白表达显著升高,差异均有统计学意义(P<0.05),见图6。

图6 miR-34a通过调控SOX4对RAS/MAPK信号通路蛋白的影响注:与NC mimic组比较,*P<0.05;与miR-34a mimic+Vector组比较,#P<0.05
3 讨 论
PCNSL是一种罕见的NHL,其临床特征不具特异性,诊断困难。90%以上的PCNSL为弥漫性大B细胞淋巴瘤,预后较差。目前以大剂量甲氨蝶呤为基础的化疗作为一线治疗,还没有针对PCNSL的标准治疗方法。因此,早期诊断对于PCNSL的治疗和预后非常重要。
miRNAs在多种类型的癌症中表达失调,并且miRNAs可能充当癌基因和肿瘤抑制基因,参与许多生物学过程,包括增殖、凋亡、转移和化疗耐药[7]。因此,miRNAs可被用作癌症诊断和预后的生物标志物。miR-34家族是一类高度保守的miRNA,包括三个同源基因,即miR-34a、miR-34b和miR-34c。其中,miR-34a是miR-34基因突变的结果,位于人类1p36染色体上。之前研究报道miR-34a在胃癌、肝癌、头颈部鳞状细胞癌等多种恶性肿瘤中发挥抑癌功能[8,9]。本研究首次发现PCNSL组织中miR-34a的表达水平显著降低。本研究进一步通过体外功能实验发现,miR-34a过表达明显抑制Raji细胞增殖,促进细胞凋亡。敲低miR-34a则促进细胞凋亡,抑制细胞凋亡。以上研究表明miR-34a可能是PCNSL的潜在肿瘤抑制因子。
miRNAs对细胞生物学行为的调控是基于其对下游靶基因的调控。SOX4是一种发育转录因子,在祖细胞的发育过程中起着重要作用。很多研究表明SOX4在多种恶性肿瘤中异常表达。然而,PCNSL中miR-34a和SOX4之间的关系尚不清楚。本研究使用生物信息学分析和双荧光素酶报告基因实验发现miR-34a靶向并负调控SOX4的表达。为了进一步确定SOX4是否参与miR-34a调控细胞增殖,本研究将miR-34a mimic与pcDNA-SOX4共转染至Raji细胞。通过功能挽救实验发现,SOX4过表达可显著逆转miR-34a mimic对Raji细胞增殖的抑制作用,以上研究结果表明miR-34a通过抑制SOX4调控Raji细胞增殖和凋亡。
为了探讨miR-34a/SOX4轴在PCNSL中发挥作用的机制,进一步研究了其潜在的下游信号通路。MAPK也称为细胞外信号调节激酶,参与多种细胞过程,如增殖、转录调节、分化和发育。已有研究表明,SOX4是MAPK信号通路的关键激活因子[10]。此外,研究还发现RAS/MAPK信号通路激活可能会增强PCNSL的致瘤性[11]。本研究发现,过表达miR-34a可显著抑制Ras、p-Raf-1、p-MEK蛋白表达,而SOX4过表达可逆转miR-34a对RAS/MAPK信号通路蛋白表达的抑制作用。以上结果提示过表达miR-34a靶向SOX4调控RAS/MAPK信号通路抑制Raji细胞增殖,促进细胞凋亡。
综上所述,本研究发现miR-34a通过靶向SOX4抑制Raji细胞增殖能力,促进细胞凋亡,其机制可能与抑制RAS/MAPK信号通路有关,以上研究结果提示miR-34a可能是PCNSL临床诊断或预后的潜在生物标志物。
