芝麻素通过lncRNA WEE2-AS1/miR-515-5p通路影响高糖诱导的血管内皮细胞损伤的机制研究
2023-03-10周慧超曹云玲井庆平
孙 珂,周慧超,曹云玲,井庆平
糖尿病是临床常见的一种慢性多发性疾病,随着疾病的进展病人会出现糖尿病血管病变、糖尿病肾病等多种慢性并发症,严重降低病人生活质量,其中糖尿病血管病变是引起心血管疾病的重要因素之一。研究[1-3]发现血管内皮细胞在糖尿病血管病变过程中发挥重要调控,高糖诱导的人脐静脉血管内皮细胞(HUVEC)损伤与糖尿病血管病变、糖尿病视网膜病变等密切相关。芝麻素是从芝麻中提取的活性成分,其具有抗氧化、降压等作用,研究[4]表明芝麻素可抑制氧化应激而减轻心肌缺血再灌注损伤。但芝麻素对糖尿病血管病变等糖尿病并发症影响的研究相对较少。长链非编码RNA(LncRNA)在多种疾病中表达异常,并可通过充当miRNA竞争性内源RNA(ceRNA)而发挥作用,研究[5]指出LncRNA WEE2-AS1在闭塞性动脉硬化症病人中表达上调,并可能调控血管内皮细胞增殖及凋亡。LncBase Predicted v.2预测显示WEE2-AS1与miR-515-5p存在结合位点,研究[6]表明miR-515-5p在氧化型低密度脂蛋白(ox-LDL)诱导的血管内皮细胞中表达下调,并可参与细胞增殖及迁移等过程。但WEE2-AS1与miR-515-5p是否可参与糖尿病血管病变的发生过程尚未可知。因此,本研究用高糖诱导血管内皮细胞建立细胞损伤模型,探讨芝麻素是否可通过调控WEE2-AS1/miR-515-5p轴而调节细胞增殖、凋亡及氧化应激。
1 材料与方法
1.1 材料与试剂 芝麻素购自上海纯优生物;HUVEC购自上海弘顺生物;DMEM培养液与胎牛血清购自美国Gibco;Trizol试剂购自北京全式金生物;逆转录试剂与荧光定量PCR试剂购自北京天根;Lipofectamine2000、MTT、凋亡检测试剂盒购自北京索莱宝;超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;sh-NC、sh-WEE2-AS1、miR-NC、miR-515-5p mimics购自广州锐博生物;慢病毒载体购自广州复能基因;兔抗人cleaved-caspase3抗体与二抗购自美国Abcam。
1.2 方法
1.2.1 实验分组 HUVEC分别培养于含有30 mmol/L、5.5 mmol/L葡萄糖的培养基内培养24 h[7],记为HG组、NG组。HUVEC分别加入含有不同浓度(10、20、40 μmol/L)芝麻素与含有30 mmol/L葡萄糖的培养基内培养24 h[8],分别记为HG+SES-L组、HG+SES-M组、HG+SES-H组。脂质体转染技术分别将sh-NC、sh-WEE2-AS1转染至血管内皮细胞后加入含有30 mmol/L葡萄糖的培养基内培养24 h,分别记为HG+sh-NC组、HG+sh-WEE2-AS1组。构建WEE2-AS1稳定过表达细胞株:血管内皮细胞用含有10%胎牛血清的培养基复苏后,取对数生长期细胞接种于6孔板后用WEE2-AS1慢病毒进行感染(细胞∶病毒=1∶100),24 h后用含有2 mg/L嘌呤霉素的培养基处理24 h,目的是杀死未感染成功的细胞,存活的细胞为WEE2-AS1稳定过表达的细胞,记为WEE2-AS1-LV组。含有WEE2-AS1-LV的血管内皮细胞于30 mmol/L葡萄糖的培养基内培养24 h,记为HG+WEE2-AS1-LV组。用40 μmol/L芝麻素与30 mmol/L葡萄糖共同培养含有WEE2-AS1-LV的血管内皮细胞24 h,记为HG+SES+WEE2-AS1-LV组。
1.2.2 qRT-PCR检测WEE2-AS1、miR-515-5p的表达水平 取各组血管内皮细胞接种于6孔板(1×105个/孔),用Trizol法提取总RNA,按照Trizol试剂说明书操作,用分光光度计检测RNA浓度,按照SuperRT cDNA Synthesis Kit逆转录试剂盒说明书将总RNA逆转录合成cDNA,以cDNA为模板进行qRT-PCR反应,反应体系:10×PCR Buffer 2.5 μL,MgSO42.5 μL,dNTPs 2.5 μL,正反向引物各0.5 μL,cDNA 2 μL,RNase-Free ddH2O补足体系至25 μL,用ABI StepOnePlus荧光定量PCR仪检测基因相对表达量。WEE2-AS1正向引物5′-ATG ACG ACC CCC AAT AAA GGA-3′,反向引物5′-CAC CGA CAT GGT TAC CAG C-3′;miR-515-5p正向引物5′-GCT TCG GTT AAT GCT AAT CGT G-3′,反向引物5′-CAG AGC AGG GTC CGA GGT A-3′;GAPDH正向引物5′-GGA GCG AGA TCC CTC CAA AAT-3′,反向引物5′-GGC TGT TGT CAT ACT TCT CAT GG-3′;U6正向引物5′-ATT GGA ACG ATA CAG AGA AGA TT-3′,反向引物5′-GGA ACG CTT CAC GAA TTT G-3′。
1.2.3 MTT检测细胞增殖 收集各组血管内皮细胞按照每孔100个细胞的密度接种于96孔板,于培养箱内培养24 h后每孔加入20 μL MTT溶液,于培养箱内培养4 h后弃上清,将DMSO按照每孔150 μL的密度加入其中,室温振荡孵育10 min后用酶标仪检测490 nm处的吸光度值(OD),以OD值表示细胞活力大小。
1.2.4 流式细胞术检测细胞凋亡率 用Annexin V-FITC/PI双染法检测细胞凋亡率,用不含EDTA的胰蛋白酶消化各组血管内皮细胞,取5×104个细胞加入500 μL Binding Buffer重悬细胞,并将细胞转移至流式管中,分别加入5 μL Annexin V-FITC,充分混匀后室温避光孵育15 min,加入5 μL PI染色,用FACS Calibur流式细胞仪检测细胞凋亡率。
1.2.5 检测氧化应激指标SOD、LDH、MDA的水平 收集各组血管内皮细胞培养上清液,根据试剂盒说明书检测LDH的活性。用反复冻融法裂解血管内皮细胞,根据试剂盒说明书分别检测SOD、MDA的水平。
1.2.6 双荧光素酶报告基因检测WEE2-AS1与miR-515-5p的靶向关系 构建野生型和突变型基因WEE2-AS1的荧光素酶表达载体wt-WEE2-AS1、mut-WEE2-AS1,用脂质体转染技术分别将wt-WEE2-AS1、mut-WEE2-AS1与miR-NC或miR-515-5p mimics共转染至血管内皮细胞,用荧光素酶报告基因检测试剂盒检测其荧光素酶活性。
1.2.7 Western blotting检测cleaved-caspase3蛋白表达 用放射免疫沉淀试验(RIPA)裂解各组血管内皮细胞并提取细胞总蛋白,将蛋白与上样缓冲液充分混匀后100 ℃煮沸10 min,蛋白变性,按照每孔20 μL的密度将蛋白样品加入凝胶上样孔,然后进行电泳与转膜,封闭1 h,加入稀释的cleaved-caspase3单克隆抗体(1∶800)与GAPDH抗体(1∶1 000),在4 ℃孵育过夜,TBST洗涤后加入二抗(1∶5 000),室温孵育2 h,用ECL进行显色,用ImageJ软件分析各条带灰度值。
1.3 统计学方法 采用独立样本t检验、单因素方差分析和q检验。
2 结果
2.1 芝麻素对高糖诱导的HUVEC损伤的影响 与NG组比较,HG组WEE2-AS1的表达量升高,miR-515-5p的表达量降低,细胞活力降低,凋亡率和cleaved-caspase3蛋白水平升高,差异均有统计学意义(P<0.05);与HG组比较,HG+SES-L组、HG+SES-M组、HG+SES-H组WEE2-AS1的表达量降低,miR-515-5p的表达量升高,细胞活力升高,凋亡率和cleaved-caspase3蛋白水平降低,且呈剂量依赖性(P<0.05)(见图1、表1)。
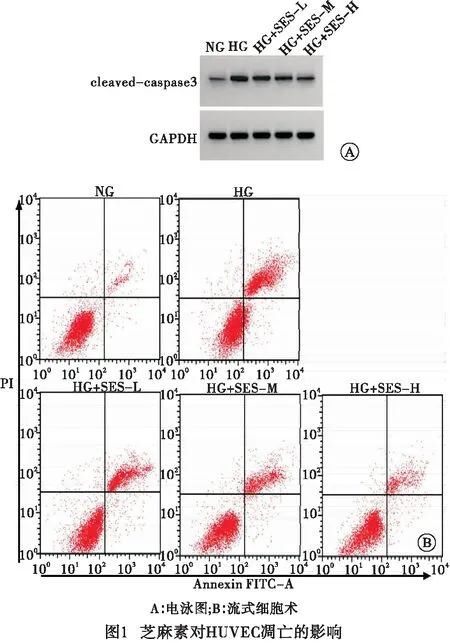
2.2 芝麻素对高糖诱导的HUVEC氧化应激的影响 与NG组比较,HG组SOD的活性降低,LDH的活性和MDA的水平升高,差异均有统计学意义(P<0.05);与HG组比较,HG+SES-L组、HG+SES-M组、HG+SES-H组SOD的活性升高,LDH的活性和MDA的水平降低,且呈剂量依赖性(P<0.05)(见表2)。
2.3 干扰WEE2-AS1对高糖诱导的HUVEC损伤氧化应激的影响 与HG组、HG+sh-NC组比较,HG+sh-WEE2-AS1组miR-515-5p的表达量升高,细胞活力升高,凋亡率和cleaved-caspase3蛋白水平降低,SOD的活性升高,LDH的活性和MDA的水平降低,差异均有统计学意义(P<0.05)(见图2、表3)。
2.4 WEE2-AS1靶向miR-515-5p LncBase Predicted v.2预测显示WEE2-AS1与miR-515-5p存在结合位点(见图3)。miR-515-5p过表达可抑制野生型载体wt-WEE2-AS1的荧光素酶活性(P<0.01),而对突变型载体mut-WEE2-AS1的荧光素酶活性无明显影响(见表4)。

表1 芝麻素对HUVEC增殖及凋亡的影响

表2 芝麻素对HUVEC中SOD、LDH和MDA的影响

2.5 WEE2-AS1对芝麻素处理的高糖诱导的HUVEC损伤氧化应激的影响 与HG组比较,HG+WEE2-AS1-LV组miR-515-5p的表达量降低,细胞活力降低,凋亡率和cleaved-caspase3蛋白水平升高,SOD的活性降低,LDH的活性和MDA的水平升高,差异均有统计学意义(P<0.05);与HG+SES组比较,HG+SES+WEE2-AS1-LV组miR-515-5p的表达量降低,细胞活力降低,凋亡率和cleaved-caspase3蛋白水平升高,SOD的活性降低,LDH的活性和MDA的水平升高,差异均有统计学意义(P<0.05)(见图4、表5)。


3 讨论
糖尿病的发病机制较为复杂,炎症、氧化应激等引起的血管内皮细胞凋亡可促进糖尿病病情恶化,保护血管内皮细胞是缓解糖尿病病情的关键环节[9]。LncRNA在高糖诱导血管内皮细胞中表达异常,并可调控细胞增殖、自噬及凋亡等生物学过程[10-11]。但LncRNA是否可作为中药提取物治疗糖尿病的潜在靶点尚未阐明。

表3 干扰WEE2-AS1对HUVEC增殖、凋亡和SOD、LDH和MDA的影响

表4 双荧光素酶报告实验
芝麻素具有改善心肌、血管肥厚等作用,并可抑制炎症反应而保护脑组织[12]。芝麻素可明显改善冠心病大鼠脂代谢与血管内皮功能[13]。本研究结果显示,高糖诱导的血管内皮细胞活力降低,凋亡率和cleaved-caspase3蛋白水平升高,与丰磊等[14]研究结果相似,提示成功建立细胞损伤模型。本研究发现芝麻素能够升高高糖诱导的血管内皮细胞活力,降低凋亡率和cleaved-caspase3蛋白水平,且呈剂量依赖性,提示芝麻素可促进高糖诱导的血管内皮细胞增殖及抑制细胞凋亡。本研究结果显示,高糖诱导的血管内皮细胞中SOD的活性降低,LDH的活性和MDA的水平升高,与乔先栋等[15]研究结果相似,芝麻素能够增强血管内皮细胞抗氧化能力而减轻细胞氧化损伤。但芝麻素影响高糖诱导的血管内皮细胞损伤的分子机制尚需进一步探究。

表5 WEE2-AS1可逆转芝麻素对高糖诱导的HUVEC的影响
本研究通过检测芝麻素作用后血管内皮细胞中LncRNA表达情况,检测结果显示WEE2-AS1的表达量升高,miR-515-5p的表达量降低,而随着芝麻素浓度的增加,高糖诱导的血管内皮细胞中WEE2-AS1的表达量降低,miR-515-5p的表达量升高,提示芝麻素可能通过抑制WEE2-AS1的表达及促进miR-515-5p的表达而发挥作用。研究[16-17]表明WEE2-AS1在三阴性乳腺癌、胶质母细胞瘤中表达上调,并可促进细胞增殖及抑制细胞凋亡。但WEE2-AS1在高糖诱导的血管内皮细胞损伤中的作用机制尚未可知。本研究结果显示,干扰WEE2-AS1表达后miR-515-5p的表达量升高,高糖诱导的血管内皮细胞活力升高,凋亡率降低,SOD的活性升高,LDH的活性和MDA的水平降低,提示干扰WEE2-AS1可能通过上调miR-515-5p的表达而促进高糖诱导的血管内皮细胞增殖及抑制细胞凋亡、氧化应激。本研究证实血管内皮细胞中WEE2-AS1能够靶向结合miR-515-5p,并可充当miR-515-5p的ceRNA分子而发挥作用。研究[18]表明miR-515-5p过表达可能抑制类风湿关节炎的发展进程。本研究结果显示,WEE2-AS1过表达可通过降低miR-515-5p的表达量而部分逆转芝麻素对高糖诱导的血管内皮细胞增殖、凋亡及氧化应激的作用。
综上所述,高糖诱导的血管内皮细胞中WEE2-AS1的表达量升高,miR-515-5p的表达量降低,芝麻素可通过降低WEE2-AS1的表达量而促进miR-515-5p的表达,从而促进高糖诱导的血管内皮细胞增殖及抑制细胞凋亡、氧化应激进而减轻细胞损伤,芝麻素可能通过调控WEE2-AS1/miR-515-5p轴而减缓糖尿病的发展进程。但关于其具体作用机制仍需进一步探究。
