投喂策略对黄颡鱼生长和繁殖的影响
2023-03-10高炜烨费树站刘昊昆杨云霞金俊琰朱晓鸣张志敏解绶启
高炜烨 费树站 刘昊昆 韩 冬 , 杨云霞 金俊琰 朱晓鸣 张志敏 解绶启 ,
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049;3. 湖北省水产动物营养与饲料工程技术研究中心, 武汉 430072)
投喂策略是指养殖中为获得最佳经济效益而采取的一系列投喂技术[1]。现阶段大多数投喂策略针对商品鱼的生产而设计, 为追求快速生长, 投喂水平一般较高。这些投喂策略应用于亲鱼养殖时往往造成投喂过量, 进而导致亲鱼脂肪异常沉积、繁殖性能降低, 同时使环境污染增加、养殖成本上升[2,3]。例如Xiong等[4]发现持续过量投喂黄颡鱼(Pelteobagrus fulvidraco)亲鱼52d后其产卵率、受精率和孵化率均显著下降; Rodrigues等[5]发现过量投喂斑马鱼(Danio rerio)会显著提高后代的死亡率和畸形率。由此可见, 设计针对亲鱼的投喂策略是十分必要的。
有研究表明, 适度降低投喂水平, 能维持甚至提升亲鱼的繁殖能力。例如Carvalho和Urbinati[6]将石脂鲤(Brycon cephalus)的投喂水平降到饱食组的40%, 对其繁殖能力没有显著影响; Sliverstein和Shimma[7]发现适度降低投喂水平可以加快三文鱼(Oncorhynchus mason)亲鱼的性成熟; 在养殖生产中, 已经性成熟的亲鱼所需的最适投喂水平也普遍低于幼鱼[8]。同时, 低投喂水平的投喂策略还能降低饲料成本, 在亲鱼养殖中有巨大的应用价值。
补偿生长是指“受环境条件限制而经过一段时期生长停滞或负生长的动物在环境条件恢复正常后所表现出的超常生长”[9]。采用饥饿再恢复投喂的投喂策略是激发补偿生长的普遍方式, 补偿生长可以使鱼的体重超过同时正常投喂的同类[10], 生长率甚至能达到其两倍[11]。推测基于补偿生长的投喂策略对亲鱼养殖有以下益处: 一方面, 亲鱼的繁殖力随体型增加而增加[12], 那么补偿生长可能会同时提高亲鱼的生长和繁殖性能[13]; 另一方面, 鱼类性成熟可能存在体型上的阈值, 那么补偿生长可能通过加速生长使亲鱼提前性成熟[14]。然而上述理论目前仍缺乏实验验证。
黄颡鱼(Pelteobagrus fulvidraco)隶属于鲶形目、鲿科、黄颡鱼属, 是一种优质名贵经济鱼类。目前在养殖中降低投喂水平对黄颡鱼母本的影响尚不明确, 未见专门针对黄颡鱼母本设计的投喂策略文献报道。本文主要探究黄颡鱼母本生长、体成分、繁殖能力和性激素合成与投喂策略的关系,同时尝试探讨基于补偿生长的投喂策略在亲鱼养殖中的应用, 筛选黄颡鱼母本养殖的适宜投喂策略,为亲鱼养殖管理提供科学依据。
1 材料与方法
1.1 实验鱼和实验饲料
实验用黄颡鱼来自湖北黄优源渔业发展有限公司, 实验开始前在室内循环水养殖系统中暂养2周进行驯化。实验采用商品饲料, 经测定其蛋白含量为39.40%、脂肪含量为8.46%。暂养期间饱食投喂, 每天投喂2次,时间为9:00和15:00。在正式实验前, 实验鱼饥饿24h, 选取体格健壮、规格均匀的雌性个体[初始均重(86.60±0.41) g], 称重后随机放入16个养殖缸(水体积400 L)中, 每缸15尾。
1.2 实验养殖系统
实验在室内循环水养殖系统中进行, 使用充气头在非投喂期间连续充气增氧。使用LED灯作为光源, 光照周期为12L∶12D (8:00—20:00)。养殖期间水温变化为(25.7±1.0)℃, 水体溶氧>7.5 mg/L, 氨氮<0.1 mg/L, pH为6.5—7.0。
1.3 饲养管理
实验周期65d。实验设计4个处理, 分别为饱食投喂的AS (Apparent satiety)组、80%饱食投喂的80AS组、50%饱食投喂的50AS组及先饥饿后饱食的HAS组, 每组4个平行。每天9:00和15:00投喂, 依据AS组当天每缸的投喂量确定80AS 组和50AS 组第二天每缸的投喂量, 按此方法投喂至实验结束。HAS组连续饥饿34d后恢复饱食投喂31d至实验结束。
1.4 实验取样
在HAS恢复饱食投喂前1天取中期样, 在实验结束当天取末期样, 取样前各组饥饿24h。每缸鱼计数称重, 然后取2尾鱼测量体重和体长, 并用0.2%肝素钠润过的注射器进行尾部取血, 在4℃下3000 r/min离心10min (Eppendorf 5417R, Germany),取上清血浆存于-80℃冰箱。随后置于冰盘上解剖取背肌和性腺存于-20℃冰箱中用于组分分析, 取性腺经液氮速冻后存于-80℃冰箱中, 用于提取总RNA。此外, 末期取样还取了用于测定繁殖性能的卵样品: 卵称重后用1 mL 4%多聚甲醛固定并转入4℃冰箱保存。
1.5 样品分析
参考AOAC[15]的方法测定基本组分, 样品在冷冻干燥机(ALPHA 1-2 LD plus, Christ, Germany)中冻干48h测定干物质含量; 使用凯氏定氮仪(2300 Kjeltec Analyzer Unit, FOSS TECATOR, Sweden)测定粗蛋白含量; 使用索氏抽提法脂肪测定仪(Soxtec system HT6, Tecator, Haganas, Sweden)以乙醚为溶剂测定粗脂肪; 使用马弗炉(湖北英山县建力电炉制造厂, 湖北英山)中以550℃充分灼烧样品测定灰分含量。
血浆总甘油三酯(TG)、总胆固醇(TCHO)、总葡萄糖(GLU)、总蛋白(TP)、低密度脂蛋白(LDLC)、高密度脂蛋白(HDL-C)、谷丙转氨酶(GPT)及谷草转氨酶(GOT)采用商品试剂盒进行测试(南京建成生物工程研究所, 中国南京)。
对卵样品进行计数和称重, 计算绝对和相对繁殖力。使用立体荧光显微镜(M205FA, Leica, Germany)测量每管样品中至少35个卵的直径。
血浆雌二醇、睾酮、促黄体生成素和卵泡刺激素含量由北京中同蓝博临床检验所(中国北京)测定, 采用125I放射性免疫检测法, 使用北京北方生物技术研究所(中国北京)的试剂盒, 检测流程遵循Zhang等[16]的方法。
根据GenBank数据库中已公布的黄颡鱼序列设计引物, 由武汉擎科创新生物科技有限公司(中国武汉)合成, 使用TRIzol (Invitrogen, USA)提取性腺组织的总RNA, 用Nanodrop 2000超微量分光光度计(Thermo Fisher Scientific, USA)和1%琼脂糖凝胶电泳检测RNA质量, 并用M-MLV逆转录酶 (Promega, USA)反转录(体系20 μL)成cDNA。在Light Cycle 480 Ⅱ PCR仪(Roche, Germany)上进行实时荧光定量反应。以黄颡鱼β肌动蛋白为内参基因,引物序列见表 1。PCR的具体程序详见Su等[17], 结果计算方法详见Vandesompele等[18]。

表1 实时荧光定量引物Tab. 1 Primers for qPCR
1.6 数据计算及统计处理
测定生长和形体指标的计算公式为:
日摄食量DFI (g/d)=干物质总摄食量/摄食天数
增重率WGR (%)=100×(终末体重-初始体重)/初始体重
饲料效率FE (%)=100×(终末体重-初始体重)/摄食量
绝对繁殖力=样品卵粒数目×卵巢重/样品重
相对繁殖力=绝对繁殖力/终末体重
采用SPSS 23.0(IBM SPSS Statistics 23.0, IBM,USA)经正态检验及方差齐性检验后, 同一时期不同处理的数据进行单因素方差分析(One-way ANOVA), 若各组之间存在显著差异(P<0.05)则进行Duncan’s多重比较; 同一处理不同时期的数据进行配对样本T检验(Matched samplesT-test)。
2 结果
2.1 生长、饲料利用
由表 2可知, AS、80AS和50AS三组的总摄食量基本符合实验设计比例并有显著差异, HAS组恢复摄食期间的日摄食量最高。中期体重随着投喂水平降低呈现降低趋势, 且80AS组与AS组无显著差异; 实验结束时HAS组体重和增重率与80AS组和50AS组无显著差异(P>0.05)。整个实验期间80AS组的体重、增重率和饲料效率与AS组没有显著差异(P>0.05)。HAS组的饲料效率低于其他各组(P<0.05)。

表2 不同投喂策略对黄颡鱼生长和饲料利用的影响(平均值±标准误)Tab. 2 Effects of different feeding regime on growth and feed utilization of yellow catfish (mean±SE)
2.2 肌肉、性腺基本组分
表3显示, 在实验中期, HAS组的肌肉粗蛋白含量最低, 各处理组的肌肉粗脂肪含量无显著差异;在实验结束时, AS组和80AS组的肌肉粗脂肪含量显著高于另外两个处理组, 肌肉粗蛋白含量随投喂水平的降低而降低, HAS组的肌肉粗蛋白含量显著高于中期(P<0.05)。
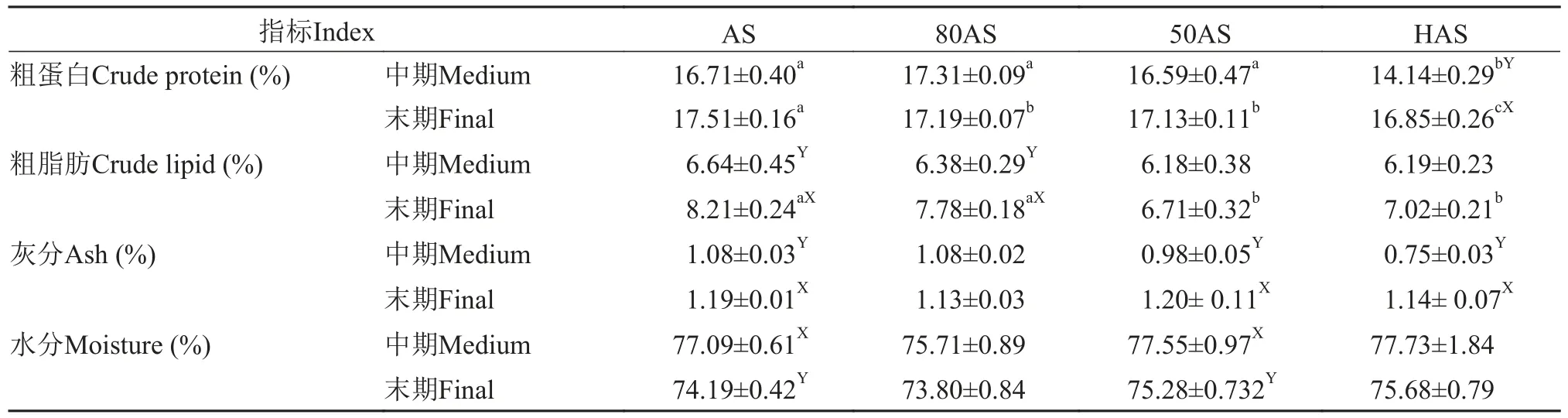
表3 不同投喂策略对黄颡鱼肌肉生化组成的影响(平均值±标准误)Tab. 3 Effects of different feeding regime on chemical composition in the muscle of yellow catfish (mean±SE)
由表 4可知, 中期HAS组的性腺粗蛋白含量最低(P<0.05), 末期性腺粗蛋白含量无显著差异, AS组、80AS组和HAS组的末期性腺粗蛋白显著高于中期。各组中期性腺粗脂肪含量随投喂水平降低而降低,末期性腺粗脂肪含量无显著差异(P>0.05), HAS组末期性腺粗脂肪显著大于中期性腺粗脂肪(P<0.05)。
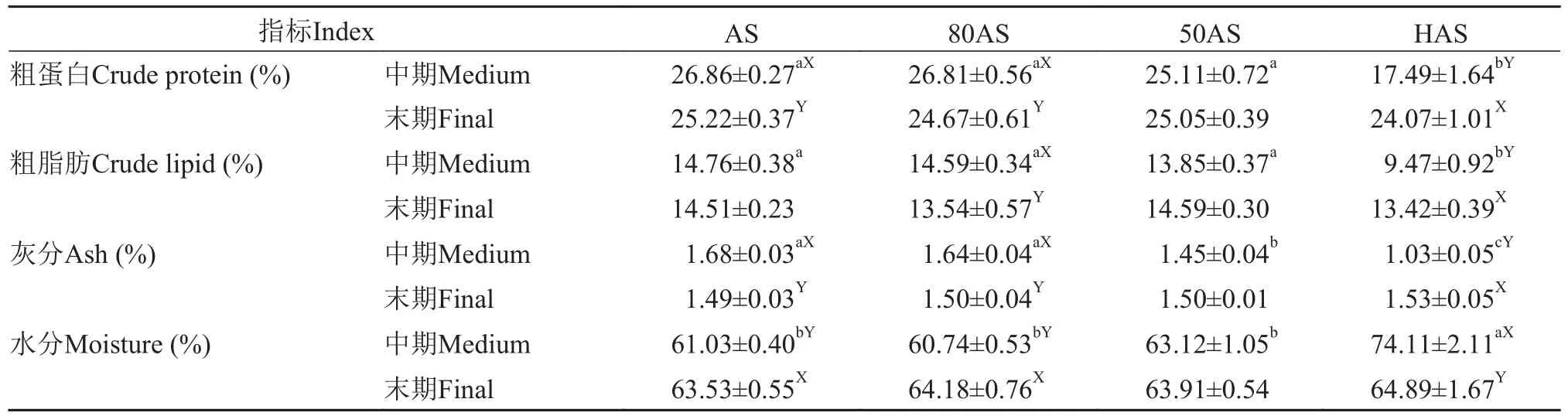
表4 不同投喂策略对黄颡鱼性腺生化组成的影响(平均值±标准误)Tab. 4 Effects of different feeding regime on chemical composition in the gonald of yellow catfish (mean±SE)
2.3 血浆生理生化指标
表5数据表明, 中期各组的血浆甘油三酯含量随投喂水平降低而降低, 末期除50AS组外三个组的血浆甘油三酯含量无显著差异, 且均显著高于中期(P<0.05)。各组在中期、末期血浆胆固醇含量均随投喂水平降低而降低。中期HAS组的血浆总蛋白最低, 末期各组间血浆总蛋白含量无显著差异(P>0.05), 除AS组外三个组的末期血浆总蛋白含量均显著高于中期(P<0.05), 中期各组的血浆低密度脂蛋白含量随投喂水平的降低而降低, HAS组最低,末期HAS组、80AS组与AS组无显著差异(P>0.05)。中期HAS组血浆高密度脂蛋白含量最低, 末期各组血浆高密度脂蛋白含量无显著差异(P>0.05)。
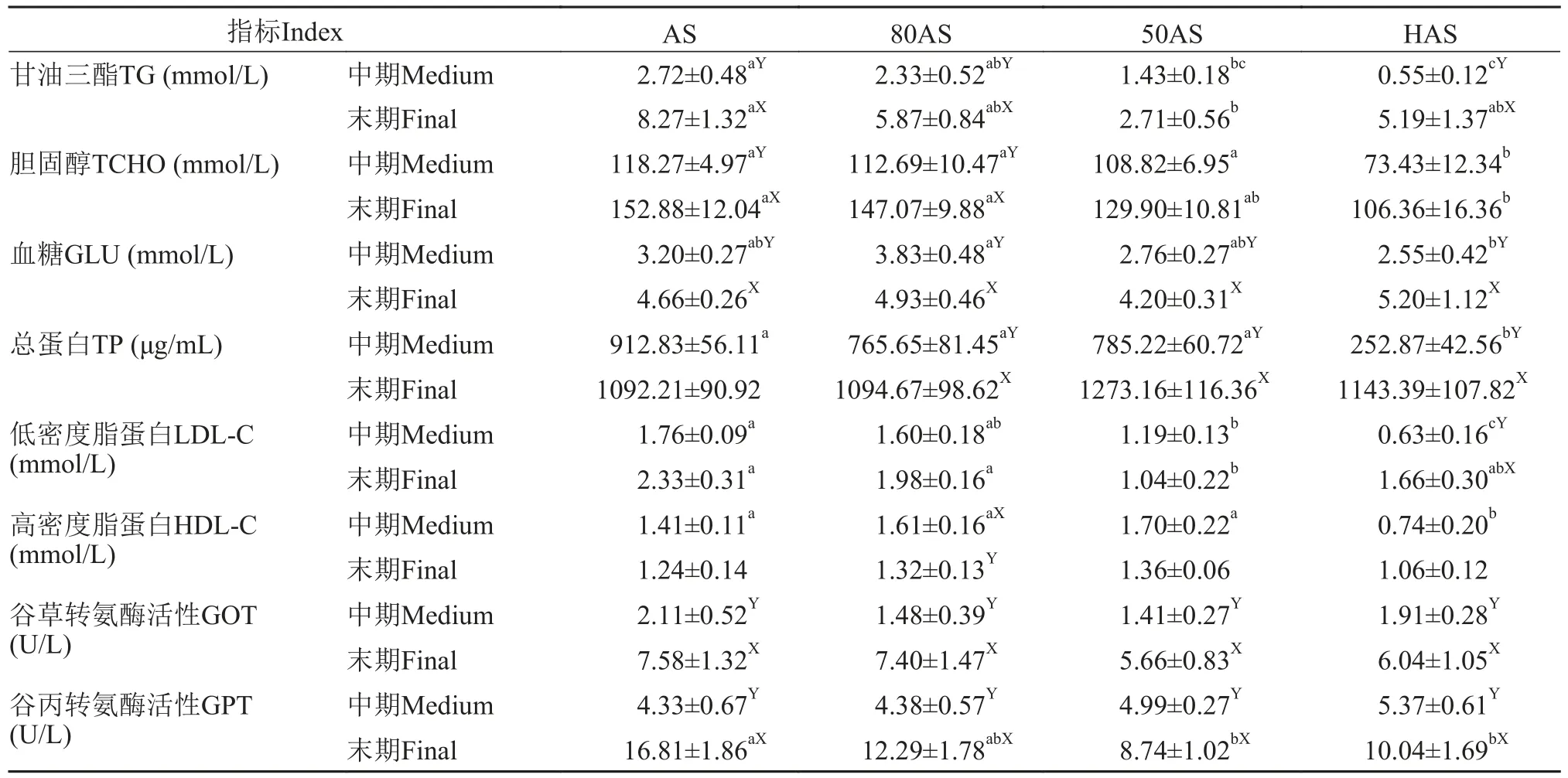
表5 不同投喂策略对黄颡鱼血浆生化组成的影响(平均值±标准误)Tab. 5 Effects of different feeding regime on plasma metabolites of yellow catfish (mean±SE)
2.4 繁殖性能
如图 1所示, 中期HAS组的腺体比最低(P<0.05),末期各组腺体比无显著差异(P>0.05), 80AS组、50AS组和HAS组末期腺体显著高于中期(P<0.05)。末期80AS组的卵直径与AS组没有显著差异(P>0.05),均显著低于HAS组(P<0.05)。各组末期绝对和相对繁殖力无显著差异(P>0.05)。
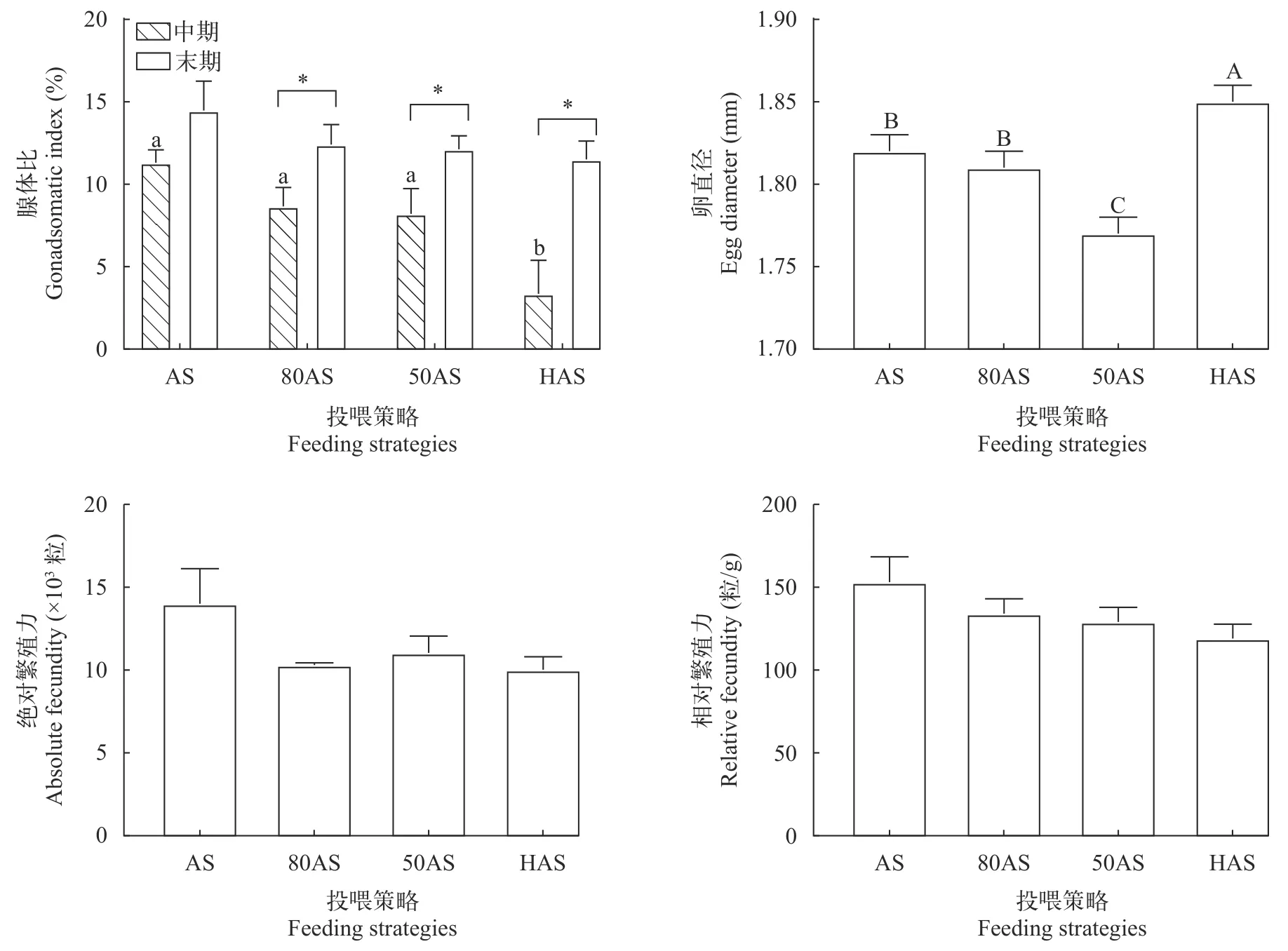
图1 不同投喂策略对黄颡鱼繁殖指标的影响Fig. 1 Effects of different feeding strategies on reproductive indexes of Pelteobagrus fulvidraco
2.5 性激素分泌
如图 2所示, 中期各处理组血浆促黄体生成素含量无显著差异, 末期80AS组促黄体生成素含量显著低于AS组(P<0.05), 50AS组和HAS组与AS组无显著差异(P>0.05)。各组中期、末期促卵泡激素含量无显著差异(P>0.05), HAS组促卵泡激素含量显著下降(P<0.05)。睾酮与雌二醇的趋势类似, 中期两种激素血浆含量随投喂水平降低而降低, 末期各组血浆睾酮和雌二醇含量无显著差异(P>0.05),在实验过程中50AS组和HAS组的血浆睾酮含量及HAS组的血浆雌二醇含量显著上升(P<0.05)。
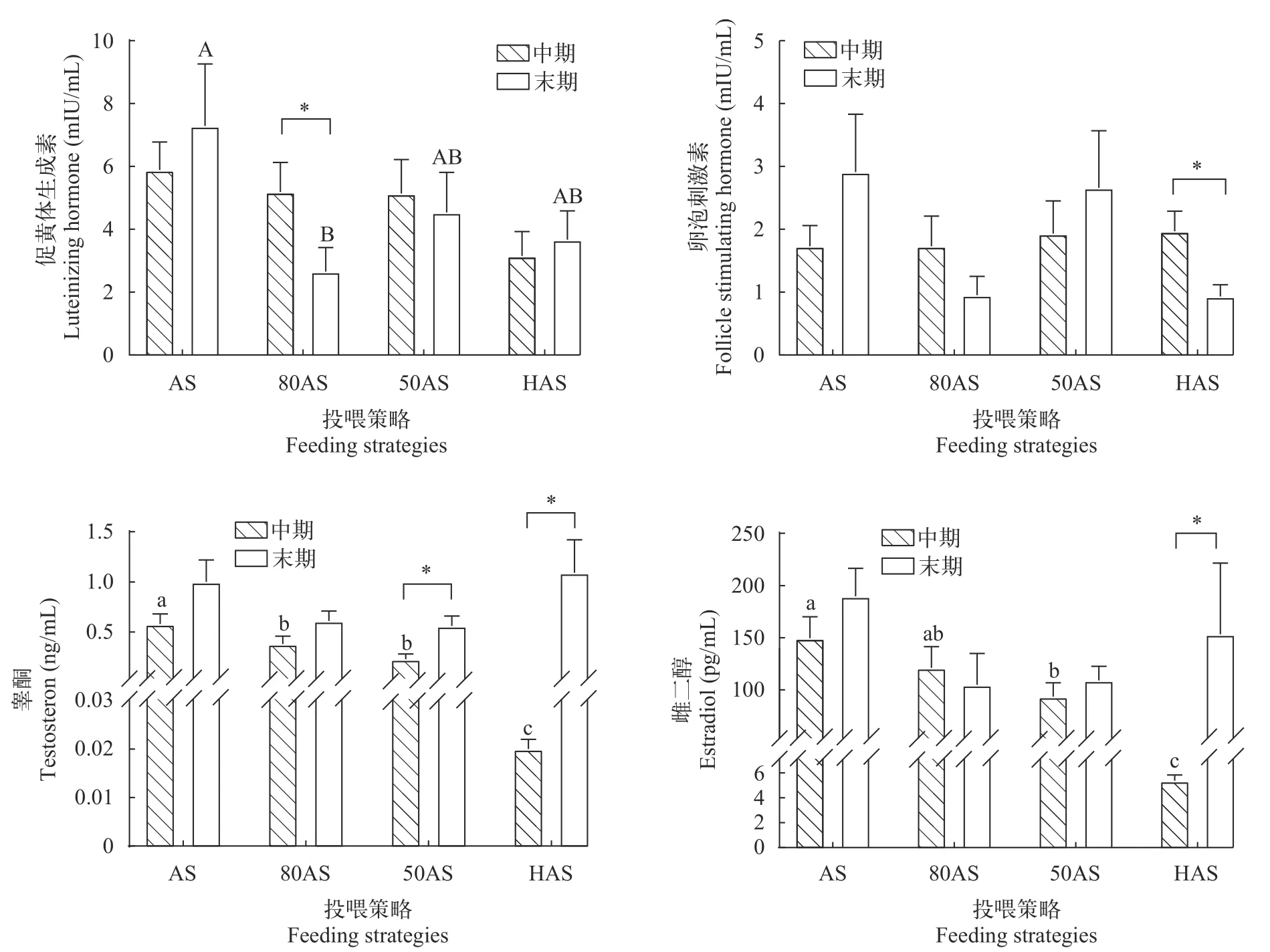
图2 不同投喂策略对黄颡鱼性激素分泌的影响Fig. 2 Effects of different feeding strategies on sex hormone secretion of Pelteobagrus fulvidraco
2.6 性激素合成及相关基因表达
如图 3所示, 中期时AS组的sf-1、3β-hsd和erβ的相对表达量显著高于其他各组。80AS组的star和cyp19a1表达量与AS组无显著差异, 并显著高于其他两组。HAS组的ar相对表达量最低。末期时各组的上述基因相对表达量无显著差异。
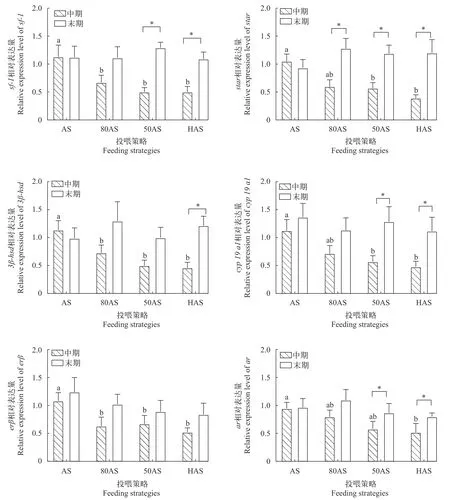
图3 黄颡鱼中期和末期性腺发育相关基因表达Fig. 3 Expression of genes involved in the gonadogenesis of the yellow catfish during the middle and the end of experiment
3 讨论
3.1 投喂策略对黄颡鱼生长和饲料利用的影响
大量研究发现, 适度降低投喂水平不会抑制鱼类生长, 例如, 75%饱食的乌苏里拟鲿(Pseudobagrus ussuriensis)的特定生长率和增重率与饱食组无显著差异[19], 80%饱食的大菱鲆(Scophthalmusmaximus)的生长率与饱食组无显著差异[20]。但过度降低投喂水平则会造成生长停滞, 例如摄食率0.5% (体重/日)组的鳚(Eleginops maclovinus)的体重体长均显著低于2% (体重/日)组[21], 摄食率2% (体重/日)组的虹鳟(Oncorhynchus mykiss)的体重和特定生长率均显著低于5% (体重/日)组[22]。在本实验中, 80AS组的增重率和末期体重与AS组无显著差异, 并显著高于50AS组, 说明在投喂水平降至80%饱食不会抑制黄颡鱼母本的生长。
本实验结束时HAS组的体重显著低于AS组而与80AS组无差异, 表明HAS组发生了补偿生长, 但补偿生长没有使黄颡鱼母本体重达到或超过同时期饱食组的水平。该现象原因可能是恢复摄食的时间过短, 实验结束时补偿生长尚未结束; 也可能是实验鱼补偿生长能力不足, 虽然有黄颡鱼补偿生长后重量超过正常投喂组的报道[23,24], 但是鱼类补偿生长的能力会随季节[25]和发育阶段[26]等因素变化; 还可能是亲鱼将更多的物质能量分配给繁殖过程, 进而导致生长抑制[14]; 需要对黄颡鱼母本发生不完全补偿生长的具体机制进行分析以优化基于补偿生长的投喂策略的效果。
3.2 投喂策略对黄颡鱼肌肉和性腺基本组分和血浆生化指标的影响
一般而言, 营养匮乏时亲鱼会动员体内物质维持性腺发育[27]。血浆甘油三酯和胆固醇是血脂的主要组成部分, 低密度脂蛋白能向外周组织转运脂质[28], Cardona等[29]和Chatzifotis等[30]认为繁殖期上述指标的上升是性腺发育促进体内脂质动员的结果。在本实验中, 除50AS组外三个组的血浆甘油三酯含量显著上升, AS组和80AS组胆固醇显著上升, HAS组的末期低密度脂蛋白显著大于中期, 这说明各组动员了体内脂肪以满足性腺的营养需求。各处理组的末期肌肉粗脂肪和粗蛋白随投喂水平呈现降低趋势, 而末期性腺粗脂肪和粗蛋白无显著差异, 类似的, Karlsen等[31]发现繁殖期饥饿的鳕(Gadus morhua)动员肝脏脂肪和肌肉蛋白质维持性腺发育, 在大西洋鲑(Salmo salar)[32]和河川沙塘鳢(Odontobutis potamophila)[33]中也有相似的现象,以上发现说明, 食物匮乏时亲鱼会将营养优先供给性腺以保证性腺发育。
3.3 投喂策略对黄颡鱼繁殖性能的影响
卵直径在一定程度上能够反应卵的质量[34], 在本实验中, 末期AS组和80AS组卵直径无显著差异,且显著大于50AS组, HAS组的卵直径最大, 这与尼罗罗非鱼(Oreochromis niloticus)[35]的情况类似, 表明恢复摄食对卵生长有补偿效应。据前期报道, 较低的投喂水平不一定会导致繁殖性能下降, 如摄食率0.75%(体重/日)组的小体鲟(Acipenser ruthenus)的卵孵化率和存活率高于摄食率1%组[36]; 同样的,低投喂组的齐氏罗非鱼(Tilapia zillii)的腺体比和卵直径与高投喂组无显著差异[37]。饥饿对繁殖的负面影响也可以在摄食后恢复, 如经历过饥饿的鳙(Aristichtys nobilis)在恢复摄食后相对繁殖力与正常投喂雌性无显著差异[38]。在本实验中, 80AS组、50AS组和HAS组的末期腺体比显著大于中期, 且均与AS组末期腺体比无差异。各处理组的末期绝对繁殖力和相对繁殖力也无显著差异。这说明不同程度限饲的投喂策略并未降低黄颡鱼母本的繁殖性能。
3.4 投喂策略对黄颡鱼性激素合成和分泌的影响
由垂体分泌的促性腺激素(Gonadotropin hormone, GtH)作用于性腺, 促进性激素的合成与分泌[39]。促卵泡激素(Follicle-stimulating hormone, FSH)和促黄体生成素(Luteinizing hormone, LH)是两种主要GtH, 二者以连续、协同的方式在卵子发生、卵母细胞发育和性激素分泌等过程中发挥调控作用[40,41]。在本实验中各处理组的血浆FSH和LH含量并未表现出随投喂水平变化的规律, 这与慈鲷(Cichlasoma dimerus)[42]、金鱼(Carassius auratus)[43]的情况一致, 表明本实验的投喂策略对黄颡鱼LH和FSH分泌影响较小。
性激素合成通路中相关因子和酶基因的表达能够反映合成速率[44]。合成过程始于类固醇急性调节蛋白(Steroidogenic acute regulatory protein,Star)将胆固醇转运进入线粒体, 同时伴随着胆固醇转化为孕烯醇酮, 这是通路中最慢的限速步骤[45];3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, 3β-hsd)直接参与雌二醇和睾酮合成的中间步骤[46]; Cyp19a1(又名芳香化酶, aromatase)催化睾酮向雌二醇的转化, 被认为性腺发育调控最关键的酶[47]。本实验80AS、50AS及HAS组的star、3βhsd和cyp19a1基因表达由中期的显著低于AS组上调至末期与AS组无显著差异, 表明三组的性激素合成能力随时间逐渐提升。类固醇生成因子-1(Steroidogenic factor 1, Sf-1)是性激素合成通路的主要调控因子之一, 能加强合成相关的酶基因转录[48]。本实验各组sf-1表达随时间和处理变化的趋势与以上基因一致, 印证了80AS、50AS及HAS组性激素合成能力的提升。
雌二醇(estradiol, E2)是调控卵巢发育最重要的性类固醇激素之一, 能够促进卵巢发育和卵黄蛋白原合成[39], 而睾酮(Testosterone, T)是雌性黄颡鱼合成E2的重要前体物质[49]。本实验80AS和50AS组中期血浆E2含量显著高于HAS组且低于AS组, 而末期各组间E2含量无显著差异, 与性激素合成基因表达的变化规律吻合。这表明虽然投喂策略在中期降低了除AS组外各处理的E2分泌, 但随着基因表达上调导致的合成能力增强, 末期时投喂策略对各组E2血浆含量已无影响。而E2和T血浆含量的变化与腺体比、性腺蛋白和脂肪的趋势一致, 说明投喂策略通过影响E2和T的含量对性腺发育进行调控。
研究者普遍认为, 低投喂水平或饥饿造成的应激对生殖有抑制作用[50], 在欧洲齿舌鲈(Dicentrarchus labrax)[51]、五条鰤(Seriola quinqueradiata)[52]和银鲑(Oncorhynchus kisutch)[53]等鱼的研究发现低投喂水平会降低雌鱼血浆E2含量, 进而产生卵母细胞生长减慢和卵泡闭锁等负面影响。此外, 应激激素被证明可以抑制繁殖相关调控通路, 如促肾上腺皮质激素分泌能使E2分泌量下降[54], 同时血浆皮质醇(Cortisol)含量上升导致cyp19a1[55]和雌激素受体基因[56]的表达下调。然而在本实验中, 80AS、50AS和HAS组的性激素合成、分泌及性腺发育仅在早期受到投喂策略的抑制, 在末期时相关指标已恢复至与AS组相同的水平, 这一现象可能与性腺的应激调控有关, 性腺可以通过增加11β羟基类固醇脱氢酶2活性(11β-hydroxysteroid dehydrogenase2,11β-HSD2)来降解皮质醇[57], 同时睾酮的大量分泌也可以削弱鱼体的应激响应[58], 可能是这些过程最终使80AS、50AS及HAS组的性激素合成能力和性腺发育水平与AS组相同。
4 结论
综上所述, 80AS组的各项生长和繁殖指标水平与AS组相近, 且摄食量显著低于AS组, 说明在达到与饱食投喂相同的生长和繁殖效果的情况下,80%饱食投喂策略可以减少饲料投入, 从而节省成本, 本研究认为80%饱食为繁殖期较为适宜黄颡鱼母本的投喂策略。HAS组虽然生长低于AS组, 但繁殖能力与AS组无差异且卵直径更大, 说明黄颡鱼饥饿后恢复摄食优先对繁殖力进行补偿, 故有必要按照黄颡鱼母本的生理特性对基于补偿生长的投喂策略进行重新设计, 以进一步提升黄颡鱼母本的繁殖力。
