基于网络药理学和分子对接探究地骨皮调血脂的作用机制
2023-03-10赵少磊朱艳茹丁浩强郑鑫杰张静泽刘岱琳
赵少磊,原 震,朱艳茹,丁浩强,郑鑫杰,张静泽,刘岱琳*
1.天津中医药大学,天津 301617
2.天津现代创新中药科技有限公司,天津 300384
近年来,脂质代谢异常已经成为仅次于高血压、吸烟的第3 大心血管疾病独立危险因素[1],高脂血症与心血管事件的发生密切相关。低密度脂蛋白胆固醇升高是心血管疾病尤其是冠状动脉粥样硬化性心血管疾病的重要危险因素,因此,调节血脂对于防治心血管疾病、降低心血管事件的发生具有重要意义。中药以其疗效确切、不良反应小以及多途径、多靶点的作用特点在调节血脂异常、防治高脂血症方面具有良好的前景。
地骨皮为茄科植物枸杞Lycium chinenseMill.或宁夏枸杞L.barbarumL.的干燥根皮。《本草纲目》中曾记载“春采枸杞叶,名天精草;夏采花,名长生花;秋采子,名枸杞子;冬采根,名地骨皮”。果实枸杞为药食同源的常用中药材,始载于《神农本草经》,具有可滋补肝肾、益精明目的功效,用于治疗虚劳精亏、腰膝酸痛、眩晕耳鸣、阳痿遗精、内热消渴、血虚萎黄、目昏不明等症[2]。枸杞的根皮名为地骨皮,可凉血除蒸、清肺降火,用于治疗阴虚潮热、骨蒸盗汗、肺热咳嗽、咯血、衄血、内热消渴等症[3]。现代药理学研究发现,地骨皮具有降血压、调血脂、降血糖、抗骨质疏松、抗炎等多种作用[4]。研究发现,地骨皮中的蒽醌类成分能够降低高脂血症大鼠总胆固醇、三酰甘油和低密度脂蛋白胆固醇水平,增加胆汁酸的外排,从而发挥调血脂作用[5-6]。地骨皮含有环肽类、黄酮、蒽醌、生物碱、多糖等多种活性成分,但是其调血脂活性成分及作用机制研究报道相对较少。因此,本研究借助网络药理学方法[7],通过基因、靶蛋白、疾病以及药物等数据库,结合系统生物学、多向药理学以及计算机生物学分析并构建地骨皮调血脂的潜在活性成分、靶点、疾病以及通路相互作用网络,并通过分子对接和细胞实验进一步验证,为揭示地骨皮的调血脂机制提供参考。
1 材料
1.1 细胞
人肝癌HepG2 细胞由武警后勤学院军事药学教研室提供,人结肠腺癌Caco-2 细胞购自普诺赛生命科技有限公司。
1.2 药品与试剂
β-谷甾醇(批号MUST1310515)、大黄素(批号 MUST13022715)、 金合欢素(批号MUST1305235)、蒙花苷(批号MUST1320153)购自成都曼思特生物科技有限公司,质量分数均大于98%;脂多糖(lipopolysaccharide,LPS,批号059M4031V)购自美国Sigma 公司;胎牛血清(批号12B031)购自Excell Bio 公司;青霉素-链霉素(批号 WH1021A161)、 胰蛋白酶(批号WH2122Z111)、DMEM 培养基(批号WH0022Z121)购自普诺赛生命科技有限公司;油酸(批号C13292586)购自麦克林生化科技有限公司;辛伐他汀(批号L2103127)购自阿拉丁生化试剂有限公司;腺苷三磷酸结合盒转运蛋白 A1(ATP binding cassette transport protein A1,ABCA1)抗体(批号27U4953)、β-actin 抗体(批号12W2944)购自Affinity 公司;HRP 标记的山羊抗兔IgG 抗体(批号CR2108180)购自赛维尔生物科技有限公司;油红O 染色试剂盒(批号20220704)、CCK-8 检测试剂盒(批号316R012)、BCA 蛋白检测试剂盒(批号20220705)购自索莱宝科技有限公司;增强化学发光试剂盒(批号AK060P081896)购自伊莱瑞特生物科技股份有限公司。
1.3 仪器
Thermo 371 型CO2培养箱、Thermo-R 型离心机、1300SA2 型生物安全柜、Multiskan GO1510 型酶标仪(美国Thermo Fisher Scientific 公司);Dmi1型倒置生物显微镜(德国Leica 公司);AI680RGB型凝胶成像仪(美国GE 公司)。
2 方法
2.1 分子网络构建
2.1.1 地骨皮化学成分及对应靶点的筛选 在TCMSP(https://old.tcmsp-e.com/tcmsp.php)数据库以“地骨皮”为关键词检索化学成分,将地骨皮按照吸收、分布、代谢、排泄(absorption,distribution,metabolism,excretion,ADME)过程筛选潜在活性成分,以口服利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18 为条件建立相应的综合模型收集相应的化学成分及其对应的靶点蛋白。同时通过查阅相关文献[26]补充活性成分以构建地骨皮活性成分数据库。运用PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库下载化合物的2D 结构,导入到SwissTargetPrediction(http://www.swisstargetprediction.ch/)数据库,设置属性为“Homo sapiens”,点击“Predict Targets”,预测相应的靶点,去除可能性为零的相关靶点,并将数据合并去重。
2.1.2 高脂血症疾病靶点数据库的构建 以“hyperlipidemia”为关键词在GeneCards(https://www.genecards.org/)和OMIM(https://www.omim.org/)数据库中对相关的疾病靶点进行检索,之后进行数据合并及去重以构建高脂血症疾病靶点数据库。
2.1.3 活性成分和疾病共同靶点的筛选 通过Uniprot(https://www.uniprot.org/)数据库将物种设定为Human,确定靶点蛋白的基因名称,随后利用Venny 2.1 对地骨皮中的活性成分和疾病的靶点取交集,得到活性成分和疾病的交集靶点。
2.1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建 为明确地骨皮活性成分相关蛋白与疾病靶点的相关作用,获取地骨皮调血脂的潜在作用靶点,将交集靶点导入到String(https://string-db.org/)数据库[8]中,构建PPI网络模型。将生物物种设定为“Homo spaiens”,将置信度设置为最高置信度“highest confidence(0.9)”,其余设置均为默认,获取PPI关键靶点。将结果进一步导入Cytoscape 3.8.2 软件中进行可视化处理,设置参数使节点大小和颜色深浅反映度值的大小,边的粗细反映结合率评分的高低,构建PPI网络图。
2.1.5 地骨皮活性成分-靶点-疾病网络图的构建将筛选出的活性成分靶点以及疾病靶点输入到Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)中得到交集韦恩图[9]。结合Cytoscape 3.8.2 软件构建活性成分-靶点-疾病网络图以及网络拓朴学分析。
2.1.6 基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 将地骨皮与调血脂的核心作用靶点录入 Metascape(http://metascape.org/)数据库进行分析,物种设置“Homo sapiens”,设置阈值“P<0.01”,进行GO 功能及KEGG 通路富集分析,分析其主要的生物学过程与相关通路,之后运用Cytoscape 3.8.2 软件进行成分-靶点-通路网络图的构建以及可视化处理。
2.1.7 分子对接 为了更好地阐述地骨皮发挥调血脂作用的潜在靶点和对应活性成分之间的结合活性,根据上述筛选出的活性成分和核心靶点,结合临床药理实验及大量调血脂相关文献报道,选取过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)通路中的2 个靶点作为研究对象,利用ChemBioDraw Ultra 软件绘制筛选得到的14 个单体化合物的结构,并用Chem 3D 软件获取所有单体化合物3D 格式的结构式。在RCSB PDB 数据库中下载关键蛋白靶点PPARα 和PPARγ的配体,尽量选择分辨率高、有配体、结构相对完整的晶体结构,并下载PDB 格式文件。应用SYBYLX 2.0 软件对化合物和蛋白靶点进行分子对接,并利用其自带的打分函数对对接结果进行模拟筛选,获得总得分值,总得分≥5 表明受体和配体亲和力较大。之后利用Discovery Studio 2019 Client 软件对结果进行可视化处理。
2.2 细胞实验
2.2.1 HepG2 细胞和Caco-2 细胞培养 HepG2 细胞用含10%胎牛血清、1%青霉素-链霉素的DMEM培养基,于37 ℃、5% CO2的恒温培养箱中培养。Caco-2 细胞用含20%胎牛血清、1%青霉素-链霉素的DMEM 培养基,于37 ℃、5% CO2的恒温培养箱中培养。每隔2 d 更换1 次培养液,当细胞融合度为80%时用胰蛋白酶消化传代。
2.2.2 细胞活力测定 分别精密称取β-谷甾醇、蒙花苷、大黄素和金合欢素适量,用二甲基亚砜(dimethyl sulfoxide,DMSO)溶液完全溶解,配制成浓度为0.01 mol/L 的各样品药液,使用时用含10%胎牛血清的DMEM 完全培养基稀释成不同浓度。HepG2 细胞以1×104个/孔接种于96 孔板中,培养24 h 后,与500 μmol/L 油酸和20 μmol/L 辛伐他汀以及不同浓度(0、25、50、100、200 μmol/L)β-谷甾醇、蒙花苷、大黄素和金合欢素分别培养24 h,另设置空白孔(不含细胞),每孔加入10 μL CCK-8 试剂,孵育2 h,使用酶标仪于450 nm 处测定吸光度(A)值,计算细胞存活率,并筛选出最适药物浓度。
Caco-2 细胞以1×104个/孔接种于96 孔板中,培养24 h 后,与不同浓度(0、25、50、100、200 μmol/L)蒙花苷和大黄素分别培养24 h 后,每孔加入10 μL CCK-8 试剂,孵育2 h,使用酶标仪于450 nm 处测定A值,计算细胞存活率,并筛选出最适药物浓度。
细胞存活率=(A给药-A空白)/(A对照-A空白)
2.2.3 油红O 染色 HepG2 细胞以2×104个/孔接种于96 孔,培养24 h 后,设置对照组、模型组、辛伐他汀(20 μmol/L)组、β-谷甾醇(100 μmol/L)组、蒙花苷(100 μmol/L)组、大黄素(50 μmol/L)组和金合欢素(100 μmol/L)组。除对照组外,其余各组加入500 μmol/L 油酸,各给药组另加入相应药物培养24 h 后,根据油红O 染色试剂盒说明书进行染色,蒸馏水清洗3 次,于显微镜下观察细胞脂滴,采用Image J 6.0 软件分析细胞脂滴含量。
2.2.4 Western blotting 分析 Caco-2 细胞以5×104个/孔接种于6 孔板中,培养24 h 后,设置对照组(以不含胎牛血清的培养基培养)、模型组(以含20%胎牛血清的培养基培养)、蒙花苷组(以含100 μmol/L 蒙花苷的培养基培养)和大黄素组(以含50 μmol/L 大黄素的培养基培养),加入药物培养24 h后用高效RIPA 组织/细胞快速裂解液提取细胞总蛋白,并使用BCA 蛋白检测试剂盒进行定量。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入脱脂牛奶,室温封闭2 h,分别加入ABCA1 抗体(1∶500)和β-actin 抗体(1∶1000),4 ℃孵育过夜;TBST 洗涤3 次,每次10 min,加入二抗,室温孵育2 h;TBST 洗涤3 次,每次10 min,使用增强化学发光试剂盒检测蛋白条带,采用Image J 6.0 软件分析条带灰度值。
2.2.5 统计学分析 采用Image J 6.0 和GraphPad Prism 8.0 软件进行统计学分析,实验数据均以±s表示。对数据进行单因素方差分析,并使用检验进行组间比较。
3 结果
3.1 地骨皮活性成分的筛选
通过TCMSP 数据库查找,得到地骨皮有效成分37 个,根据OB≥30%和DL≥0.18 进行筛选,同时查阅相关文献,最终获得地骨皮中调血脂的潜在活性成分14 个(表1)。

表1 地骨皮的潜在活性成分Table 1 Potential active components of Lycii Cortex
3.2 成分靶点、疾病靶点以及交集靶点的筛选
将TCMSP 和SwissTargetPrediction 数据库得到的活性成分靶点合并去重后共得到393 个活性成分靶点,依据GeneCards 和OMIM 数据库中对相关的疾病靶点检索结果,进行数据合并及去重后得到1486 个靶点,之后将筛选出的成分靶点和疾病靶点输入Venny 2.1 取交集(图1),得到153 个交集靶点,作为药物作用于疾病的预测靶点。
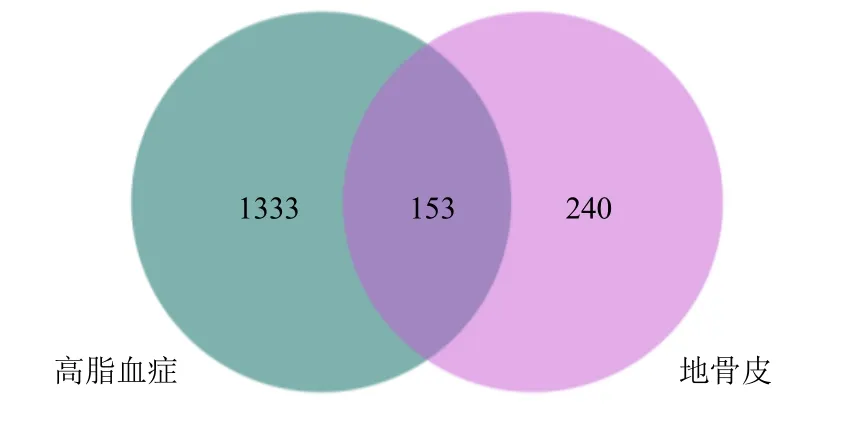
图1 地骨皮成分靶点与疾病靶点的Venn 图Fig.1 Venn diagram of component targets and disease targets of Lycii Cortex
3.3 PPI 网络的构建
将得到的153 个药物和疾病交集靶点导入到String 数据库中,设置相互作用得分为最高0.9,剔除未参与蛋白互作的靶点,从而得到PPI网络。将得到的数据导入到Cytoscape 3.8.2 软件中进行进一步处理和分析见图2,活性成分和靶点均以节点表示,相互关系则以边表示。
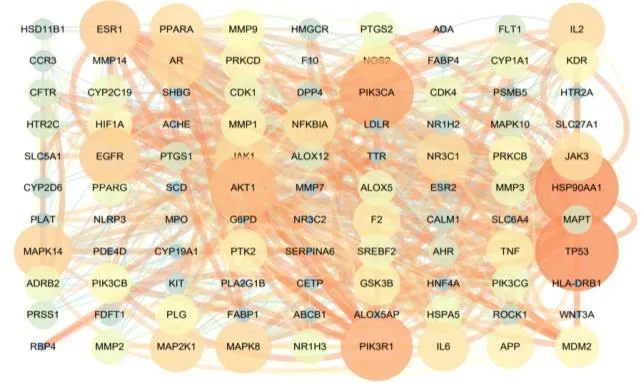
图2 活性成分与疾病交集靶点的PPI 网络Fig.2 PPI network of intersection targets of active ingredient and disease
3.4 成分-靶点-疾病网络的构建
将活性成分和疾病靶点筛选得到的交集靶点导入到Cytoscape 3.8.2 软件中,构建成分-交集靶点-疾病网络(图3),活性成分、靶点以及疾病均以节点表示,相互关系则以边表示。之后进行拓扑学分析,以度值反映节点的重要程度,度值越大则表示其在该网络中越重要。地骨皮中筛选的14 个成分中主要的活性成分为苦楝萜酮内酯、莨菪碱、金色酰胺醇酯、醋酸芳樟酯、β-谷甾醇、大黄素、金合欢素等。
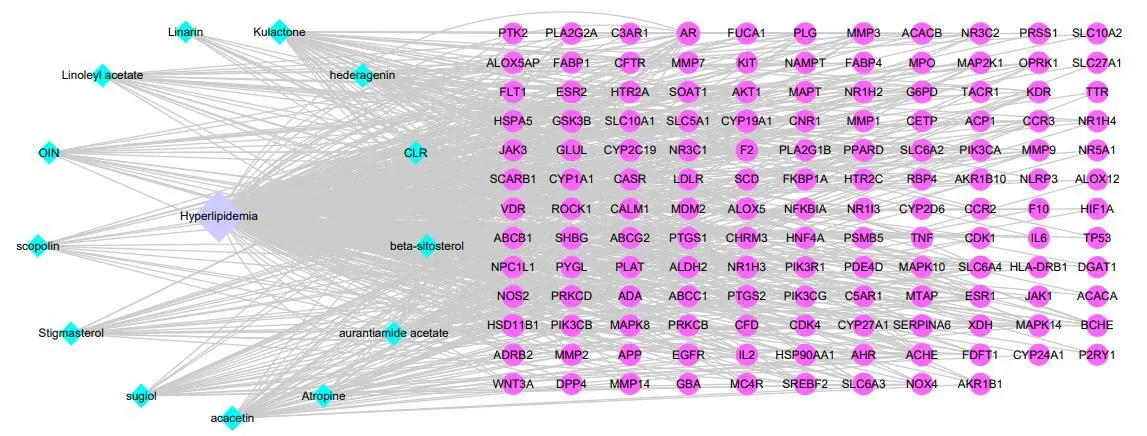
图3 活性成分-靶点-疾病网络Fig.3 Active ingredient-target-disease target network
3.5 GO 功能和KEGG 通路富集分析
将地骨皮调血脂作用交集靶点导入到Metascape 数据库中进行GO 功能富集分析(P<0.5),主要包括生物过程、细胞组分和分子功能分析。如图4所示,这些成分发挥作用的生物过程主要涉及细胞脂质反应、脂质代谢过程的正调控、脂质定位、脂质定位的调节以及蛋白质磷酸化的正调控等过程;分子功能主要是包括脂质结合、丝氨酸型肽酶活性、酰胺结合、激酶结合、氧化还原酶活性、脂肪酸的结合和酪氨酸激酶活性;在细胞成分层面主要作用在细胞膜、细胞膜顶端以及细胞质核周围。进一步进行KEGG 通路富集分析,并根据P值的大小和富集基因数目筛选,如图5所示,主要涉及脂质和动脉粥样硬化、脂肪消化吸收、胆汁分泌等过程,以及AMP 激活的蛋白激酶(AMPactivated protein kinase,AMPK)、PPAR 等信号通路。其中气泡的颜色代表富集显著性,颜色越红,代表富集度越高;而气泡的大小代表该通路上基因富集的数量,气泡越大代表富集的基因数目越多。
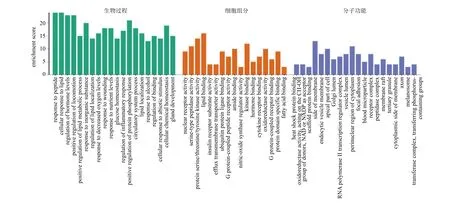
图4 GO 功能富集分析Fig.4 GO function enrichment analysis

图5 KEGG 通路富集分析Fig.5 KEGG pathway enrichment analysis
3.6 活性成分-靶点-通路网络图的构建
根据KEGG 通路富集分析从而构建地骨皮化学成分-靶点-通路网络(图6),节点的大小既反映度值大小,也反映各成分与靶点以及靶点与通路之间的关系,节点越大表示其关联程度越高。地骨皮中筛选出的活性成分通过作用在脂质和动脉粥样硬化、胰岛素抵抗、脂肪消化吸收、胆汁分泌、AMPK、PPAR 等信号通路上的清道夫受体B1(scavenger receptor B1,SCARB1)、PPARα、PPARγ、糖原合酶激酶-3β(glycogen synthasc kinase-3β,GSK-3β)等蛋白靶点相互协同作用,从而发挥调血脂作用。

图6 地骨皮活性成分-靶点-通路网络Fig.6 Active ingredient-target-pathway network in Lycii Cortex
3.7 分子对接
将地骨皮中筛选出的14 个单体化合物与PPAR信号通路上的靶点蛋白PPARα 和PPARγ 进行分子对接,总得分≥5 表明受体和配体亲和力较大,对接越好。各配体分子和受体蛋白的分子对接得分结果见表2,可以看出莨宕碱、金合欢素、蒙花苷、阿托品、枸杞酰胺、β-谷甾醇以及大黄素得分均大于5,说明这些化合物与PPAR 信号通路上的PPARα以及PPARγ 靶蛋白均表现出良好的结合作用。分子对接筛选出的关键活性成分莨宕碱、金合欢素、蒙花苷、阿托品、枸杞酰胺、β-谷甾醇以及大黄素与靶蛋白PPARα 和PPARγ 分子对接模型见图7、8。

图7 关键活性成分与靶点蛋白PPARα 对接模型图Fig.7 Docking model of key components and target PPARα
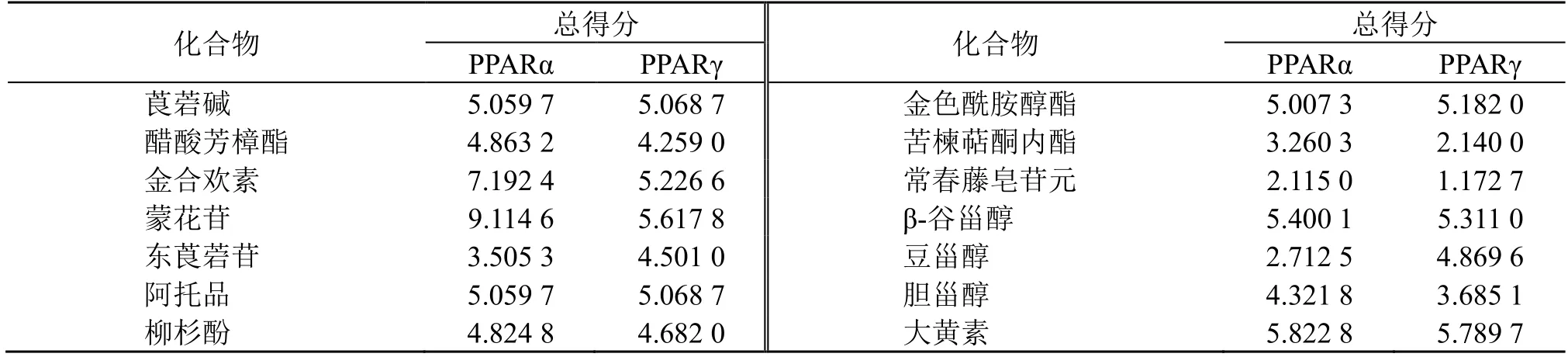
表2 地骨皮活性成分与靶蛋白分子对接结果Table 2 Docking of core active ingredients of Lycii Cortex to key targets

图8 关键活性成分与靶点蛋白PPARγ 对接模型图Fig.8 Docking model of key components and target PPARγ
3.8 β-谷甾醇、蒙花苷、大黄素和金合欢素对HepG2 细胞活力的影响
经过对比上述分子对接的结果,发现β-谷甾醇、蒙花苷、大黄素以及金合欢素的得分结果要明显高于其他成分的得分,说明这4 个化合物与靶蛋白结合作用更好,可能是潜在的关键活性成分,因此选择β-谷甾醇、蒙花苷、大黄素以及金合欢素进行HepG2 细胞调血脂活性筛选。采用CCK-8 法考察不同浓度的β-谷甾醇、蒙花苷、大黄素和金合欢素对HepG2 细胞活力的影响,如图9-A所示,与对照组比较,油酸组和辛伐他汀组对细胞无毒性,因此选取500 μmol/L 油酸作为造模浓度,20 μmol/L 辛伐他汀作为阳性药浓度;β-谷甾醇、蒙花苷和金合欢素在0~100 μmol/L 对细胞无明显毒性作用,浓度为200 μmol/L 时,细胞活力下降,因此选择100 μmol/L 作为给药浓度;大黄素在0~50 μmol/L 对细胞无明显毒性作用,浓度为100 μmol/L 时,细胞活力下降,因此选择50 μmol/L 作为大黄素给药浓度。
3.9 β-谷甾醇、蒙花苷、大黄素和金合欢素对油酸诱导的HepG2 细胞中脂滴含量的影响
如图9-B所示,对照组HepG2 细胞中未出现明显脂滴,500 μmol/L 油酸诱导的模型组细胞中出现大量脂滴(P<0.01),说明造模成功。与模型组比较,辛伐他汀组、β-谷甾醇组、蒙花苷组、大黄素组脂滴均明显减少(P<0.05、0.01),而金合欢素组效果并不显著。
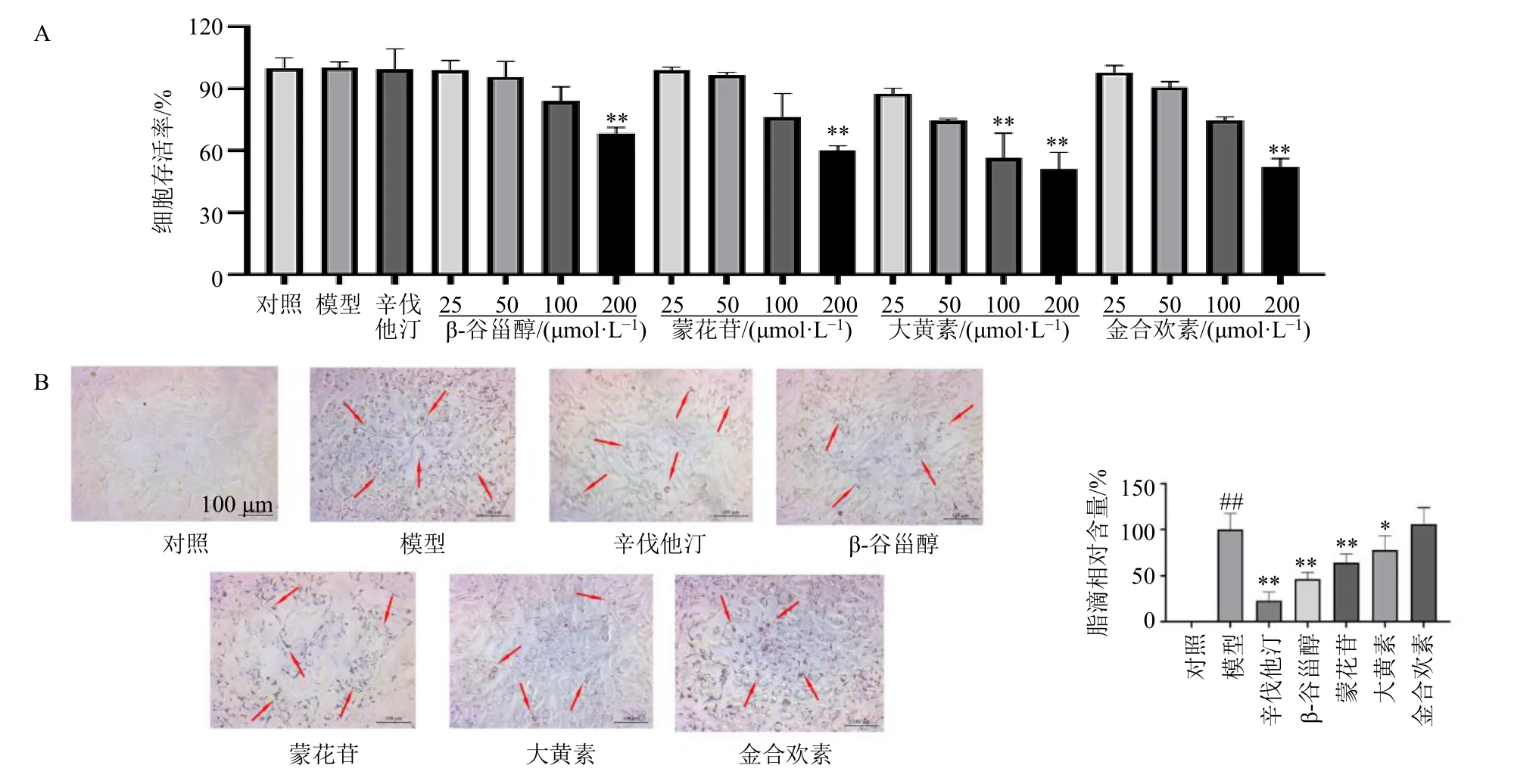
图9 β-谷甾醇、蒙花苷、大黄素和金合欢素对HepG2 细胞活力(A)以及对油酸诱导的HepG2 细胞脂质积累(B)的影响(±s,n = 3)Fig.9 Effects of β-sitosterol,linarin,emodin and acacetin on viability of HepG2 cells(A)and lipid accumulation(B)in HepG2 cells induced by oleic acid(±s,n = 3)
3.10 蒙花苷与大黄素对 Caco-2 细胞活力和ABCA1 蛋白表达的影响
根据HepG2 细胞调血脂活性筛选结果表明,蒙花苷、β-谷甾醇以及大黄素的作用效果较为显著,而金合欢素并无显示显著效果;同时β-谷甾醇在多种药材中均存在,其特征代表性较弱,分子对接得分结果也显示蒙花苷和大黄素与靶蛋白PPARα 和PPARγ 的结合能力远强于β-谷甾醇,因此主要考察蒙花苷和大黄素对下游蛋白ABCA1 表达的影响,进而评价其调血脂作用。
采用CCK-8 法考察蒙花苷及大黄素对Caco-2细胞活力的影响,如图10-A所示,与对照组比较,蒙花苷在0~100 μmol/L 对细胞无毒性作用,浓度为200 μmol/L 时,细胞活力下降,所以选择100 μmol/L 作为给药浓度;大黄素在0~50 μmol/L 对细胞无毒性作用,浓度为100 μmol/L 时,细胞活力下降,所以选择50 μmol/L 作为给药浓度。

图10 蒙花苷和大黄素对Caco-2 细胞活力(A)以及ABCA1 蛋白表达(B)的影响(±s,n = 3)Fig.10 Effects of linarin and emodin on viability of Caco-2 cells(A)and ABCA1 protein expression(B)(±s,n = 3)
ABCA1 是一种完整的细胞膜蛋白,能够通过与载脂蛋白受体相互作用,从而影响高密度脂蛋白胆固醇的生物合成[10],是影响胆固醇外流的关键调节因子[11]。血脂的升高与胆固醇的逆向转运有着十分紧密的联系,ABCA1 是介导肝脏中胆固醇输出的关键蛋白,PPARγ/肝X 受体α(liver X receptor α,LXRα)/ABCA1 是一条经典的脂质代谢通路,PPARγ蛋白表达的升高可以激活下游相关蛋白如ABCA1的表达升高,从而促进胆固醇以及脂质的代谢。如图10-B所示,与对照组比较,模型组细胞中ABCA1蛋白表达水平显著降低(P<0.01),表明模型组细胞胆固醇外流显著降低,增加了细胞内的脂质蓄积。与模型组比较,给予蒙花苷(100 μmol/L)与大黄素(50 μmol/L)处理均有效地升高了ABCA1 蛋白的表达水平(P<0.05、0.01),表明蒙花苷与大黄素可通过升高ABCA1 蛋白的表达促进细胞内胆固醇外流,减少细胞内的脂质蓄积,发挥调血脂作用。
4 讨论
血脂异常是指成人血浆总胆固醇、三酰甘油、低密度脂蛋白胆固醇升高和高密度脂蛋白胆固醇降低为特征的疾病[12]。血脂升高可引发外周血管疾病、动脉粥样硬化、冠心病、胰腺炎等[13]。大量研究结果表明,总胆固醇或低密度脂蛋白胆固醇水平升高在动脉粥样硬化的发生和发展过程中发挥着重要的作用,与人群中冠心病的发病率和病死率呈显著正相关[14]。中医古籍中无确切高脂血症病名,《灵枢·五窿津液别》最早出现了有关“膏”的记载:“五谷之津液,和合而为膏者,内渗于骨空,补益脑髓,而下流于阴股”,为后世医家有关血脂异常的论述提供了思路。根据其临床表现可归属为“痰湿”“痰浊”“眩晕”“瘀血”等证。我国传统医学治疗血脂异常有着悠久历史。《灵枢·逆顺肥瘦》曰:“血浊气涩,疾泻之,则经可通也。”古人认为,浊之在血脉,须以清化通利之泻法除去血中之浊物,方可脉通气顺。地骨皮性凉,归肺、肝、肾经,具有清热凉血的功效,可以通过清化通利之法调节血脂。
本研究根据网络药理学和检索相关文献,共筛选出莨菪碱、醋酸芳樟酯、金合欢素、蒙花苷、东莨菪苷、阿托品、柳杉酚、金色酰胺醇酯、苦楝萜酮内酯、常春藤皂苷元、β-谷甾醇、豆甾醇、胆甾醇和大黄素14 个潜在活性成分,得到成分对应的393个靶点和1486 个疾病靶点。将活性成分靶点与疾病靶点取交集,得到153 个共有靶点。GO 功能分析显示地骨皮的活性成分发挥调血脂作用主要涉及细胞脂质反应、脂质代谢过程的正调控以及蛋白质磷酸化的正调控等过程,这些成分可能是通过作用在细胞膜、细胞膜顶端以及细胞质核周围,从而影响脂质结合、氧化还原酶活性、脂肪酸的结合和酪氨酸激酶活性等分子功能。KEGG 通路分析发现主要涉及脂质和动脉粥样硬化、胰岛素抵抗、脂肪消化吸收、胆汁分泌、AMPK、PPAR 等信号通路。胰岛素抵抗容易导致代谢综合征、2 型糖尿病以及肥胖等症状,可引起血管内皮功能障碍、血脂异常、高血压和血管炎症等[15]。研究发现,地骨皮水提物可以显著降低2 型糖尿病大鼠的空腹血糖,改善血脂异常和肝脏病理变化,可能是通过作用于AMPK信号通路上调葡萄糖转运子4(glucose transporter 4,GLUT4)和PPARα 蛋白表达水平,下调GSK-3β 蛋白表达来改善胰岛素抵抗[16]。胰岛素抵抗发生的主要原因是炎性细胞因子的升高,从而干扰胰岛素信号转导中胰岛素抵抗的正常磷酸化,进一步阻断下游信号激活的一系列级联放大反应,从而影响胰岛素的生成、转运等生理功能,引起胰岛素抵抗,目前研究较多的炎性细胞因子引起胰岛素抵抗的信号转导通路主要是与AMPK、GSK-3β、蛋白酪氨酸磷酸酶-1B(protein tyrosine phosphatase-1B,PTP-1B)、c-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)以及核因子-κB(nuclear factor-κB,NF-κB)等信号转导通路有关[17]。大黄素能够降低KKAγ 小鼠空腹血糖、总胆固醇、三酰甘油等,还能减少炎症反应,能够上调KKAγ 小鼠骨骼肌和脂肪组织PPARγ及GLUT4的mRNA 和蛋白表达水平,从而促进骨骼肌和脂肪组织对体内葡萄糖的摄取,改善胰岛素抵抗[18]。microRNA-192 与脂肪代谢有关,miR-192 表达的激活以及甾醇调节元件结合转录因子1(sterol regulatory element binding transcription factor 1,SREBF1)、PPARγ 表达的下调能够促进猪卵母细胞的脂质代谢[19]。PPAR 信号通路是发挥调血脂作用的一条重要途径,PPAR 信号通路上的蛋白如PPARα、PPARγ 等能够影响脂肪吸收、脂肪代谢、脂质合成等一系列的代谢相关重要环节[20]。同时PPARγ 作为核受体,可以通过降低游离脂肪酸水平调节脂质代谢紊乱,还可以通过调节脂肪因子分泌,促进机体对葡萄糖的利用,进一步改善胰岛素抵抗[21]。AMPK 信号通路被激活后,下游通路与脂质合成相关的基因和蛋白的表达水平下调,同时能导致ACC 磷酸化水平提高,从而抑制脂质生成,达到调节脂肪代谢的作用[22]。
PPARα 具有多效性,能够参与脂肪酸代谢、胆固醇代谢等过程,可以调节高密度脂蛋白胆固醇、载脂蛋白ApoI和ApoII,减少肝合成和释放低密度脂蛋白胆固醇,调节血脂。激活的PPARα 可以促进脂蛋白脂肪酶合成,催化脂蛋白中的三酰甘油脂解成为游离脂肪酸,调节脂质代谢[23]。PPARγ 有广泛的生物学效应,在脂肪细胞分化调控、机体糖脂代谢平衡的调节、胰岛素敏感性增强等方面均发挥重要的作用[24]。分子对接结果显示,地骨皮的调血脂潜在有效成分莨宕碱、金合欢素、蒙花苷、阿托品、金色酰胺醇酯、β-谷甾醇以及大黄素与靶蛋白PPARα 和PPARγ 的对接总得分均≥5,说明地骨皮核心潜在活性成分与关键靶点分子生物结合亲和力高,具有较好的药效活性。经过对比发现金合欢素、蒙花苷、β-谷甾醇以及大黄素的得分结果要明显高于莨宕碱、阿托品和金色酰胺醇酯的得分,说明这4 个化合物的结合能力更强,药效活性可能更好。推测地骨皮中可能主要是金合欢素、蒙花苷、β-谷甾醇以及大黄素等潜在活性成分通过作用关键靶蛋白PPARα 和PPARγ 等,调控PPAR、AMPK、胰岛素抵抗、脂质代谢等信号通路起到调血脂的作用。
根据文献报道,金合欢素和蒙花苷属于黄酮类化合物,这类成分能够改善血管的通透性及脆性,调节血脂和胆固醇[25]。席梅等[26]对金合欢素的调血脂和抗动脉粥样硬化作用进行研究,发现金合欢素能使HepG2 细胞中低密度脂蛋白受体mRNA 和蛋白的水平显著升高,降低小鼠血清中的总胆固醇和低密度脂蛋白胆固醇的水平,具有调血脂的效果。β-谷甾醇是植物甾醇类成分,是中药发挥调血脂的活性成分之一,可以通过抑制肠道中胆固醇的吸收、降低血清总胆固醇或低密度脂蛋白胆固醇来改善血脂异常[27]。张帆[28]研究发现β-谷甾醇等6 种植物甾醇能显著降低Caco-2 对胆固醇的吸收,发挥调血脂作用。地骨皮中的蒽醌类成分也具有一定的调血脂作用[5-6]。韩伟等[29]对高脂血症模型鹌鹑连续ig 大黄素8 周,发现大黄素能显著降低血清总胆固醇、三酰甘油、低密度脂蛋白胆固醇、丙二醛以及脂质过氧化物的含量,具有显著的调血脂作用。莨菪碱和阿托品是莨菪烷类生物碱,这类成分能明显改善微循环和组织的缺血、缺氧状态,改善血液流变、稳定细胞膜、改善心功能和兴奋中枢神经系统等[30],金色酰胺醇酯具有一定的抗炎活性[31],而关于这几种成分调血脂方面研究还有待进一步深入。同时根据分子对接结果显示金合欢素、蒙花苷、β-谷甾醇以及大黄素的调血脂作用可能更为显著,因此选择将金合欢素、蒙花苷、β-谷甾醇以及大黄素作用于HepG2 细胞,进行体外调血脂活性筛选。结果显示蒙花苷、β-谷甾醇以及大黄素对细胞脂质蓄积具有一定的抑制作用,可能是发挥调血脂作用的关键活性成分,而金合欢素对HepG2 细胞脂质的蓄积并无显著效果。可能是由于金合欢素与PPARα 和PPARγ等靶蛋白结合后影响了其他调血脂有关的通路发挥作用,并未对细胞中脂质蓄积产生影响[26]。
肝脏中ABCA1 的过表达可以促进胆固醇的外排,导致肝细胞中的脂质积累减少以及高密度脂蛋白胆固醇水平的升高,从而发挥一定的调血脂作用[32]。Western blotting 实验结果显示,蒙花苷和大黄素给药后显著升高了ABCA1 蛋白表达水平,从而促进了细胞中胆固醇的外流以及脂质的代谢,发挥调血脂作用。本研究通过网络药理学、分子对接以及细胞实验探究发现地骨皮中的蒙花苷、大黄素以及β-谷甾醇等活性成分可能是通过作用于PPARα、PPARγ 等多个靶点,进而影响PPAR、AMPK、胰岛素抵抗、脂质代谢等信号通路上与调血脂有关的蛋白表达,改善和影响细胞内胆固醇的外流以及脂质积累,发挥调血脂作用。因此地骨皮可能是通过多成分、多靶点、多通路来实现调血脂作用。
利益冲突所有作者均声明不存在利益冲突
