两种宫腔镜手术方式切除多发性子宫内膜息肉的疗效比较
2023-03-09韩姣姣柳吉羱齐小雪
张 立, 陈 妍, 韩姣姣, 柳吉羱, 齐小雪
子宫内膜息肉是妇科常见病,是由子宫内膜局部过度增生所致,表现为突出于子宫腔内的单个或多个光滑肿物,蒂长短不一。子宫内膜息肉的高发人群为从育龄期到绝经后的女性,我国女性群体中子宫内膜息肉的发病率为24%~25%,临床上可引起不规则阴道流血、不孕,其中不孕患者中子宫内膜息肉的发病率可达34.9%[1]。绝大多数研究表明,子宫内膜息肉的发生与内膜局灶的雌孕激素受体表达失衡、基因表达异常、炎症介质失衡等相关[2]。宫腔镜是诊断子宫内膜息肉的金标准[3],宫腔镜下息肉摘除术是子宫内膜息肉首选的治疗方法[4],但多发性息肉极易复发[5-6]。目前临床上有传统的宫腔镜电切术使用环形电极切除息肉,也有冷刀宫腔镜系统使用配备的非能量器械进行手术[7]。因考虑到应用传统的电手术器械时,组织温度迅速超过300 ℃,产生热效应损伤周围组织,可能对术后组织器官功能产生影响[8],不利于对育龄期患者生育能力的保护,近年来宫腔镜冷刀手术在临床越来越广泛应用。相较于传统电刀,冷刀使用剪刀、抓钳等进行操作,无能量、热辐射所带来的损伤,对内膜损害小,同时降低了患者术后不适感。目前关于宫腔镜冷刀切除术和宫腔镜电切术切除子宫内膜息肉疗效比较的研究报道较少,故本研究旨在对比分析两种宫腔镜手术方式切除多发性子宫内膜息肉的疗效及妊娠结局。
1 资料与方法
1.1一般资料 回顾性分析我院于2020年12月至2021年12月期间收治的、有生育需求且患有多发性子宫内膜息肉的246例患者的临床资料。纳入标准:(1)育龄期女性,行宫腔镜下息肉切除术;(2)术中见息肉呈多发;(3)手术后病理诊断证实为子宫内膜息肉;(4)术后1年内有生育要求,术后1个月后未避孕,患者未绝经。排除标准:(1)病理结果证实合并其他病变,如子宫黏膜下肌瘤、子宫内膜不典型增生等;(2)合并恶性肿瘤疾病者;(3)术后1年内再次手术切除子宫者;(4)恶病质、肥胖等体重指数(body mass index,BMI)异常状态者(BMI<18.5 kg/m2或>24 kg/m2);(5)术后1年内不适宜妊娠者。其中145例行宫腔镜下电切术(电切组),101例行宫腔镜下冷刀切除术(冷刀组)。电切组年龄28~48(33.56±3.67)岁,BMI为(22.74±2.47) kg/m2;冷刀组年龄23~50(32.78±3.99)岁,BMI为(22.21±3.76) kg/m2。两组年龄、BMI比较差异无统计学意义(P>0.05),具有可比性。本研究获医院医学伦理委员会批准(批号2021KT013),所有患者知情同意。
1.2手术方法 术前行常规检查,包括血、尿常规,凝血功能、白带常规、肝肾功能、血糖、电解质等。(1)电切组:术前海藻棒机械性扩张宫颈。术中采用5%葡萄糖溶液膨宫,膨宫压力80~100 mmHg。手术开始先探查宫腔深度,依次扩宫至9.5~10号。置镜后,利用环状单极电极依次切除所有可见的息肉。(2)冷刀组:术前海藻棒机械性扩张宫颈。术中采用生理盐水膨宫,膨宫压力80~100 mmHg。手术开始先探查宫腔深度,依次扩宫至9.5~10号。置镜后,用抓钳钳夹息肉蒂根部,旋转摘除息肉。再次观察息肉根部,若仍有残留,利用剪刀剪除残留的根部。两组手术均由我科有相应资质的高年资医师实施。
1.3观察指标 病历记录中的手术时间、术中出血量、术后阴道流血时间、住院时间。
1.4随访 于术后1个月、3个月、6个月及1年通过门诊、电话等方式进行随访。随访内容包括:(1)并发症:包括术中子宫穿孔、术后1个月内盆腔感染、术后闭经等。(2)息肉复发:随访期间因异常子宫出血或超声发现宫腔异常回声,再次行宫腔镜检查证实为子宫内膜息肉。(3)妊娠情况:手术1个月后可开始性生活,观察宫内妊娠情况。

2 结果
2.1两组手术时间、术后阴道流血时间比较 冷刀组手术时间、术后阴道流血时间均长于电切组,但差异无统计学意义(P>0.05)。见表1。

表1 两组手术时间、术后阴道流血时间比较
2.2两组术中出血量、住院时间比较 两组术中出血量为10~15 ml,两组无显著差异。两组住院时间均为2 d,两组无显著差异。
2.3两组术后息肉复发率、妊娠率比较 两组术后复发率比较差异无统计学意义(P>0.05)。冷刀组术后妊娠率高于电切组,差异有统计学意义(P<0.05)。见表2。两组术后均未见术中子宫穿孔、术后1个月内盆腔感染、闭经等主要并发症发生。
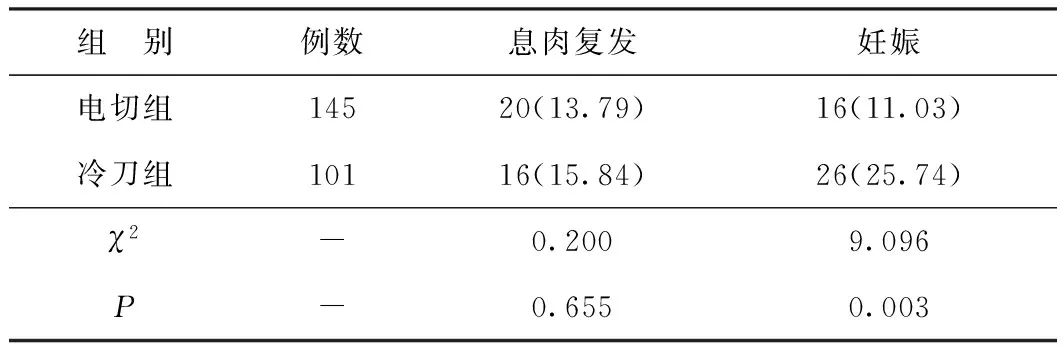
表2 两组术后息肉复发率、妊娠率比较[n(%)]
3 讨论
3.1子宫内膜息肉是妇科的常见病,国外有研究显示,不明原因的不孕症患者中子宫内膜息肉发病率高达16.5%~26.5%[9]。国内外多项研究证实切除子宫内膜息肉有利于提高不孕症患者的临床妊娠率以及辅助生殖的成功率[10-11]。
3.2传统的宫腔镜电切术使用环形电极切除息肉,也可电凝止血,术后复发率低,在临床应用广泛。近年来子宫内膜息肉切除术后生育能力的恢复逐渐受到关注。电切时产生热辐射可能损伤病变部位的深部肌层组织、周围正常的子宫内膜,电切产生的热量可能导致膨宫液温度上升,对子宫内膜造成热损伤,从而导致宫腔粘连风险增加,降低术后妊娠率[12-13]。宫腔镜冷刀系统配备非能量器械,操作灵活、简便,且降低了电切时的电、热损伤。研究表明该系统可替代很多传统宫腔镜电切手术,且具有手术成功率高、对子宫内膜保护好、手术难度低等优势[14]。
3.3宫腔镜下子宫内膜息肉电切术通过破坏子宫内膜功能层及部分基底层,使子宫内膜对激素的反应能力减弱,从而达到治愈异常子宫出血的目的。对于年龄较大或已无生育要求的患者,可电切大部分子宫内膜和浅表的病灶,减少术后异常子宫出血发生概率,术后可获得肯定的疗效。但对于年轻、有生育要求的患者,在治疗子宫内膜息肉的同时,更需要保护子宫内膜。冷刀操作在宫腔镜直视下,利用抓钳和剪刀等冷刀器械,从息肉根蒂部切除息肉,并且不损伤周围正常的组织。宫腔镜下冷刀摘除息肉定位准确,保留了子宫内膜功能,其优越性是其他手术方式所不能替代的。
3.4宫腔镜手术后并发症包括近期并发症和远期并发症,主要近期并发症包括子宫穿孔、术中出血、邻近脏器的损伤等[15]。本研究显示两组术后均未见主要并发症发生,可见冷刀系统的使用并未增加手术风险。Garuti等[16]研究显示两种手术方式在手术时间上无差异,均未引起近期手术并发症。本研究两组术中出血量、住院时间均无显著差异,由此可进一步说明使用冷刀进行宫腔镜手术不会大幅提高手术难度,不会造成更多的手术并发症。
3.5本研究结果显示,冷刀组手术时间、术后阴道流血时间长于电切组,但差异无统计学意义(P>0.05)。手术时间的增多除了受医师手术熟练度的影响外,也可能与冷刀摘除息肉往往需要多次对息肉根部进行钳夹、剪除有关。由于冷刀技术没有使用电凝,创面渗血可导致术后阴道流血时间的延长。
3.6本研究中两组术后1年内子宫内膜息肉的复发率差异无统计学意义,但冷刀组术后1年内妊娠率优于电切组。两种术式的复发率未见显著差异,可能与随访时间不够长有关,也可能说明电切对息肉根部的破坏其实无助于预防息肉的复发。冷刀组术后妊娠率更高,可能与冷刀对子宫内膜损伤更小,宫腔微环境及子宫内膜术后恢复更快有关[13]。何其凤[17]研究表明冷刀切除子宫内膜息肉复发率为6.06%,可显著改善患者异常子宫出血的症状。Mazzon等[18]通过对688例子宫肌瘤患者行宫腔镜下冷刀切除术后发现,冷刀技术可能降低子宫穿孔及术后宫腔粘连风险,对有生育需求患者有利。
3.7子宫内膜息肉与不孕症密切相关。Shokeir等[19]研究显示,在原发性不孕症患者中子宫内膜息肉的发病率为3.8%~38.5%,在继发性不孕症患者中的发病率为1.8%~17%。患有子宫内膜息肉的不孕症患者经过宫腔镜处理后,自然妊娠率能够得到提升,其术后妊娠率为43%~80%[20]。本研究中冷刀组术后妊娠率高于电切组,建议有生育要求的患者使用宫腔镜冷刀切除子内膜息肉。
综上所述,宫腔镜下冷刀切除多发性子宫内膜息肉与传统的宫腔镜电切手术一样安全有效,虽然可能增加手术时间及术后阴道流血时间,但能更好地保护患者生育能力。宫腔镜冷刀技术作为传统宫腔镜电切技术的延伸和补充,成为宫腔镜微创技术的重要发展方向,可以在医疗机构推广应用。
