蔗糖异构酶在异麦芽酮糖生产中的研究进展
2023-03-09张佳钰郑明强路福平刘夫锋
陈 宁,张佳钰,郑明强,路福平,刘夫锋*
(1.天津科技大学 工业发酵微生物教育部重点实验室/天津市工业微生物重点实验室/工业酶国家工程实验室,天津 300457;2.天津科技大学 生物工程学院,天津 300457)
随着社会经济的提高与健康意识的发展,人们越来越关注高质量的健康生活,低热量及零蔗糖食品饮料逐渐成为重要的消费产品。此外,肥胖、高血糖、龋齿等健康问题也增加了消费者对低糖食品的消费倾向,异麦芽酮糖作为替代蔗糖的功能性甜味剂而受到广泛关注[1-3]。异麦芽酮糖(isomaltulose),即6-O-α-D-吡喃葡糖基-D-果糖,又称帕拉金糖,是蔗糖的一种异构体,与蔗糖有着相似的物理性质和口感[4]。异麦芽酮糖是通过果糖和葡萄糖以α-1,6糖苷键相连后得到的右旋双糖。自然状态下,异麦芽酮糖是以白色结晶状态存在的。异麦芽酮糖的甜度大约是蔗糖的50%,且无任何异味,甜味稳定,将异麦芽酮糖放在高温环境(120 ℃)中熬煮一段时间,甜味几乎没有变化[2]。异麦芽酮糖易溶于水,且随着温度的升高其溶解度逐渐变大[3]。与蔗糖相比,异麦芽酮糖的耐酸性较强,将20 g/dL 的蔗糖和异麦芽酮糖在酸性条件下的沸水浴中处理一定时间后,蔗糖全部水解,而异麦芽酮糖几乎没有变化[5]。由于异麦芽酮糖的吸湿性较差,不易降解,尤其是在柠檬酸的存在下,其可在室温条件下长时间的保存。
异麦芽酮糖还有一定的保健功能。研究发现,当摄入的食物中添加了异麦芽酮糖时,可有效减少口腔疾病的发生[5],且唾液中可变链球菌的数量也明显减少[6],且异麦芽酮糖可在小肠内完全消化、吸收,由于异麦芽酮糖的分解速度很慢,体内胰岛素和血糖可长时间保持在一定范围内,不会造成血液中葡萄糖水平极速上升,可有效预防糖尿病,适合糖尿病患者摄入[7-8]。另外,异麦芽酮糖还可通过加氢反应生产糖醇[9],其可作为无糖替代品应用于食品中。异麦芽酮糖以其良好的酸稳定性、极低的吸湿性和较高的安全性[10-11],在食品中具有广阔的市场应用前景。异麦芽酮糖广泛的优势和适用人群,使其具有重要的开发价值。甜菜和蜂蜜中存在天然的异麦芽酮糖,但其含量较少且提取困难,难以满足市场需求。因此,为了满足市场供给需要,亟须提高异麦芽酮糖的生产效率。
目前,异麦芽酮糖的制备方法主要有化学转化法和生物转化法。由于化学转化法存在耗能高、污染性强等问题[12],而且技术不够成熟,使得制备异麦芽酮糖变得非常困难。因此,包括酶转化法和微生物转化法在内的生物转化法在国内外得到了广泛的应用。生物转化法是基于蔗糖异构化法转化生成异麦芽酮糖,即利用微生物合成的蔗糖异构酶(sucrose isomerase,SIase,EC 5.4.99.11)将蔗糖分子中葡萄糖和果糖之间的α-1,2 糖苷键异构化为α-1,6 糖苷键形成异麦芽酮糖和α-1,1 糖苷键形成海藻酮糖[13]。因此,蔗糖异构酶是生物催化生成异麦芽酮糖和海藻酮糖最有效的生物酶制剂,通过蔗糖异构酶生物转化法实现异麦芽酮糖产业化受到人们越来越多的关注。作者综述了蔗糖异构酶的研究进展,详细介绍了SIase 的来源、三维结构、催化机制、理性改造和异源表达等,以及在异麦芽酮糖制备中细胞固定化和酶固定化的固定化技术,最后展望了蔗糖异构酶在异麦芽酮糖工业化生产中的广阔市场前景。
1 蔗糖异构酶的概述
1.1 蔗糖异构酶的来源
20 世纪50 年代,南德公司首次在甜菜厂的废水中分离得到能够分泌蔗糖异构酶的红色精朊杆菌(Protaminobacter rubrum),进而发明了采用微生物酶转化法制备异麦芽酮糖。经过几十年的研究发展,科研人员已经分离获得多种能够合成蔗糖异构酶的微生物,且绝大部分蔗糖异构酶都来源于细菌。能产蔗糖异构酶的代表细菌有:普城沙雷氏菌[14]、放射性土壤杆菌[15]、大黄欧文菌[16]、分散泛菌[17]、克雷伯氏肺炎菌[18]以及嗜中酸假单胞菌[19]。根据酶催化生成的主要产物,蔗糖异构酶分为:主要生产异麦芽酮糖型(转化率为60%~90%)和主要生产海藻酮糖型(转化率为85%~89%)。此外,一种来源于昆虫Silverleaf whitefly 的蔗糖异构酶[20]催化蔗糖只生成海藻酮糖。
1.2 蔗糖异构酶的酶学性质
蔗糖异构酶的pI 小于7,属于酸性蛋白质,最适pH 在5.5~7.0。当pH 超过此范围时,其活性显著降低。同时,催化口袋的电荷对催化反应的最终产物影响显著。当反应的pH 高于酶的最适pH 时,最终产物中海藻酮糖的比例上升;而当反应的pH 低于酶的最适pH 时,催化产物中葡萄糖和果糖的产量增加[21]。大多数蔗糖异构酶的最适温度在20~40 ℃,且蔗糖异构化产物的比例受温度影响很大。高温条件有利于异麦芽酮糖的形成,而较低的反应温度则有利于海藻酮糖的生成。一般来说,反应温度的升高加快了反应速度。然而,高温条件(>50 ℃)会加剧蔗糖的水解,并生成葡萄糖和果糖。不同来源的蔗糖异构酶的动力学参数不同,其底物亲和力和识别能力也是不同,如嗜中酸假单胞菌(Pseudomonas mesoacidophila)中蔗糖异构酶Km值为19.2 mmol/L[22],大黄欧文菌(Erwinia rhapontici)中蔗糖异构酶的Km值是其10 倍左右,达到222 mmol/L[23]。同样的,红色精朊杆菌P.rubrum CBS574.77 的Kcat/Km值为1 301 L/(s·mmol)[24],而P.mesoacidophila MX-45 的Kcat/Km值仅为36 L/(s·mmol)[25]。此外,不同的金属离子对蔗糖异构酶的影响也存在差异,Mn2+和Mg2+的存在可促进酶活力的提升,Ca2+、Cu2+、Zn2+的存在会使酶活力受到微弱抑制,而当Ag+、Hg+存在时酶完全失活。同时,蔗糖异构酶对蔗糖具有高度的底物特异性,当反应体系中存在葡萄糖和果糖时,葡萄糖和果糖则变为该酶的竞争性抑制剂,使酶的底物亲和力降低[26]。
1.3 蔗糖异构酶的三维结构
在蛋白质数据库(PDB)里,目前利用X 射线衍射法已成功解析了4 种蔗糖异构酶的三级结构,分别是来源于Klebsiella sp.LX3(PDB:1M53)[18]、Protaminobacter rubrum CBS574.77(PBD:3GBD)[27]、Pseudomonas mesoacidophila MX-45(PBD:1ZJA)[22]和Erwinia rhapontici NX-5(PBD:4HOW)[28]的蔗糖异构酶。其 中,P.mesoacidophila MX-45 和E.rhapontici NX-5 蔗糖异构酶突变体的结构以及其抑制剂结合体的结晶结构也得到全面解析[19,28]。作为单亚基分子的蔗糖异构酶,其分子结构和糖苷酶13(GH13)家族的酶分子结构类似,如寡-1,6-葡萄糖苷酶和α-葡萄糖苷酶[29],而且不同来源的蔗糖异构酶的三级结构同源性也很高[25]。与GH13 家族酶相比,蔗糖异构酶也是由3 个结构域组成,包括C端结构域、N 端结构域和亚结构域[30]。其中,N 端结构域是一个(β/α)8桶状结构,是由8 个α 螺旋与8个β 折叠组成,包括氨基酸残基16~119 和190~493,构成了蔗糖异构酶的催化活性中心,具有与糖苷酶13 家族相似的底物结合和催化机制,同时连接着C 端结构域和亚结构域[26];C 端结构域由两个反平行β-折叠组成,与N 端结构域以及亚结构域之间形成离子键和氢键,用以确保酶活性中心所在区域的稳定性,氨基酸残基包括494~573;亚结构域则由多个loop 结构组成,参与底物的结合[21],包括氨基酸残基120~190。
在对多种蔗糖异构酶氨基酸序列的多重比对发现,通常在N 端结构域中存在一段包括5 个氨基酸的特定序列。以来源于P.mesoacidophila MX-45的蔗糖异构酶MutB 晶体结构为例(见图1),Asp200、Glu254、Asp327、Phe256 和Phe280 为高度保守序列,其中Asp200、Glu254 和Asp327 构成催化活性中心,位于蔗糖异构酶的催化口袋中,负责酶与底物的结合和催化[19,21]。Phe256 和Phe280 相距约0.6 nm,在催化域入口形成一对芳香钳,将该位点对其进行特异性定点突变后,发现产物中仅含有葡萄糖和果糖,且没有生成海藻酮糖和异麦芽酮糖,说明突变后的酶失去了异构活性,表明这两个氨基酸在底物识别和产物特异性中起着重要作用[21,31]。与GH13 家族其他酶不同的是,由5 个氨基酸组成的特定序列是蔗糖异构酶所特有的,并且该段独特的序列参与了酶的异构化反应[32]。

图1 P.mesoacidophila MX-45 MutB 催化口袋示意图Fig.1 Schematic diagram of P.mesoacidophila MX-45 MutB catalytic pocket
1.4 蔗糖异构酶催化机理
蔗糖异构酶以蔗糖为底物时,催化过程包括异构化反应和水解反应。蔗糖通过异构化反应生成异麦芽酮糖和海藻酮糖,通过水解反应将蔗糖水解为葡萄糖和果糖(见图2)。
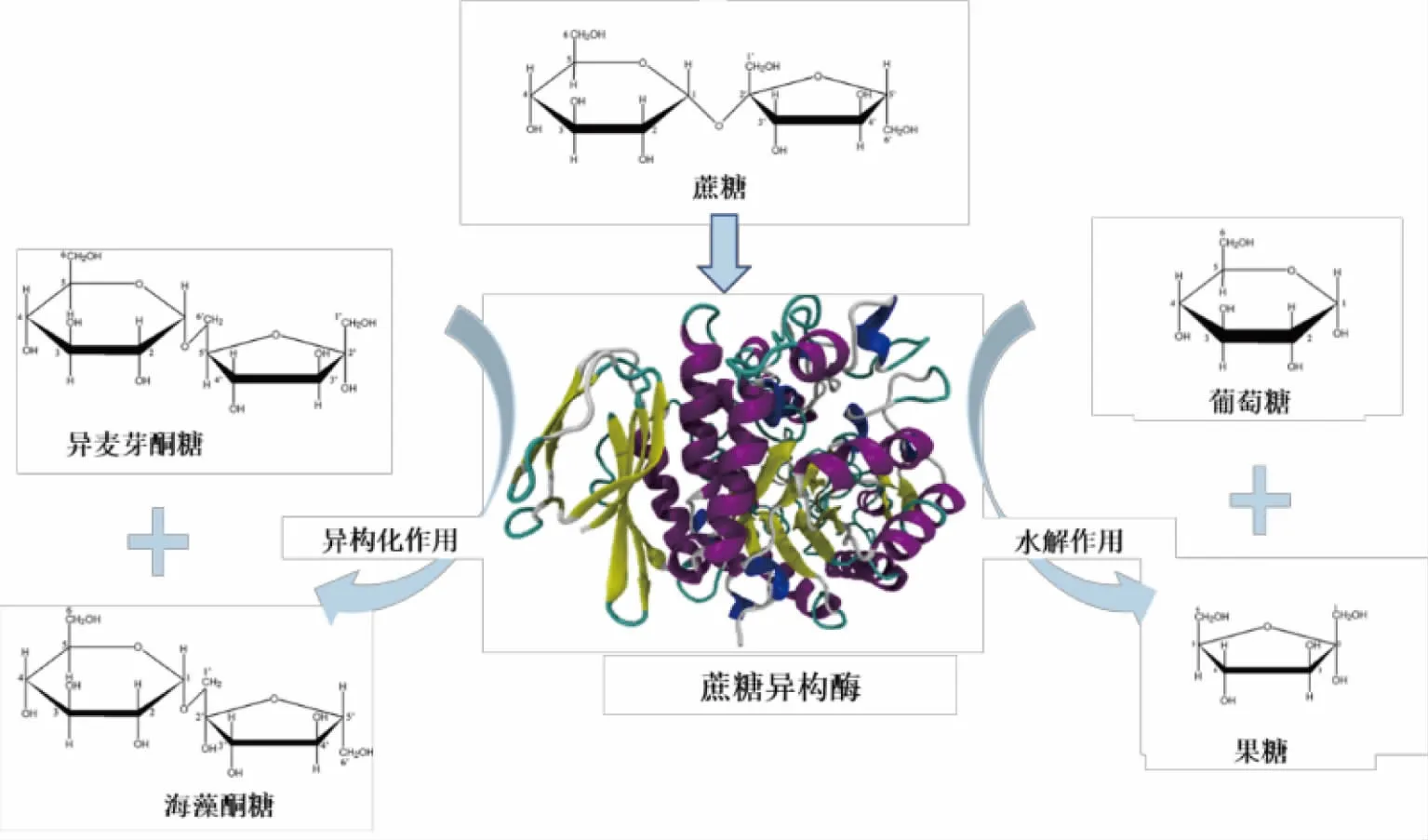
图2 蔗糖异构酶的水解和异构化作用Fig.2 Hydrolysis and isomerization of sucrose isomerase
Cheetham 在20 世纪80 年代提出了蔗糖异构酶的催化机理[33]。以来源于E.rhapontici 的蔗糖异构酶作为研究对象,探讨了蔗糖异构酶整个的催化反应过程。认为在催化反应中首先发生了水解反应,生成葡萄糖和果糖,然后葡萄糖基与果糖基的C1 和C6 位的羟基非选择性地结合,形成具有α-1,6 糖苷键的异麦芽酮糖和α-1,1 糖苷键的海藻酮糖。且在这个过程中,优先生成海藻酮糖,主要是由于海藻酮糖产生过程中不需要果糖基进行180°旋转,其生成所需能量更低。
以源于S.plymuthica ATCC 15928 的蔗糖异构酶为研究对象,有研究者提出了蔗糖异构酶的分子内重排[14]。在催化的过程中,蔗糖异构酶将底物水解为葡萄糖和果糖,蔗糖异构酶与葡萄糖基紧密相连,而与果糖基仅通过离子键结合,致使果糖基可自由旋转和改变其位置,形成异麦芽酮糖和海藻酮糖。此外,通过实验发现,在反应体系中加入果糖会增加产物中海藻酮糖的比例,而在底物中加入一定量的葡萄糖会提高异麦芽酮糖的产率,从而验证了海藻酮糖和异麦芽酮糖的生成比例取决于底物蔗糖的互变异构率。
在上述研究的基础上,Zhang 等将来源于Klebsiella sp.LX3 的蔗糖异构酶作为研究对象,提出了异构化反应和水解反应的两步催化机制,同时发现了蔗糖异构酶的保守序列,325RLDRD329[18]。随后在P.mesoacidophila MX-45[34]和P.rubrum[31]来源的蔗糖异构酶的基因中也发现了此保守序列。在对P.rubrum 蔗糖异构酶的Arg325 和Arg328 位置进行定点突变后,发现突变体生成异麦芽酮糖的比例出现不同程度的下降,且突变导致产物中有异麦芽糖的形成。研究发现,突变的这两个氨基酸是结合果糖基的两个重要位点,而突变导致酶对果糖基亲和力下降,容易与酶脱离;与此同时,体系中的葡萄糖会充当底物迅速与酶结合,最终生成异麦芽糖。
近年来,Ravaud 等提出了新的蔗糖异构酶的催化机制,两步双位移催化机制[21]。在蔗糖异构酶催化蔗糖生成异麦芽酮糖和海藻酮糖过程中,酶-糖基中间复合物共价键的形成与断裂是通过羧基离子过渡态来完成的。活性中心的谷氨酸作为酸性催化剂提供质子使底物糖苷键上的氧质子化,后通过天冬氨酸对蔗糖上C1 位的氢原子进行亲核攻击,使其去质子化并生成酶-β-葡萄糖基复合物,最终果糖基通过互变异构生成异麦芽酮糖和海藻酮糖。
2 蔗糖异构酶的异源表达
利用基因工程等方法已将多种来源的蔗糖异构酶在大肠杆菌、枯草芽孢杆菌和酵母菌等工程菌株中实现了异源表达。大肠杆菌(Escherichia coli)是生产目标产品的理想工业菌株之一,来源于Klebsiella planticola 的SIase 基因成功克隆并在E.coli 中表达,所得蔗糖异构酶的水解活性随pH 的升高而降低,异麦芽酮糖成为主要产物。Zhang 等克隆了菌株Erwinia sp.Ejp617 的SIase 基因在E.coli BL21(DE3)中异源表达,经生物催化后,重组SIase可将300.0 g/L 的蔗糖转化为240.9 g/L 异麦芽酮糖[35]。然而,大肠杆菌由于细胞壁热原和内毒素的合成,不适用于异麦芽酮糖的合成。因此,在安全的食品级宿主中异源表达SIase 受到越来越多的关注。乳酸乳杆菌(Lactococcus lactis)由于其非致病性、无侵染性的特性被认为是重组蛋白质生产和分泌的高效表达菌株[36]。Park 等将来源于Enterobacter sp.FMB-1 的SIase 基因在L.lactis MG1363 中异源表达,并将所得SIase 用于异麦芽酮糖生产,其转化率为72%[37]。同样,枯草芽孢杆菌(Bacillus subtilis)也是常用菌株之一。将来源于E.rhapontici NX-5 的SIase 基因在工程菌B.subtilis WB800 中过表达,有效解决了异麦芽酮糖生产中的食品安全问题[38]。另外,解脂耶氏酵母(Yarrowia lipolytica)具有GRAS认证,是一种公认安全的微生物,来源于P.dispersa UQ68J 的SIase 基因可在此酵母中进行高效表达[39]。蔗糖异构酶的异源表达见表1。

表1 蔗糖异构酶的异源表达Table 1 Heterologous expression of sucrose isomerase
3 蔗糖异构酶的理性改造
虽然天然蔗糖异构酶可用于异麦芽酮糖的生物合成,但在工业应用过程中仍存在热稳定性差、转化率低等问题。基于结构信息的蛋白质工程可以提高天然酶的应用性,因此出现了多种蛋白质工程方法(见表2)。目前蔗糖异构酶的分子改造主要集中在提高热稳定性、提高异麦芽酮糖的产率以及减少副产物这3 个方面。

表2 蔗糖异构酶的分子改造Table 2 Molecular modification of sucrose isomerase
来源于Klebsiella sp.LX3 菌株的SIase(PalⅠ)在50 ℃条件下的半衰期只有1.8 min,这严重限制了该酶的工业化应用。为了提高其热稳定性,通过定点诱变对其进行分子改造,利用脯氨酸取代Glu498 和Arg310 后所得的突变酶,在50 ℃条件下的半衰期是天然酶的11 倍,显著提高了热稳定性,与此同时异麦芽酮糖的转化率提高了27%[43]。在此基础上,Zhang 等又对Klebsiella sp.LX3 来源的蔗糖异构酶的保守序列进行了大量的突变。结果发现,将保守序列中的精氨酸或天冬氨酸(Arg325、Arg328、Asp325 和Asp329)突变为中性氨基酸或相反电荷的氨基酸时,生成产物中异麦芽酮糖占比下降26%~67%,而海藻酮糖的比例增加17%~61%。上述结果表明,突变点并不影响酶活性,而仅影响其产物特异性,由高产量的异麦芽酮糖转化为高产量的海藻酮糖[18]。
来源于Serratia plymuthica AS9 的蔗糖异构酶是另一种研究较多的蔗糖异构酶。但前期研究结果表明来源于S.plymuthica AS9 的蔗糖异构酶的热稳定性较差。为了获得热稳定较高的突变体,利用B因子位点选择结合定点突变技术构建了3 种突变体,E175N、K576D 和E175N/K576D。在45 ℃培养条件下,突变体的半衰期分别是天然酶半衰期的1.38、1.04、1.19 倍,热稳定性提高,同时异麦芽酮糖的得率也分别提高了2.0%、1.0%、2.8%[44]。此外,为了减少由S.plymuthica AS9 蔗糖异构酶在生物合成过程中产生的副产物,Pilak 等采用了类似于“战舰策略” 的半模拟蛋白质工程策略,对来源于S.plymuthica 的SIase 进行了7 次循环突变,共涉及55 个位点,最终获得了一株三重突变体Y219L/D398G/V465E。该突变体的最适反应温度从30 ℃提高到35 ℃,热稳定性和催化效率都明显提高[45]。
而来源于P.dispersa UQ68J 的SIase 却表现出对异麦芽酮糖的产物特异性较低。为了克服上述缺点,研究者以靠近底物结合位点的299 位氨基酸为目标,利用定点突变技术获得突变体Q299E,其底物转化率从(90.3±0.8)%提高到(94.2±0.4)%[46]。此外,Lipski 等将来源于Rhizobium sp.的SIase 进行随机突变,获得的F164L 突变体将底物转化率提高了55.1%[47]。
4 生物催化生产异麦芽酮糖中蔗糖异构酶的固定化应用
异麦芽酮糖在自然界中的含量微乎其微,且提取困难,与其市场需求相去甚远。化学合成制备异麦芽酮糖难度较大,并且容易污染环境。因此,对于异麦芽酮糖的生产,国内外大都采用生物转化法,主要包括微生物转化法和酶转化法。作为生物转化异麦芽酮糖中重要酶制剂,蔗糖异构酶的固定化有助于提高其催化性能及稳定性,实现生物酶的回收或重复使用。
4.1 固定化细胞
微生物转化法是利用整个微生物细胞来生产异麦芽酮糖,也包括游离细胞转化法和固定化细胞转化法。有研究者将Enterobacter sp.FMB1 菌体与蔗糖混合发酵,48 h 后的产物得率高达90%,然而由于其发酵环境复杂、成本较高,给后期分离造成困难,不适用于工业放大[48]。随着固定化技术的提高,通过化学或物理手段将微生物细胞固定于某一区域内,在保持菌体催化活性的同时还可进行回收再利用。因此,与游离细胞生产异麦芽酮糖相比,固定化细胞具有简化下游工艺、连续操作生产、提高催化剂稳定性和操作稳定性、可重复使用性等优点。
近年来,已报道的固定化细胞转化法主要有海藻酸盐包埋法和壳聚糖-戊二醛交联法,所得的固定化细胞不仅可以提高异麦芽酮糖的产率还可改善其应用性能。Cheetham 等最早将E.rhapontici NCPPB 1578 细胞包埋进海藻酸盐凝胶颗粒,所得固定化细胞的异麦芽酮糖产率是0.2 g/(h·g),且与游离细胞相比,其操作稳定性提高[33]。随后Mundra等将相同来源的细胞利用响应面分析法优化了该固定化过程,在海藻酸盐质量浓度为5 g/dL、细胞载量为5 g/L 时,达到异麦芽酮糖最大产率,且将异麦芽酮糖的产量提高了40%[49]。有研究者利用海藻酸钙对Erwinia sp.D12 细胞进行固定化,采用响应面法优化了固定化工艺,同时评估了明胶和谷氨酰胺转氨酶的添加对海藻酸钙固定的Erwinia sp.D12 细胞颗粒网状化的影响[50]。结果表明,用3 g/dL 海藻酸钠固定细胞,细胞固定化质量浓度为47 g/dL,添加0.3 mol/L 氯化钙、1.7 g/dL 的明胶和0.15 g/dL 的谷氨酰胺转氨酶所得的固定化细胞,在连续生产7 次后其蔗糖转化率还能保持50%~60%。随后又利用海藻酸钙超声固定Erwinia sp.D12 细胞颗粒填充床柱,其蔗糖最大转化率为53%~59%,且能够在480 h内保持较高活性。降低温度对所得异麦芽酮糖结晶后,结晶纯度高达96.5%[51]。Li 等将表达SIase 基因的重组E.coli 细胞用戊二醛处理后,重悬于海藻酸钠溶液中,并加入氯化钙溶液制备固定化细胞微球。所得固定化细胞在1.5 h 内的蔗糖转化率为87%,且能够在酶反应器中连续30 d 保持稳定[16]。
为了提高重组E.coli 细胞的重复使用性,Li 等又优化了其固定化条件,得出2 g/dL 的海藻酸钠和3 g/dL 的氯化钙为最优固定化条件,且在重复使用30 次后其稳定性良好,采用柱式反应器连续生产40 d 后,异麦芽酮糖产率(转化率)还可高达83%[52]。除此之外,还有其他一些微生物用于海藻酸盐固定化细胞生产异麦芽酮糖,比如Klebsiella sp.[53-54]、P.rubrum[55]、S.plymuthica ATCC15928[56-58]等。用海藻酸钙、戊二醛和聚乙烯亚胺对P.rubrum 细胞进行固定化,得到稳定的固定化细胞微球,可重复使用24 个批次,异麦芽酮糖产率(转化率)高达89%~94%[55]。Krastanov 等利用中空纤维膜反应器固定化S.plymuthica ATCC15928 细胞,固定化细胞的催化活性随操作时间的延长缓慢下降,在连续操作90 d后活性仅丧失了11%,且在生物反应器的循环模式下,质量浓度40~60 g/dL 的底物在36~48 h 内的转化率均能达到90%以上[56]。随后又利用壳聚糖-戊二醛交联法将S.plymuthica ATCC15928 细胞进行固定,所得固定化细胞的底物转化率高达94%[57]。
4.2 固定化酶
细胞固定化具有细胞自溶、细胞代谢导致产物浓度低等缺点。同时,固定化细胞生产异麦芽酮糖,存在菌体浓度低、生产强度弱的缺陷[54],因此,酶转化法受到越来越多的关注。酶转化法是指将蔗糖异构酶从微生物中分离出来,通过游离酶或固定化酶转化制备异麦芽酮糖。常用的SIase 的固定化方法包括交联、包埋和吸附。Contesini 等将来源于Erwinia sp.D12 的SIase 分别利用低甲氧基果胶和脂肪微胶囊包埋和铁铝酸四钙吸附两种方法制备固定化SIase,所得固定化SIase 的异麦芽酮糖转化率分别为30%和60%[59]。随后又将铁铝酸四钙吸附的固定化条件进行了优化,所得的固定化SIase 的异麦芽酮糖转化率提高到63%[60]。Zhang 等将重组SIase 纯化后利用聚乙烯醇-海藻酸钠进行固定,该酶的稳定性显著提高,在循环使用13 个批次后还能保持96%的高转化率[61]。与包埋和吸附方法相比,交联法固定化酶更加稳定,酶不易脱落,重复使用性好。Wu 等将SIase 交联固定到聚赖氨酸修饰的介孔二氧化钛上,其酶活力回收率高达93%,且具有良好的操作稳定性,在连续反应条件下其半衰期可达114 h,使用16 个批次后仍能保持95%的蔗糖转化率[13]。此外,作者也以来源于Pantoea dispersa 的蔗糖异构酶为模型酶,分别采用了硅球-戊二醛吸附交联法和戊二醛-葡聚糖醛交联法制备了交联酶聚集体,大幅提高了固定化酶的催化性能[62-63]。目前关于固定化细胞或酶生产异麦芽酮糖的研究见表3。
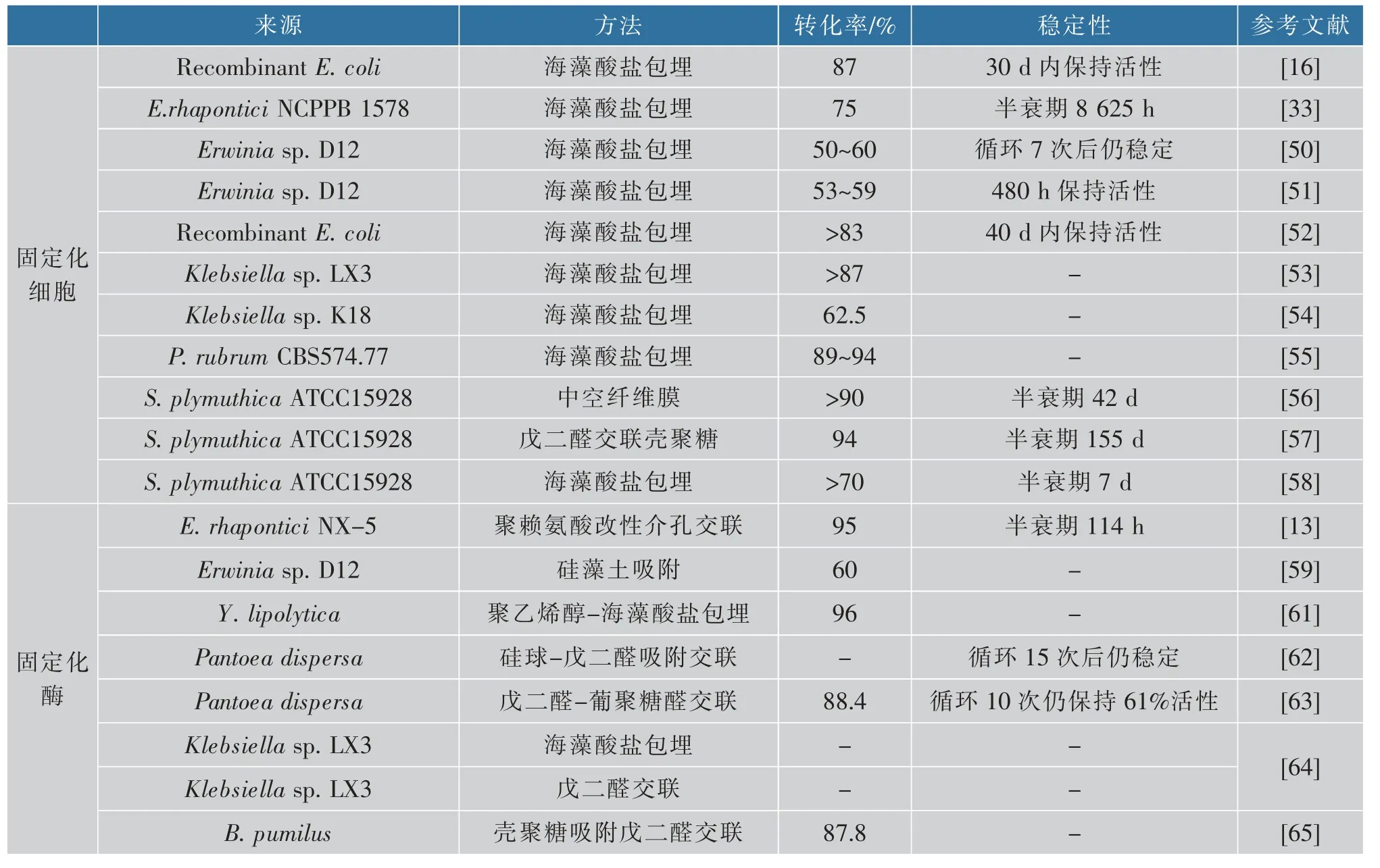
表3 固定化细胞或酶生产异麦芽酮糖Table 3 Isomaltulose production by immobilized cells or enzymes
5 展 望
异麦芽酮糖具有优良的理化性质和保健功效,是蔗糖的理想替代物,在减糖等健康食品中拥有广阔的市场前景。蔗糖异构酶是生物转化异麦芽酮糖最有效的生物酶制剂,近年来围绕菌株的筛选、酶的异源表达、酶分子改造以及固定化细胞/酶等领域,进行了大量且系统的研究,使人们对SIase 有了更深入的认识,然而作为一种具有重要应用价值的工业酶,仍存在一些问题亟待解决。
现有的食品安全级菌株存在分泌量低、热稳定性差、应用性能差等缺陷,要解决这些问题,可以从菌株和酶两方面进行改造。选育SIase 高产菌株,优化工程菌株的发酵工艺,构建高效的基因工程产酶菌株;或在SIase 结构的研究基础上,首先确定了影响酶活性的关键区域,通过理性设计改造酶分子,改善酶的催化特性,如提高热稳定性和pH 耐受性、增加产物特异性等。另外,部分SIase 的热稳定较差,在进行了相关蛋白质工程修饰后,效果并不是很明显,可进一步对其进行固定化,而现如今的固定化细胞或固定化酶的技术相对不成熟,为了提高SIase 在工业生产中的应用性能,还需要对SIase 的关键位点进行进一步的探索和修饰。
