肾动脉纤维肌性发育不良诊断及处理中国专家共识
2023-03-09中国医疗保健国际交流促进会难治性高血压与周围动脉病分会共识起草组
中国医疗保健国际交流促进会难治性高血压与周围动脉病分会共识起草组
纤维肌性发育不良(fibromuscular dysplasia,FMD)曾被认为是一种罕见病,但随着对疾病认识水平的提高及影像学诊断技术的进步,越来越多的患者被诊断。通常FMD 被认为是一种特发性、节段性、非炎症性、非动脉粥样硬化性的中小动脉疾病,可导致受累血管狭窄、闭塞以及形成动脉瘤或动脉夹层[1-2]。全身的中小动脉均可受累,但最常累及肾动脉。最近发表的一项国际FMD 注册研究表明,约90.7%的患者累及肾动脉,其他如颈动脉、椎动脉、颅内动脉、髂动脉、肠系膜动脉及冠状动脉等也可受累,两处及以上血管受累约占57%[3]。中国人群肾动脉FMD 的临床特征与当前国际共识的数据相比较有诸多差异,需引起心血管医师的关注[4-5]。本共识沿用当前国际共识对FMD 的定义,萃取国内外的研究精华,结合中国人群肾动脉FMD 的临床特征和治疗经验,以规范临床诊治,提高疗效。
1 流行病学
国外有研究估计症状性肾动脉FMD 在普通人群中的患病率约为0.4%,而无症状肾动脉FMD 则患病率相对较高,约为4.4%~6.6%[6],但并无大样本人群研究证实。在欧美人群中,FMD 为肾动脉狭窄第二位病因,约占10%[7-8],也是儿童肾血管性高血压的最常见原因[9]。来自中国医学科学院阜外医院的一项研究表明,FMD 所致的肾动脉狭窄约占肾动脉狭窄人群的4.2%,为肾动脉狭窄的第三位病因,并且在40 岁以下肾动脉狭窄患者中比例约为三分之一[10],与欧美国家的流行病学特征有较大差别。中国人群肾动脉FMD 的患病率尚未见报道,如按肾动脉狭窄占成人高血压人群的1%~3%,而FMD 约占肾动脉狭窄人群的4%来估计,推测肾动脉FMD 的人群患病率约为0.12%~0.36%。
以往欧美研究认为,FMD 多见于30~50 岁中青年人群[11-12]。但近年来研究数据显示,FMD 的平均发病年龄在50~60 岁,提示不能忽视在中老年人群中筛查FMD[13-14]。欧美FMD 患者另一个特点是女性为主,尤其近年来的研究数据显示90%~95%为女性[13,15]。但中国医学科学院阜外医院及上海交通大学医学院附属瑞金医院两大中心汇总的连续20 年病例的数据显示,中国肾动脉FMD 患者多为青少年,平均年龄为26 岁,男女比例差别不大[16]。并且中国FMD 患者特征与日本及韩国等东亚国家相似[17-18],这显示东西方人群在FMD 发病年龄和性别方面差异显著。
2 病因学
FMD 的发病机制至今仍不清楚,一般认为是基因和环境因素共同作用的结果。有研究提示吸烟是FMD 相关的潜在致病因素[19],但未被证实。由于FMD 患者中女性占大部分,雌激素和孕激素已被怀疑为FMD 的相关因素[20],但其与FMD 的关联尚无明确证据[21],在使用口服避孕药或其他外源性女性激素的人群中也无明确的致病关联证据[22]。另外,也有研究发现FMD 患者血转化生长因子(TGF)-β1、TGF-β2 水平较同年龄组、同性别对照组明显升高,而α-1 抗胰蛋白酶缺乏,这些因素也可能是FMD 潜在的发病机制[23]。
有研究显示一部分FMD 患者为家族性常染色体显性遗传[24],但占FMD 人群比例很低(1.9%~7.3%)[14,25],提示遗传因素在FMD 的发病中不起重要作用。一些学者认为FMD 与基因突变有关。PHACTR1是目前认为较可能的FMD 易感基因[21,26-28]。有研究通过对1 154 例患者(大部分为肾动脉FMD)与3 895 例对照者进行基因关联研究,发现PHACTR1的内含子rs9349379 对血管发育有直接影响,该变异使FMD 风险增加约40%[21]。rs9349379还增加内皮素1 的表达,在适当的血管床中选择性调节内皮素1 的功能可能被用于治疗疾病[29]。CD2相关蛋白上游区域中紧密连锁不平衡的几个基因与FMD 显著关联,其中最紧密相关的是rs9296551[30]。一种新型的复发性COL5A1基因变异c.1540G> A患者表现动脉瘤、夹层形成、动脉迂曲和多灶型FMD,在组织学上证实为动脉壁纤维化和平滑肌细胞排列紊乱,提示c.1540G> A 基因变异与动脉夹层和多灶型FMD 相关[31]。
3 组织病理分型及造影分型
Harrison 与McCormack 根据受累动脉管壁结构层次的不同提出了FMD 的病理分型,分为中膜型、内膜型及外膜型[32]。中膜型组织学上表现为动脉中层变薄及动脉肌层纤维增生交替出现,其中动脉肌层被胶原疏松的纤维增生所取代;内膜型组织学特征是平滑肌细胞在内膜纤维基质中增生,导致严重的管腔变窄,而中膜及外膜基本正常;外膜型可见外膜成纤维细胞和胶原蛋白明显增多。三种类型动脉管壁病变可无明显界限,因为病变常累及相邻层。据报道,中膜型最为多见,约占70%~80%,其次为内膜型,约占10%~15%,而外膜型最为少见,约占5%~10%[11-12]。
近二十年来,随着影像学技术的进步和腔内介入治疗的广泛开展,外科手术已逐渐被血管腔内介入治疗所取代,多数FMD 病例难以取得病理标本,病理分型已不再实用。目前临床上多采用基于动脉造影不同形态的分型[33],分为多灶型(典型者呈“串珠样”改变),单灶型(狭窄长度<1 cm)和管型(狭窄长度>1 cm)(图1)。
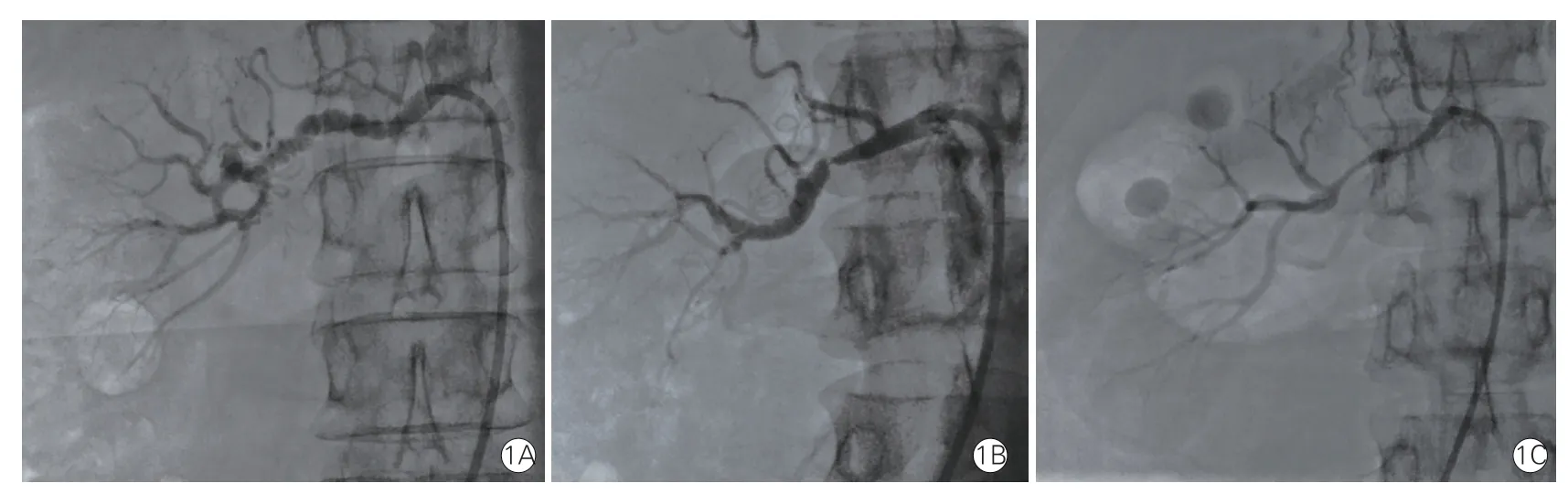
图1 基于血管造影形态的肾动脉纤维肌性发育不良分型
近年来,又有学者提议将单灶型与管型合称为局灶型[34]。有研究显示,在组织病理上多灶型均为中膜型;单灶型多为内膜型,少量为外膜型;管型多为外膜型,少许为内膜型[6]。欧美人群研究显示,70%以上的FMD 为多灶型,局灶型仅占10%~20%。近期美国及欧洲的注册研究[1,14]中,多灶型分别占76%及71.9%。而我国的研究数据与其截然不同,以局灶型为主,约为75%,而多灶型不到25%[4]。也有个案报道局灶型病变可能发展为多灶型病变[35],或局灶型和多灶型病变在同一患者的二侧肾动脉并存[36]。
4 临床表现
肾动脉FMD 最常见的临床表现是高血压。来自中国医学科学院阜外医院近18 年的回顾性研究显示,连续入选的142 例肾动脉FMD 患者全部罹患高血压,高血压发病年龄6~54 岁,主要分布于10~29 岁,10 岁以下及40 岁以上发病者较少。高血压多为中重度,表现为收缩压和舒张压均持续升高,昼夜节律消失[37-38]。肾动脉FMD 患者如合并颈动脉、椎动脉、肠系膜及颅内动脉等部位病变,可出现头痛、搏动性耳鸣、腹痛、眩晕等不典型症状[1]。肾动脉FMD 多无体征,少部分患者可闻及上腹部或脐周血管杂音[1]。
肾动脉FMD 所致肾损害及是否合并肾外器官受损是需要关注的重要临床问题。多数患者有微量或轻度蛋白尿,局灶型患者患侧肾萎缩及肾小球滤过率(GFR)减退常见,但整体肾功能不全少见[4,39]。上述中国医学科学院阜外医院登记的142 例肾动脉FMD 患者中,62 例(43.7%)存在肾脏损害,包括肾功能不全7 例(4.9%),一侧肾萎缩49 例(34.5%),一侧肾脏梗死6 例(4.2%);尿蛋白阳性25 例(17.6%)。17 例(12.0%)合并肾外靶器官严重损害,其中合并脑卒中13 例(9.2%;出血性脑卒中2 例,缺血性脑卒中11 例),一过性肺水肿5 例(3.5%)[4]。美国多中心FMD 注册研究显示,FMD 患者肾动脉受累占86.4%,肾功能衰竭和肾脏梗死的比例分别为1.6%和0.9%,合并脑血管事件19.2%[其中短暂性脑缺血发作(TIA)13.5%,脑卒中9.8%,蛛网膜下腔出血1.1%][25,40-41]。欧洲多中心FMD 注册研究显示,91.0%患者存在肾动脉受累,TIA、脑卒中和蛛网膜下腔出血的发生率分别为3.5%、7.7%和3.5%[3,36]。
中国肾动脉FMD 患者的筛查建议
(1)高血压发病年龄<30 岁,高血压2~3 级,尤其是难治性高血压患者。
(2)一侧肾萎缩,除外肾实质和上尿路梗阻疾病。
(3)上腹部或脐周闻及血管杂音。
(4)超声提示肾动脉中远段存在狭窄、动脉瘤或夹层。
(5)在肾动脉以外其他部位血管有一处或多处出现典型的FMD 病变。
存在以上各项之一,建议进行筛查。
5 肾动脉FMD 的诊断
影像学检查是诊断肾动脉FMD 的主要手段,临床上主要方法有多普勒超声,CT 血管成像(CTA),磁共振血管成像(MRA)及经皮选择性血管造影。影像学诊断取决于FMD 病变的特征表现(局灶型或多灶型病变)以及相关表现(动脉夹层、动脉瘤和动脉扭曲)。
欧美专家共识均推荐多普勒超声为首选的FMD筛查方法[1,11-12],但高度依赖操作者技术,且受肥胖、呼吸运动及肠道气体干扰,也无法清晰显示肾动脉病变的解剖细节,很难发现FMD 的影像学特征,对肾动脉FMD 的诊断价值有限。肾动脉CTA 诊断的敏感性和特异性均很好(图2),本共识推荐其为首选。如CTA 有禁忌,可选MRA,MRA 诊断肾动脉FMD 的准确性稍低于CTA,易于高估病变狭窄程度,但可避免对比剂的肾毒性和较大剂量的X 线辐射。CTA 或MRA 检查可显示直径1 mm 以上肾动脉的解剖特征,肾脏大小和大致灌注程度,以及其他腹腔动脉如腹腔干、脾动脉、肠系膜上动脉、肠系膜下动脉是否受累,这些信息对于FMD 的诊断和制定治疗策略有很大帮助[42]。肾动脉造影仍然是诊断肾动脉FMD 的金标准,但一般用于CTA 或MRA 诊断不确定,但临床又高度怀疑时进行。

图2 肾动脉CTA
在欧美国家的报道中,多灶型(串珠样病变)占80%以上[11-12,34],局灶型较少。我国FMD 主要为局灶型,需要排除不典型大动脉炎和动脉粥样硬化所致的肾动脉狭窄,尤其是40 岁以下患者。血管内超声(IVUS)可以清晰显示动脉病变组织超声特征和管腔截面形状。有研究认为IVUS 较动脉造影可更好地评估FMD 病变的特征[43],但相关研究较少。IVUS 显示串珠样改变的FMD 主要表现为病变部位多处动脉瘤、夹层及假腔形成,而局灶型FMD 主要表现为均匀环状高密度强回声的内中膜增厚或伴外膜轮廓收缩的负性重构两种类型(图3)。局灶型狭窄的病因鉴别,IVUS 对排除粥样硬化和外部压迫有重要作用,但对炎症性狭窄是否有鉴别价值需要进一步研究。
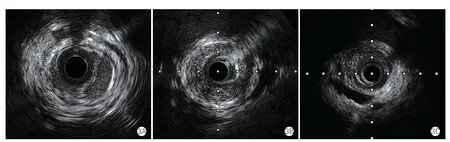
图3 肾动脉纤维肌性发育不良的血管内超声影像
尽管选择性肾动脉造影是评估FMD 位置和形态的金标准,但只能在预期会影响患者诊治时进行。在肾动脉FMD(尤其是多灶型)的患者中,有时仅通过影像学检查无法确定肾动脉狭窄的严重程度和血液动力学意义,肾血流量和肾素分泌往往也在正常范围,并且由于部分患者的FMD 累及双侧肾动脉,这类患者的分侧肾静脉取血测定肾素也可能无法确定病变更严重一侧。因此,建议必要时进行跨狭窄压差测量,以评估狭窄的血液动力学意义。在肾动脉FMD 进行血管成形术后,对造影发现有明显夹层和残余狭窄的病变也建议测量跨狭窄压差,以确定压力梯度是否已被消除。在医疗条件好的中心,除了测量跨狭窄压差,还可根据需要结合IVUS 或光学相干断层扫描(OCT)评估病情。
当肾动脉影像学的特征符合FMD 诊断时,目前认为FMD 也有可能累及全身中小动脉,国际共识建议进行全身其他动脉的影像学检查。欧美注册研究数据表明,约一半以上FMD 患者累及多血管[3]。但中国人群肾动脉FMD 合并肾外动脉受累的比例很低[4],对所有患者进行全身其它动脉的影像学检查似无必要,建议基于存在的症状和体征对可疑患者行进一步血管影像学检查,包括颅外颈/椎动脉,其次颅内动脉、内脏动脉和冠状动脉,甚至是四肢动脉。另外,当发现一条肾动脉FMD 以后,虽然其他血管首次检查未发现问题,但目前尚不清楚其他血管是否还会发生新的FMD 病变,也尚难定论需要隔多久重复检查。
肾动脉FMD 的影像学选择和诊断要点
(1)当怀疑肾动脉FMD 时,进行确诊(或排除)应进行无创影像学检查,CTA 是首选。但如果存在禁忌,则选择MRA。
(2)CTA 和MRA 检查均有禁忌时,才考虑将双功能超声作为肾动脉FMD 无创诊断的替代方法,但准确性较低。
(3)当CTA、MRA 二者阴性,但存在高度怀疑时,则应考虑进行经皮选择性肾动脉造影。
(4)肾动脉FMD 影像学特征主要包括:①病变位于肾动脉主干的中远段,可累及一级分支,极少累及主干近端或二级分支;②形态上可呈典型的串珠样或局灶狭窄,可伴有动脉瘤、夹层或闭塞;③非同一条肾动脉上可能存在不同形态的病变,但必须包含一处狭窄性病变;④如果仅肾动脉主干的中远段或一级分支存在动脉瘤、夹层或闭塞病变不足以诊断FMD,须有肾外动脉FMD 的明确证据。
6 鉴别诊断
肾动脉FMD 的鉴别诊断是临床关注的重点问题,了解FMD 的临床和影像学特征表现对鉴别FMD 和其他动脉疾病至关重要。FMD 的鉴别诊断包括许多其他动脉病变以及成像伪影等。参考最近的国际共识[1],并结合中国人群肾动脉疾病谱[10],共识列出了肾动脉FMD 在临床上需要鉴别诊断的主要疾病和要点(表1)。
表1 肾动脉FMD 的鉴别诊断
7 肾动脉FMD 的治疗
7.1 降压药物治疗
目前对于肾动脉FMD 所致高血压,理想的降压目标值尚不清楚,临床实践中可参考《肾动脉狭窄的诊断和处理中国专家共识》[44]和《中国高血压防治指南(2018 年修订版)》[45]。病理生理上肾动脉FMD 所致高血压的主要原因是肾素-血管紧张素-醛固酮系统激活,因此建议首选血管紧张素转换酶抑制剂(ACEI)或者血管紧张素Ⅱ受体拮抗剂(ARB)类药物[46],但双侧受累患者在应用过程中需严密监测肾功能,单侧患者使用一般不会影响整体肾功能,但仍需监测患肾萎缩情况。若降压不达标,需联合用药,钙拮抗剂及β 受体阻滞剂均可选择,利尿剂可进一步激活肾素-血管紧张素-醛固酮系统,一般不主张联用,但合并一过性急性肺水肿或慢性心力衰竭时可短期使用。至于哪种联合降压方案更合理,目前尚缺乏前瞻性随机对照研究证据,可根据患者病情和合并症具体分析,采取个体化方案。
7.2 抗血小板与其他药物治疗
对于肾动脉FMD 患者,一般主张给予小剂量阿司匹林。这样的治疗并无明确循证医学依据,主要见于一些FMD 患者合并动脉瘤或者夹层,有可能在病变部位形成血栓,或者导致梗死,由此认为是有必要的。在来自美国的一项注册研究中,72.9%的FMD 患者使用了抗血小板治疗[46]。但是,考虑到许多患者合并严重的高血压,持续服用阿司匹林可能导致出血风险,临床上推荐综合评估患者出血风险后,在血压控制满意的情况下,使用阿司匹林75~100 mg/d 抗血小板治疗。老年肾动脉FMD 患者如合并冠心病、脑血管病、外周血管疾病或有血管介入病史等情况时,推荐常规进行抗血小板治疗。对于接受介入治疗的肾动脉FMD 患者,术前至少2 d开始服用阿司匹林100 mg/d 和氯吡格雷75 mg/d。如果仅进行球囊成形,则阿司匹林100 mg/d 和氯吡格雷75 mg/d 维持1~3 个月,随后单药长期维持;如果使用金属裸支架,则阿司匹林100 mg/d 和氯吡格雷75 mg/d 维持6 个月,随后单药长期维持。
基于目前国际国内血脂异常管理指南,肾动脉FMD 往往存在高血压,合并高脂血症的中老年患者大多需要强化降脂,建议按血脂异常管理指南推荐尽早启动降脂治疗。
现代人为什么比以前更忙?再回到文首那个议题,答案就十分清楚了,用伦敦经济学院教授大卫的话说,就是因为一大批没有意义的“工作”被管理层源源不断地创造出来。其标志就是真正干事的人少了,而“日常事务管理人员急剧上升”,人浮于事,事浮于人。就高校而言,有些大学,各类非教研人员和教研人员占比几乎各为一半,就很能说明问题。
7.3 肾动脉FMD 的血管重建治疗
肾动脉FMD 治疗首先考虑血管重建。血管重建的目标是纠正肾动脉管腔狭窄,消除肾血管性高血压和恢复患肾功能。主要方法有经皮腔内介入治疗及外科开放手术治疗,前者包括肾动脉球囊扩张术和支架置入术。基于当前有限的研究证据[47-49],本共识建议,肾动脉FMD 患者如果肾动脉主干或一级分支节段性管腔直径狭窄≥50%伴持续高血压和(或)患侧肾功能下降,如无禁忌证,均推荐血管重建治疗。年龄<40 岁、高血压起病时间短的患者往往血管重建疗效更好。对于年龄≥40 岁、高血压起病时间≥5 年的患者,可能合并原发性高血压和血管重构,血管重建疗效逐渐降低,建议考虑满足以下条件之一可行血管重建治疗[44]:(1)未服降压药情况下持续高血压2 或3 级;(2)应用二联降压药物(其中包括足量ACEI或ARB)血压不达标;(3)患肾萎缩较正常参考范围或正常对侧小1.5 cm 以上,和(或)患肾GFR 较正常参考范围或正常对侧低25%以上;(4)应用ACEI/ARB后患肾功能明显恶化;(5)未服ACEI 或ARB 情况下外周静脉血肾素和血管紧张素水平明显超过正常范围或患肾静脉血肾素和血管紧张素水平明显超过正常对侧2 倍以上。符合条件数越多越应尽早进行血管重建手术。如果肾动脉FMD 患者的患肾长径<7 cm,GFR<10 ml/min,有明显蛋白尿,一般归为相对手术禁忌证。但我国肾动脉FMD 患者多为青少年,如病变血管解剖适合,无绝对手术禁忌证,仍建议尝试血运重建治疗,有潜在获益可能。临床上常可看到患肾病变血管开通成功后,患者血压显著下降,患肾体积和GFR 可部分恢复。
目前推荐经皮肾动脉球囊扩张术作为肾动脉FMD 所致狭窄的首选治疗[1,44],新型的刻痕球囊、药物涂层球囊是否可以提高扩张效果,减少再狭窄率,目前尚缺乏足够临床证据。对于小直径球囊尚难以充分扩开的病变,不推荐使用更大直径的高压球囊或切割球囊扩张,否则有导致肾动脉破裂或假性动脉瘤危险。以下情况可考虑支架置入:(1)球囊扩张后出现限制血流的明显夹层;(2)球囊扩张后弹性回缩超过参考血管直径的50%;(3)球囊扩张后肾动脉破裂,使用覆膜支架;(4)辅助合并肾动脉瘤的弹簧圈填塞或封闭;(5)二次球囊扩张术后仍在1 年内再狭窄。肾动脉FMD 所致狭窄介入治疗术后高血压治愈率或改善率各项研究差别较大。综合多数研究报道,治愈率在30%~50%,改善率为50%~80%,介入治疗效果与患者年龄明显相关,年轻患者降压反应明显好于年长患者。一项纳入47 项研究的荟萃分析表明,1 616 例肾动脉FMD 患者行介入治疗后高血压的治愈率为36%[48]。国内最大样本肾动脉FMD腔内血运重建后随访显示,高血压的治愈和改善率更高[47,49],这可能与病例年龄偏小有关。
肾动脉FMD 血管造影及狭窄性病变经皮腔内血管成形术操作建议
(1)一般采用股动脉入路。如果肾动脉近端与开口以远的腹主动脉夹角<45°,或肾动脉开口以远的腹主动脉严重迂曲,建议采用上肢动脉入路,提高导管与肾动脉主干的同轴性,便于腔内操作。
(2)多体位进行选择性肾动脉造影,清楚地观察肾动脉全貌,包括分叉/分支是否受累、肾脏大小、肾实质的灌注,并评估是否存在肾动脉瘤或夹层。
(3)在有条件的导管室,对于“串珠样病变”最好采用压力导丝进行跨狭窄压差测定。如果无压力导丝,可以采用4 F 或5 F 带末端侧孔的造影导管进行跨狭窄压力测定。对于血管造影仍显示欠清楚的病变或病变性质需要鉴别,可采用IVUS 或OCT 协助判断狭窄程度和病变管壁的组织学影像特征。
(4)将直径狭窄≥50%或跨狭窄收缩压差阈值定在20 mmHg(1 mmHg=0.133 kPa),作为是否进行肾动脉扩张成形术的必要条件。
(5)进行肾动脉血管成形术时,选择起始球囊直径一般较病变直径大1.0~1.5 mm,最大直径应等于或稍小于标测导管或定量血管造影测定的远端正常血管直径。每次球囊直径增大幅度应为0.5~1.0 mm,直到残余狭窄<30%或跨狭窄收缩压差小于20 mmHg。在血管成形时,球囊加压要缓慢递增,一般每2~3 s 增加1 个大气压,直至球囊完全张开。如果球囊扩张时患者诉肾区出现明显胀痛,应及时停止加压,此时即使球囊扩张不完全,也必须回撤压力,造影观察是否血管出现夹层或破裂。如果未见血管损伤,不建议用更大压力或更换更大直径球囊扩张,也不建议使用切割球囊或支架置入;如果球囊张开不到正常参考血管直径的70%,继续加压无法进一步扩张或出现明显胀痛,建议停止介入操作,考虑择期行开放式血管重建。
(6)目前仍建议首次或二次介入治疗一般不进行支架置入。支架置入仅限于血管成形的并发症(如夹层、假性动脉瘤、血管破裂)的补救措施,或第二次球囊扩张成形后再狭窄。有小样本报道这样的条件性支架再狭窄率很低,远期疗效良好,是否可用于首次介入治疗需进一步临床证据支持。
(7)在血管成形术结束后,应再次造影,必要时可进一步采用压力导丝或IVUS 或OCT 协助判断,以评估病变处理是否满意,是否存在潜在并发症。
对于肾动脉FMD 的夹层病变,治疗上采取什么措施仍有争议,目前共识建议,如果夹层未明显影响血流,病变相对稳定,无明显缺血表现,可以只予以阿司匹林观察即可;如果夹层明显影响血流,出现缺血症状,建议行血管重建治疗。血管重建包括支架置入或外科开放旁路移植。肾动脉主干夹层行支架置入治疗成功率高,效果较好;但如果管腔直径小于4 mm 的夹层,对肾功能影响有限,支架再狭窄率高,如果血流未明显受限,一般主张保守治疗。
对FMD 所致的肾动脉瘤,目前治疗上也存在较大争议。一般认为直径≥2 cm 的动脉瘤破裂风险增加,需要考虑腔内治疗,治疗的方法包括弹簧圈填塞和覆膜支架;对于直径< 2 cm 的动脉瘤,破裂风险低,是否需要治疗存在争议。由夹层导致的假性动脉瘤缺血性事件或破裂的风险很低,一般很少需要血管腔内治疗。但由于妊娠期间动脉瘤破裂或夹层进展风险增加,对于合并这类病变的育龄女性或正在考虑备孕的女性需要考虑提前干预[50-51]。
对于肾动脉FMD 一些特殊病变,包括:(1)肾动脉狭窄球囊扩张不到参考血管直径50%即出现明显腹痛;(2)肾动脉狭窄解剖复杂难以通过导丝或不适合球囊成形;(3)肾动脉狭窄合并动脉瘤腔多分支的病变。这些病变腔内治疗效果有限或不适合腔内治疗,一般主张进行开放外科血管重建,包括原位血管重建、肾脏离体血管重建后再植入、自体肾移植等。通常方式包括自体大隐静脉主-肾动脉旁路移植术,狭窄段切除吻合术,或狭窄段的切开成形手术。对于上述术式不适合的复杂FMD 病变,自体肾移植也是开放直视手术的重要组成,可以提供更清晰、更充足的操作空间和时间。因为要离体操作,存在热缺血时间,要保护好离体肾,避免肾功能损伤,并尽可能缩短缺血无灌注时间。患肾切除仅适用于肾动脉不能重建并已经丧失滤过功能,但仍存在大量分泌肾素导致高血压的有症状患者。
8 肾动脉FMD 合并肾外器官FMD 的处理原则
肾动脉FMD 合并肾外器官FMD 的比例,欧美文献报道约占50%,但国内文献报道不到10%[4]。肾外各器官动脉FMD 处理原则建议遵循相关的指南或共识,本共识不作进一步阐述。如果并存,建议先处理有症状或器官功能受损的病变;如果均有症状或器官功能受损,建议先处理可能危及生命的病变,或同期处理。例如FMD 累及肾动脉,也累及冠状动脉或颈动脉,则先处理引起心绞痛或TIA 的病变;病情许可的情况下,也可同期进一步处理肾动脉。
9 肾动脉FMD 介入术围术期管理
肾动脉FMD 介入治疗围术期的管理遵循既往已建立的规范[44],包括术前病情评价与药物治疗准备、术中术后病情监测和并发症的识别处理。病情评价:除做好全身一般状态评价外,术前常规检查包括:血、尿常规,肝、肾功能,电解质,卧立位血浆肾素-醛固酮,C 反应蛋白,血沉,24 小时动态血压,肾脏/肾动脉超声/CTA 或MRA。选择性检查包括:开博通肾显像和(或)分侧肾小球滤过率,同步四肢血压测量,全主动脉/弓上动脉/颅内动脉CTA 或MRA,冠状动脉CTA。药物治疗准备:(1)血压尽可能平稳达标(<140/90 mmHg),不宜>160/100 mmHg。(2)抗血小板或者抗凝治疗:一般情况下,术前至少2 d 开始服用阿司匹林100 mg/d和氯吡格雷75 mg/d。如果仅进行球囊成形,则阿司匹林100 mg/d 和氯吡格雷75 mg/d 维持1~3 个月,随后单药长期维持;如果使用金属裸支架,则阿司匹林100 mg/d 和氯吡格雷75 mg/d 维持6 个月,随后单药长期维持[1]。术中抗凝药物一般使用普通肝素25~50 mg,使活化凝血时间(ACT)维持在200~300 s之间即可。(3)肾功能保护:因为多数肾动脉FMD患者肾功能在正常范围,不需要额外的肾功能保护。对肾功能已受损的患者,术中尽可能少用对比剂,建议推荐最大对比剂用量=5 ml×体重(kg)/血清肌酐(mg/dl);其次要做好水化,在心功能允许的情况下,常规术前6~12 h 开始静脉滴注生理盐水1~2 ml/min,术后继续水化12~24 h,保证术后4 h 尿量达到1 000 ml 以上。(4)术后注意监测尿量、尿常规、肾功能和血压24~48 h,根据血压变化调整降压药用量,避免低血压。
10 肾动脉FMD 术后随访
肾动脉FMD 是一种慢性、进展性血管疾病需要对血管进行定期检查和长期随访。对于术前有高血压的患者,术后每周至少测量血压一次。如果血压恢复正常或显著改善,则根据血压水平调整降压药用量或停药;若术后血压再次明显升高到术前水平,建议即刻做影像学评估是否出现再狭窄。目前证据不足以推荐肾动脉FMD 患者随访的特殊影像学检查方法。影像学检查的类型和频次须根据每位患者的病情个体化考虑,同时也要结合当地医疗条件。建议术后患者第1、3、6 个月各随访一次,以后每年随访一次。有FMD 相关症状或体征的患者可视病情需要更频繁随访。随访期间临床评估应包括心血管事件、可能与FMD 相关的症状和血压控制。同时应坚持药物治疗,特别是抗血小板药物和降压药物,以及观察这些药物潜在的不良反应。随访时进行尿液、肾功能、电解质和血液生化指标检查,根据这些结果综合考虑用药调整。
学术顾问:刘力生(中国医学科学院阜外医院),高润霖(中国医学科学院阜外医院),王继光(上海市高血压研究所),高平进(上海市高血压研究所),姜一农(大连医科大学附属第一医院),陶军(中山大学附属第一医院)
专家共识起草组成员(按姓氏汉语拼音排序):陈晓平(四川大学华西医院),程康(西安市人民医院),车武强(中日友好医院),董徽(中国医学科学院阜外医院),董一飞(南昌大学第二附属医院),冯颖青(广东省人民医院),宫海滨(徐州市心血管病研究所),贾楠(青岛市市立医院),蒋雄京(中国医学科学院阜外医院),李燕(上海市高血压研究所),李拥军(北京医院 国家老年医学中心),刘敏(河南省人民医院),刘新文(浙江医院),罗玉贤(石家庄市人民医院),罗建方(广东省人民医院),彭猛(郑州大学第一附属医院),唐礼江(浙江医院),田红燕(西安交通大学第一附属医院),王慧勇(广州医科大学附属第一医院),魏文娟(浙江萧山医院),肖国胜(厦门大学附属心血管病医院),许建忠(上海交通大学医学院附属瑞金医院),杨滨(山西医科大学第一医院),杨敏(北京大学第一医院),叶涛(厦门大学附属心血管病医院),余静(兰州大学第二医院),张英(大连医科大学附属第一医院),邹玉宝(中国医学科学院阜外医院)
执笔专家:蒋雄京(中国医学科学院阜外医院),许建忠(上海交通大学医学院附属瑞金医院),董徽(中国医学科学院阜外医院)
利益冲突:所有作者均声明不存在利益冲突
