甘南牦牛三种血液原虫多重PCR检测方法建立及流行病学调查
2023-03-09陈亚明李勇生高生智徐庚全潘阳阳余四九
陈亚明 李勇生 高生智 张 莉 徐庚全 潘阳阳 余四九 ,*
(1甘肃农业大学,甘肃 兰州 730070;2甘肃省动物疫病预防控制中心,甘肃 兰州 730070)
牦牛是分布于高原地区的重要畜种,是当地许多牧民家庭的主要生活和经济来源,并且在农业生产中具有重要作用[1]。牦牛在放牧饲养过程中通常会感染各类寄生虫,且寄生虫感染多呈慢性持续感染,临床症状不易观察;虽然牦牛抵抗力强,寄生虫感染的致死率不高,但牦牛的生产性能和生长发育都会受到影响[2]。弓形虫(Toxoplasma gondii)、环形泰勒虫(Theileria annulata)和新孢子虫(Neospora caninum)是严重危害养牛业的常见寄生虫,家畜寄生虫感染,不仅给养殖业造成巨大的经济损失,更对人类健康造成严重危害[3]。因此检测弓形虫、环形泰勒虫和新孢子虫的感染和流行情况对这3种疾病的防治具有十分重要的意义。
弓形虫和新孢子虫均为牛体内的常见寄生虫,牛群感染后临床症状相似,且发生混合感染的情况日趋严重,主要引起母畜出现木乃伊胎、死胎、流产以及神经系统障碍[4-5]。新孢子虫病和弓形虫病分别由新孢子虫和刚地弓形虫寄生于宿主所引起[6],犬科动物和猫科动物分别是新孢子虫和弓形虫的终末宿主[7]。其中新孢子虫对牛造成的危害最为严重,而弓形虫病是一种人兽共患寄生虫病,牛和其他反刍动物是弓形虫的主要中间宿主[8],这两种寄生虫具有水平和垂直传播两种传播方式。环形泰勒虫感染牛的红细胞、淋巴细胞等,主要表现为淋巴结肿大、贫血、消瘦、高热和食欲不振[9],重症可出现死亡病例,我国已将此病定为二类疫病[10]。但目前尚无可用于预防弓形虫、环形泰勒虫和新孢子虫的成熟疫苗[11-12]。当前,弓形虫和新孢子虫在世界各主要的养牛国家普遍流行[13-15],造成了巨大的经济损失。迄今,弓形虫、新孢子虫在我国大多数省份均有报道[16-17],部分省份也有牛群中存在环形泰勒虫的相关报道[18]。
综合上述进展表明,准确判断弓形虫和新孢子虫感染须经实验室病原检测和诊断。迄今,鉴别检测弓形虫、新孢子虫和环形泰勒虫的常用方法有PCR、实时荧光定量PCR、酶联免疫吸附试验(ELISA)、环介导等温扩增反应(Lamp)等检测方法,其中已有同时检测新孢子虫和弓形虫的双重PCR 检测方法[19]。但是,鉴别检测弓形虫、环形泰勒虫、新孢子虫的多重PCR 方法仍鲜有报道。因此,本试验针对弓形虫、环形泰勒虫和新孢子虫设计特异性引物,建立弓形虫、环形泰勒虫和新孢子虫的三重PCR 方法,以期为临床流行病学调查提供后备支持,从而掌握甘肃省甘南地区3 种寄生虫的流行状况。
1 材料与方法
1.1 试验材料
弓形虫DNA、环形泰勒虫DNA 和新孢子虫DNA均为甘肃农业大学牛羊胚胎工程技术研究中心实验室保存。试验所用牦牛629 份血清样品均采自甘南地区牦牛养殖区。
1.2 仪器与试剂
全血基因组DNA 提取试剂盒、Taq 聚合酶、PCR 试剂、DNA Marker(DL 2000),宝生物工程(大连)有限公司;T100 型PCR 仪,美国Bio-Rad 公司;BioSpectrum 310 凝胶成像系统,美国UVP 公司;高速离心机,德国Eppendorf公司。
1.3 引物的设计合成
根据弓形虫hypothetical protein基因(GenBank 登录号:MG003442.1)、环形泰勒虫Tams1基因(GenBank登录号:LC549654.1)和新孢子虫Nc-p43(GenBank 登录号:EF469765.1),应用Primer premier 6.0 软件各设计一对特异性引物,扩增的目的片段长度分别为520、341 和156 bp(表1)。引物由天津卡梅德生物科技有限公司合成。

表1 多重PCR引物序列Table 1 Multiplex PCR primer sequences
1.4 单重PCR方法的建立
PCR 体系共25 μL:牛弓形虫、环形泰勒虫和新孢子虫的基因组DNA 模板各1 μL,2×Taq Master Mix 12 μL,上、下游引物各0.5 μL,ddH2O 补足至25 μL,混合均匀后进行PCR 反应。扩增程序:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火45 s,72 ℃延伸30 s,共35 个循环;72 ℃延伸10 min。对PCR 产物进行1%琼脂糖凝胶电泳,并在凝胶成像系统下观察。
1.5 多重PCR方法的建立与优化
利用1.4 的反应体系,以弓形虫、环形泰勒虫和新孢子虫的基因组DNA为模板。根据设计的3对引物扩增温度的参考值,分别设置55、56、57、58、59 ℃共5 个梯度进行退火温度优化,以筛选最佳反应温度。
1.6 多重PCR特异性试验
采用优化后的多重PCR方法,分别对弓形虫、环形泰勒虫、新孢子虫、牛双芽巴贝斯虫(Babesia bigemina)和牛卵形巴贝斯虫(Babesia ovata)单一DNA 及其不同组合进行核酸样品扩增,以检测该方法的特异性。
1.7 多重PCR敏感性试验
将弓形虫、环形泰勒虫和新孢子虫3 种原虫的DNA 模板浓度稀释到相同数量级,按优化后的条件进行多重PCR扩增,以检测该方法的敏感性。
1.8 重复性试验
应用建立的多重PCR 方法,对弓形虫+环形泰勒虫、牛双芽巴贝斯虫、弓形虫+环形泰勒虫+新孢子虫、环形泰勒虫+新孢子虫、牛卵形巴贝斯虫、弓形虫+新孢子虫、环形泰勒虫、弓形虫、环形泰勒虫、弓形虫+环形泰勒虫+新孢子虫、弓形虫+新孢子虫、阴性对照和环形泰勒虫样本进行重复试验,验证多重PCR 方法稳定性。
1.9 流行病学调查
将采集到的629 份甘南地区牦牛血清样本,提取DNA 模板,应用本试验所建立的多重PCR 方法检测。出现预期大小520、341、156 bp 条带为阳性,未出现相应条带为阴性。
1.10 数据分析
运用F检验和卡方检验判定季节和年龄与牦牛感染3 种原虫之间存在的相关风险关系。P>0.05 代表差异无统计学意义,即该因素不是感染寄生虫的风险因素。
2 结果与分析
2.1 PCR引物的确定
分别以弓形虫、环形泰勒虫和新孢子虫的DNA 模板进行扩增。结果显示,获得与预期片段大小一致的目的片段520(弓形虫)、341(环形泰勒虫)和156 bp(新孢子虫),未见非特异性条带出现(图1),说明本试验所设计的3对引物特异性良好,可对3种目标虫体的DNA进行有效扩增。
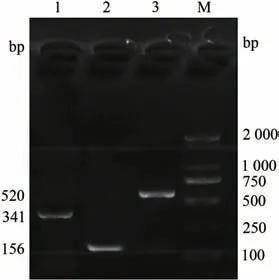
图1 单一PCR引物的特异性检测Fig.1 Specific detection of a single PCR primer
2.2 多重PCR反应体系的建立及退火温度优化
以单一PCR 反应条件为基础构建多重PCR,反应体系为3 种原虫的模板和引物,优化退火温度。结果显示,在56、57、58 ℃都有特异性条带出现,57 ℃时3种PCR产物亮度最高。因此,该多重PCR 反应最佳温度为57 ℃(图2)。
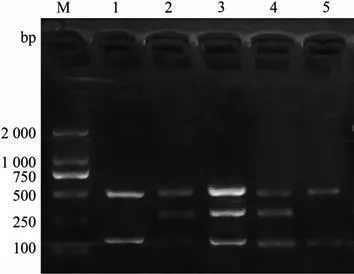
图2 多重PCR反应体系的建立及退火温度优化Fig.2 Establishment of multiplex PCR reaction system and optimization of annealing temperature
2.3 多重PCR特异性试验
采用优化后的PCR 反应体系及扩增程序,用3 对引物分别对弓形虫、环形泰勒虫和新孢子虫的单一DNA模板进行扩增,均可扩增出相应的目的片段(图3,泳道1~3);对弓形虫、环形泰勒虫和新孢子虫3种原虫的混合DNA 模板,扩增出3 条目的片段(图3,泳道4);对弓形虫、环形泰勒虫和新孢子虫的DNA 模板进行不同组合扩增,分别扩增出2条目的条带(图3,泳道5~7),且无其他非特异性条带;而对牛双芽巴贝斯虫、牛卵形巴贝斯虫DNA 和水为模板(图3,泳道8~10)时均无条带出现,表明该多重PCR方法具有良好的特异性。
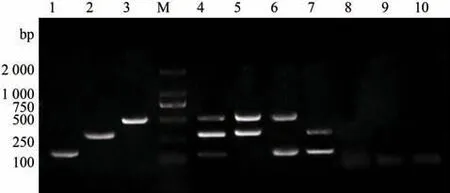
图3 多重PCR的特异性试验Fig.3 Specificity of multiplex PCR
2.4 多重PCR敏感性试验
检测弓形虫、环形泰勒虫和新孢子虫的DNA 浓度,并将上述3 份DNA 分别稀释到相同数量级后进行PCR扩增。该方法可检测到弓形虫、环形泰勒虫和新孢子虫DNA的最低浓度分别是0.01、0.02和0.01 ng·μL-1(图4)。说明该多重PCR 反应敏感性良好,且敏感性能够满足对临床3种虫体DNA浓度的要求。
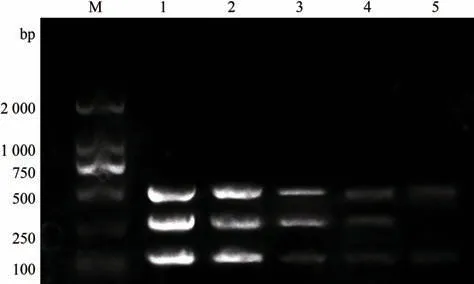
图4 多重PCR敏感性试验Fig.4 Multiplex PCR sensitivity assay
2.5 多重PCR重复性试验
用建立的多重PCR 方法对12 份样本以及阴性对照进行检测,均能扩增出与预期大小相符的目的条带(图5),且无其他非特异性条带的出现。此外,该多重PCR 方法对牛双芽巴贝斯虫、牛卵形巴贝斯虫的扩增效果均为阴性,表明该多重PCR稳定性较好。
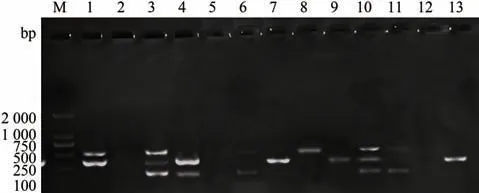
图5 多重PCR 重复性试验结果Fig.5 Multiplex PCR repeatability test results
2.6 临床样品检测结果
应用所建立的多重PCR 方法,检测采集自甘南地区的629 份血清,结果如表2 所示。弓形虫阳性率为4.29%,环形泰勒虫阳性率为3.66%,新孢子虫的阳性率为5.88%。3 种原虫血清阳性率之间差异不显著(P>0.05)。
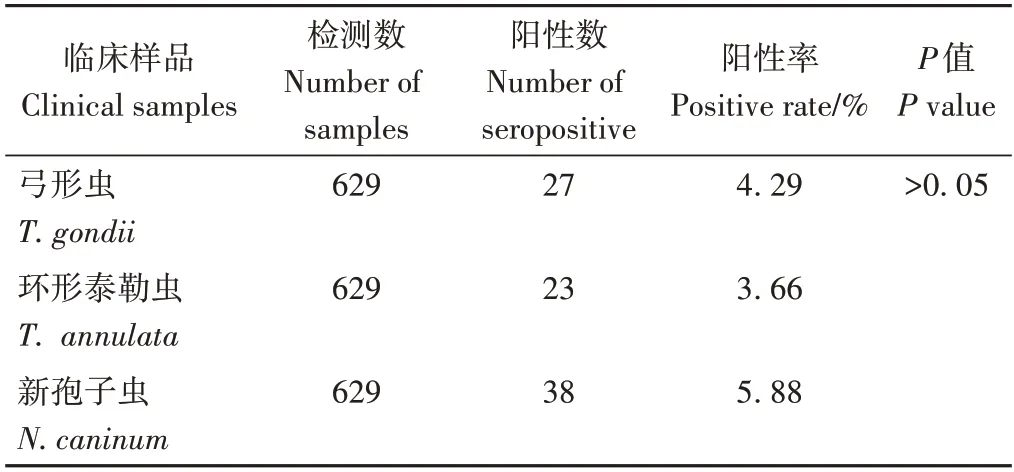
表2 629份临床样品检测结果统计表Table 2 Statistical table of test results of 629 clinical samples
2.7 混合感染情况汇总
将629 份临床样品的混合感染情况进行统计分析,结果如表3 所示。弓形虫和环形泰勒虫的混合感染率为2.23%,弓形虫和新孢子虫的混合感染率为3.50%,新孢子虫和环形泰勒虫的混合感染率为4.13%,3种原虫的混合感染率为3.82%。混合感染的总计感染率为13.68%。
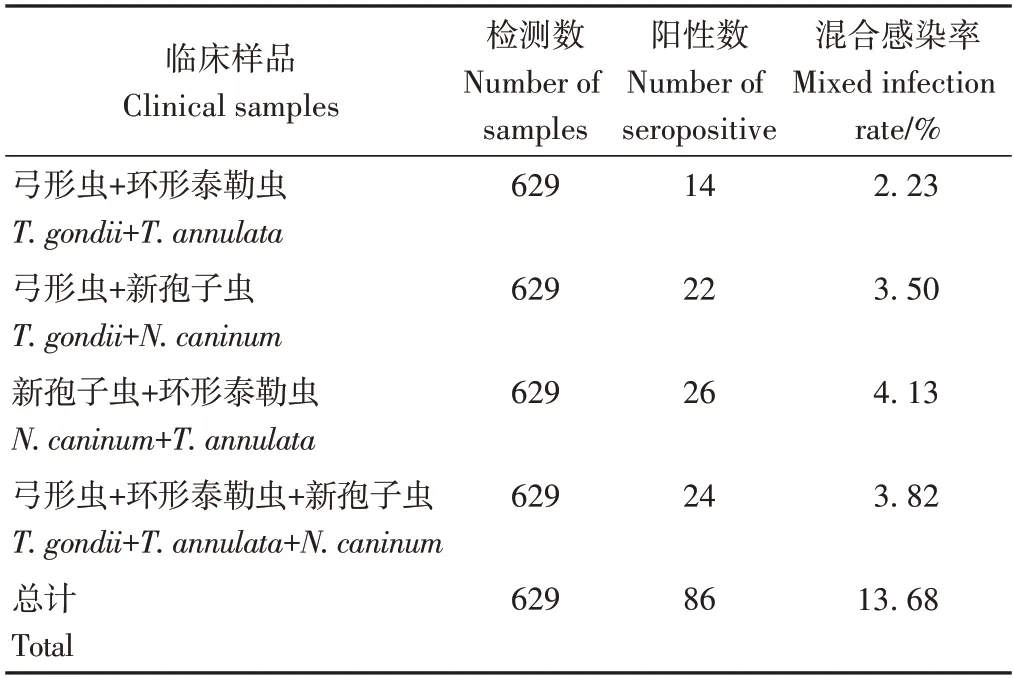
表3 629份临床样品检测结果混合感染统计表Table 3 Statistical table of mixed infection of 629 clinical samples
2.8 不同季节检测结果汇总
对629 份临床样品的检测结果按季节进行统计分析,结果如表4所示。春季、夏季、冬季检测牦牛3种原虫阳性率总计分别为29.34%、23.12%、29.37%。总体不同季节的阳性率差异不显著(P>0.05)。
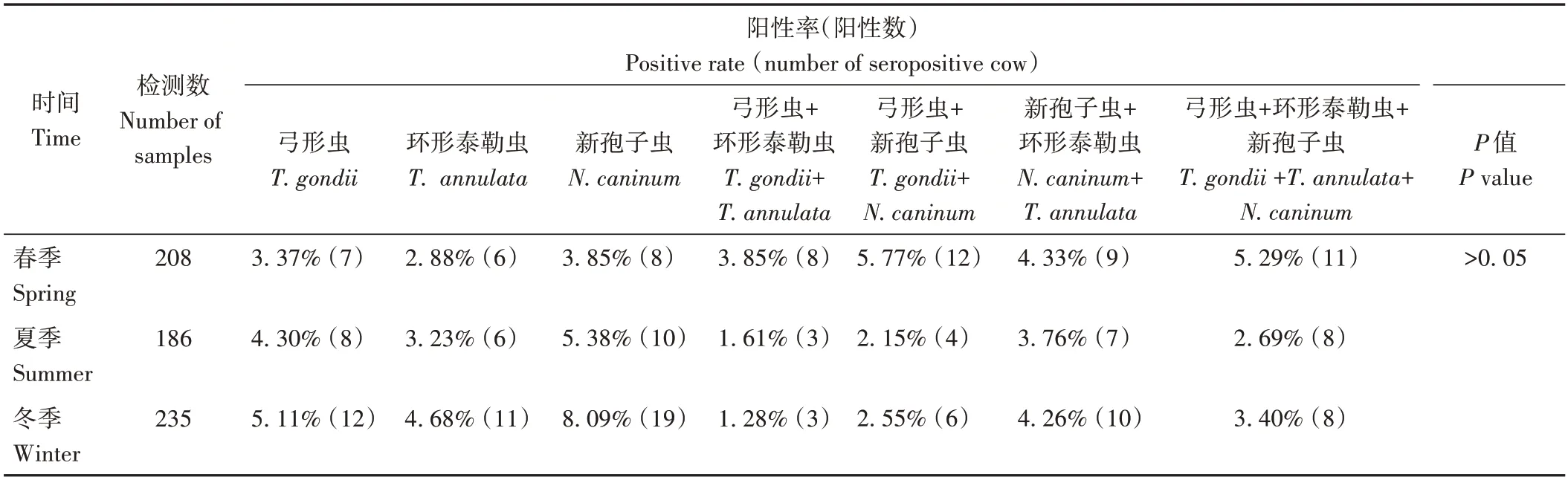
表4 629份临床样品检测结果时间统计表Table 4 Time statistics table of test results of 629 clinical samples
2.9 不同年龄牦牛检测结果汇总
629 份血清样品按照牦牛不同年龄检测结果进行汇总,结果如表5 所示。0~3 岁的牦牛感染3 种原虫的总计阳性率为27.83%,大于3 岁感染3 种原虫的总计阳性率为27.46%。总体2 组不同年龄牦牛间的阳性率差异不显著(P>0.05)。
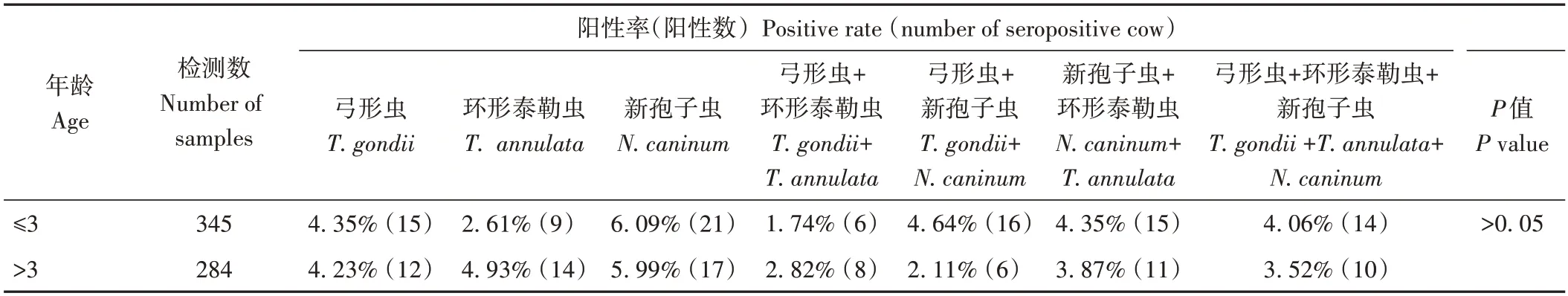
表5 不同年龄牦牛检测结果统计表Table 5 Statistical table of detection results of yaks of different ages
2.10 影响牦牛弓形虫、环形泰勒虫和新孢子虫的风险因素
运用F检验和卡方检验判定牦牛的年龄和不同季节与其感染这3 种原虫之间存在的相关联系。结果如表6所示,季节和年龄均不是牦牛感染3种原虫的风险因素(P>0.05)。
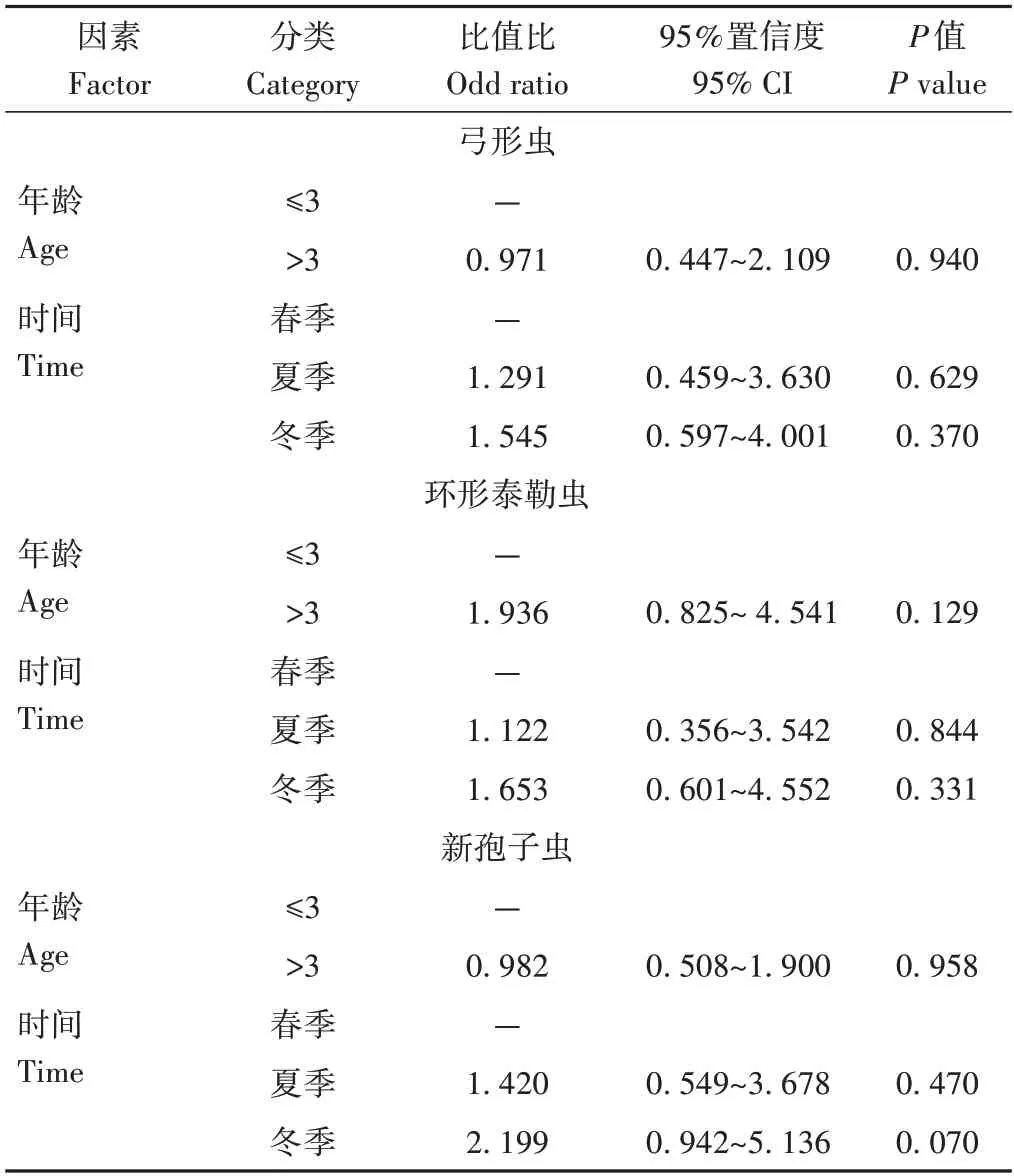
表6 年龄和季节与牦牛感染弓形虫、环形泰勒虫和新孢子虫的风险关系Table 6 Odds ratio of age and season of yak as risk factors for T.gondii,T.annulata and N.caninum
3 讨论
由于弓形虫与新孢子虫的混合感染加重了治疗的复杂性[20-21],加之环形泰勒虫在牛群中的普遍存在对牛具有的潜在危害[22]。为此,本研究建立了检测弓形虫、环形泰勒虫和新孢子虫的多重PCR 方法,可为预防上述3种寄生虫感染提供参考。
在多重PCR 建立过程中,引物的设计对试验的特异性和扩增效率起着至关重要的作用[23]。因此,本研究根据弓形虫、环形泰勒虫和新孢子虫的保守序列,分别设计3 对特异性引物,且扩增弓形虫(520 bp)、环形泰勒虫(341 bp)、新孢子虫(156 bp)的片段大小差异大于100 bp,便于电泳后观察条带。此外,对多重PCR反应的退火温度、循环数进行优化[24]。本试验首先优化单重PCR 反应体系,确定多重PCR 反应体系中最佳循环数为35个循环,最佳退火温度为57 ℃,并且弓形虫、环形泰勒虫和新孢子虫最低检出下限分别达到0.01、0.02和0.01 ng·μL-1,成功建立了弓形虫、环形泰勒虫和新孢子虫3种常见寄生虫的多重PCR检测方法。
本研究应用该多重PCR 检测方法,对甘南地区2021年采集的629份样品进行检测,结果发现弓形虫、环形泰勒虫和新孢子虫混合感染率分别为4.29%、3.66%、5.88%,表明弓形虫、环形泰勒虫和新孢子虫在甘南牦牛中均有感染,其中新孢子虫单一阳性率最高,环形泰勒虫阳性率最低,混合感染率高达13.67%。本试验在甘南地区采集的629 份牦牛血清中,新孢子虫阳性率为5.88%,这与Koiwai等[25]对日本的2 420份牛血清进行研究,阳性率为5.8%的结果接近。赵鹏等[26]报道长春地区牛感染弓形虫的总体阳性率为6.00%;王芝英等[27]研究发现重庆市牛弓形虫平均阳性率为27.25%;而巴西米纳斯吉拉斯地区的牛弓形虫血清阳性率高达60.29%[28]。本研究发现甘南地区牦牛环形泰勒虫的阳性率为3.66%,低于其他研究,但环形泰勒虫对牛群的危害仍不能轻视。此外,本试验对甘南地区的牦牛血清检测,发现弓形虫、环形泰勒虫和新孢子虫阳性率整体低于我国各个地区的平均值[29],说明不同地区、不同国家牛群间的弓形虫、环形泰勒虫和新孢子虫感染率差异较大。甘南地区牦牛弓形虫、环形泰勒虫和新孢子虫感染水平较低的原因可能与该地区气候条件有关。甘南地处高原,大部分地区海拔在3 000 m 以上,常年气温较低,昼夜温差大,日照强烈,这些环境因素均不利于弓形虫、环形泰勒虫和新孢子虫卵囊的生长和繁殖,这与Sarvi 等[30]研究结果不同。与寒冷干燥地区相比,弓形虫卵囊通常在温暖、潮湿的气候和低海拔地区更普遍,存活时间更长[31]。对于弓形虫、环形泰勒虫和新孢子虫的混合感染,国内外研究报道较少,而本研究发现2021年甘南地区牦牛弓形虫和环形泰勒虫的混合感染率为2.23%,弓形虫和新孢子虫的混合感染率为3.50%,新孢子虫和梨形虫的混合感染率为4.13%,3 种原虫的混合感染率为3.82%,其中二重感染为混合感染的主要模式,占混合感染的9.86%。混合感染类型呈多样化,临床不易区分,传统或单一PCR 检测方法可易造成漏检和误诊。当前甘南地区牦牛3 种血液原虫的混合感染严重程度较低,混合感染的总计感染率为13.68%,应密切监测流行现状和趋势,防止牦牛出现大规模混合感染。
本研究还分析了3 种原虫血清阳性率和季节、年龄之间的关系。结果表明,随着春、夏、冬季节的变化,3 种原虫的单一感染率逐渐增加,3 种原虫均为冬季的血清阳性率最高,其次是夏季,春季血清阳性率最低。同一季节中,均表现为新孢子虫的血清阳性率最高,其次是弓形虫,环形泰勒虫血清阳性率最低,这与于晋海等[32]的研究结果相符。但风险因素分析发现季节不是牦牛感染3 种原虫的风险因子(P>0.05)。其次,弓形虫、环形泰勒虫和新孢子虫的阳性率在不同年龄之间差异不显著(P>0.05),可知年龄不是牦牛感染弓形虫、环形泰勒虫和新孢子虫的风险因素,说明3种原虫均可感染各个年龄阶段的牦牛,推测牦牛感染寄生虫的主要原因是牦牛放牧的牧场有其他动物(马、牛、狗)并与其频繁接触。不同地区的环境差异可能是造成牦牛弓形虫、环形泰勒虫和新孢子虫感染率不同的原因。
4 结论
本研究建立了一种灵敏性好、特异性强的弓形虫、环形泰勒虫和新孢子虫多重PCR 检测方法,并对甘肃省甘南地区牦牛感染弓形虫、环形泰勒虫和新孢子虫进行了流行病学调查,其混合感染率为13.68%,在风险因素方面,耗牛感染3 种血液原虫均与季节、年龄无关。
