糖肾方通过调节脂质自噬减少非酒精性脂肪性肝病小鼠肝脏脂质沉积
2023-03-08杨景舒赵海玲孙秋月武曦蔼龚文心程思益
杨景舒,杨 猛,李 平,赵海玲,孙秋月,武曦蔼,杨 鑫,张 韫,龚文心,程思益,李 忻*
(1.北京中医药大学 中日友好医院临床医学院,北京 100029;2.中日友好医院 普外乳甲外科,北京 100029;3.中日友好医院临床医学研究所,北京 100029;4.中日友好医院 内分泌科二病区,北京 100029)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指排除过量饮酒史而出现肝细胞内脂质代谢紊乱和脂肪蓄积,常伴有肥胖、糖尿病、高脂血症、高血压等代谢异常[1]。研究显示,全球NAFLD 患者占总人口的32.4%,且呈现持续增长的趋势[2]。目前,NAFLD 的病因尚不明确,临床上没有标准的治疗药物,流行病学调查研究结果认为其可能与遗传、饮食结构、运动缺乏和菌群失调等因素有关[3]。自噬是一种自我降解过程,通过消除多余的细胞器或大分子物质来维持细胞和生物体稳态。自噬的功能异常与糖尿病、肥胖、NAFLD、高脂血症等多种代谢疾病相关[4]。研究表明,自噬障碍能够引起肝脏脂质沉积,导致NAFLD 发生[5]。鉴于自噬在NAFLD 中的关键作用,调节自噬可能是治疗NAFLD的潜在策略。
糖肾方颗粒剂(Tangshen Formula,TSF)由黄芪、生地黄、山茱萸、枳壳、鬼箭羽、三七和熟大黄按照一定比例配制而成,具有益气柔肝、活血通络之功效。临床研究发现,TSF 可提高糖尿病患者血清高密度脂蛋白、降低血清低密度脂蛋白及甘油三酯水平[6]。前期研究观察到TSF 可以显著减少2型糖尿病小鼠肝脏中的脂质堆积,对血清中的谷丙转氨酶(glutamic pyruvic transaminase,ALT)、谷草转氨酶(glutamic oxaloacetic transaminase,AST)等标志物进行调控,同时还能调整调节甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)的代谢失调[7],但其具体分子机制还需进一步探讨。基于此,我们使用NAFLD 小鼠模型来研究TSF对NAFLD的治疗效果和可能的机制。
1 材料
1.1 实验动物
SPF 级雄性C57BL/6J 小鼠24 只,8 周龄,购自北京华阜康实验动物技术有限公司,许可证号:SCXK(京)2019-0008。饲养于中日友好医院临床医学研究所实验动物平台,实验动物许可证号:SYXK(京)2023-0001,湿度(55±15%)和温度(23±3°C)环境,所有实验及操作遵循《实验动物管理条例》进行。本实验通过中日友好医院临床医学研究所实验动物伦理审批,批号:zryhyy21-21-01-15。
1.2 药物与试剂
TSF 颗粒购自北京亚东制药有限公司。苏木素-伊红(HE)以及油红O 染色试剂购自索莱宝生物科技有限公司。LC3B 抗体购自美国Sigma 公司,p62 抗体购于日本MBL 公司,SIRT1、mTOR 和p-mTOR 的抗体购自美国Santa Cruz 公司和Cell Signaling Technology公司。
2 方法
2.1 实验分组及糖肾方(TSF)干预
选取健康SPF 级8 周龄C57BL/6J 小鼠24 只,适应性喂养后随机分为4 组(每组6 只):对照组(ND)、对照+TSF 组(ND+TSF)、模型组(HFD)、模型+TSF 组(HFD+TSF)。对照组和对照+TSF 组小鼠给予正常饮食(normal diet,ND),模型组和模型+TSF 组小鼠给予高脂饮食(high fat diet,HFD)。各组小鼠均自由获得饮用水及食物。造模4周后对ND+TSF组、HFD+TSF组小鼠进行TSF(2.4g/kg/d)灌胃,治疗12周。实验结束前,所有小鼠被禁食12h后处置,采集血清和肝脏组织。
2.2 肝组织病理学检测
HE 染色:小鼠肝脏右叶浸泡于4%多聚甲醛溶液中固定24h。随后,将组织包埋在石蜡中,并进一步切割成厚度约为5μm 的薄片。用HE 进行染色处理。染色完成后的切片经过脱水和封闭步骤后在显微镜下观察。
油红O染色:将冷冻包埋的肝脏组织冰冻切片干燥处理后,切片用油红O 浸染20min,使用60%的异丙醇溶液分化,再用苏木素染色小鼠肝脏组织中的细胞核1min 并进行返蓝处理。染色完成后,用甘油封闭切片,并在显微镜下进行观察。
2.3 血清生化指标检测
各组小鼠采用1%戊巴比妥钠腹腔注射麻醉后眼球取血,离心分离血清,全自动生化分析仪测定小鼠血清ALT、AST、TC和TG的表达水平。
2.4 Western Blot检测自噬相关蛋白表达
采用免疫印迹法(Western blot)检测自噬标记物LC3B-Ⅰ/Ⅱ、自噬底物p62、沉默信息调节因子(silent information regulator 1,SIRT1)及自噬上游关键分子mTOR 等的表达。每个样本肝组织称取50mg,并采用RIPA 裂解液对其进行完全裂解。完成后,对样本进行离心后取上清液,进一步使用BCA 方法评估其蛋白含量。随后,采用6%~12.5%的SDS-PAGE 凝胶对蛋白进行电泳分离,并将其转移到PVDF 膜上。5%脱脂奶粉对PVDF膜室温封闭2h,在常温下分别加入β-actin(1∶3000)、LC3B(1∶2000)、P62(1∶2000)、SIRT1(1∶1000)、p-mTOR(1∶1000)和mTOR(1∶1000)抗体孵育2h。放置摇床上使用TBST 洗涤后,加入二抗IgG 抗体(1∶3000),在常温下孵育1.5h。TBST洗涤后,用ECL 试剂进行显影,并通过Bio-Rad 设备获取图像。最后,采用ImageJ 软件分析条带的灰度值,以β-actin 作为参照标准,目标蛋白表达以相对灰度表示。
2.5 统计学方法
本实验所得数据采用GraphPad Prism 8.3 软件进行统计分析,以均数±标准误差表示,多组间比较用One-way ANOVA 检验分析,方差分析有统计学意义时采用Tukey 法进行两两比较。P<0.05认为具有统计学意义。
3 结果
3.1 糖肾方(TSF)对NAFLD 小鼠血清ALT、AST、 TC和TG水平的影响
与正常饲料喂养的ND 组小鼠相比,高脂饲料喂养的HFD 组小鼠血清中的ALT、AST、TC 和TG 水平明显升高,(P<0.05,P<0.01);与HFD 组比较,HFD+TSF 组的ALT、AST、TC 和TG 水平显著降低(P<0.05,P<0.01),见表1。
表1 TSF对NAFLD小鼠血生化水平的影响(n=6,±s)
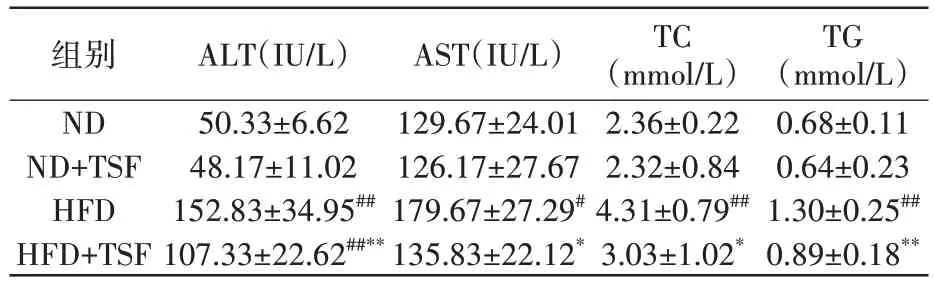
表1 TSF对NAFLD小鼠血生化水平的影响(n=6,±s)
注:与ND 组比较,# P<0.05,## P<0.01;HFD+TSF 组与HFD 组比较,* P<0.05,** P<0.01
TC(mmol/L)2.36±0.22 2.32±0.84 4.31±0.79##3.03±1.02*TG(mmol/L)0.68±0.11 0.64±0.23 1.30±0.25##0.89±0.18**组别ND ND+TSF HFD HFD+TSF ALT(IU/L)50.33±6.62 48.17±11.02 152.83±34.95##107.33±22.62##**AST(IU/L)129.67±24.01 126.17±27.67 179.67±27.29#135.83±22.12*
3.2 糖肾方(TSF)对NAFLD 小鼠肝组织病理形态学的影响
HE染色显示,ND 组中的肝细胞结构完好,从中央静脉开始向外辐射,整齐有序地排列,肝小叶的形态清晰。而HFD 组的小鼠肝小叶结构损坏、界限模糊,且肝细胞变得肿大,出现脂肪空泡以及炎症细胞渗透和部分肝细胞坏死。HFD+TSF 组的小鼠肝细胞形态相对于HFD 组有明显改善,其病理损伤较轻,脂肪空泡数量和大小都显著减少。见图1(封三)。
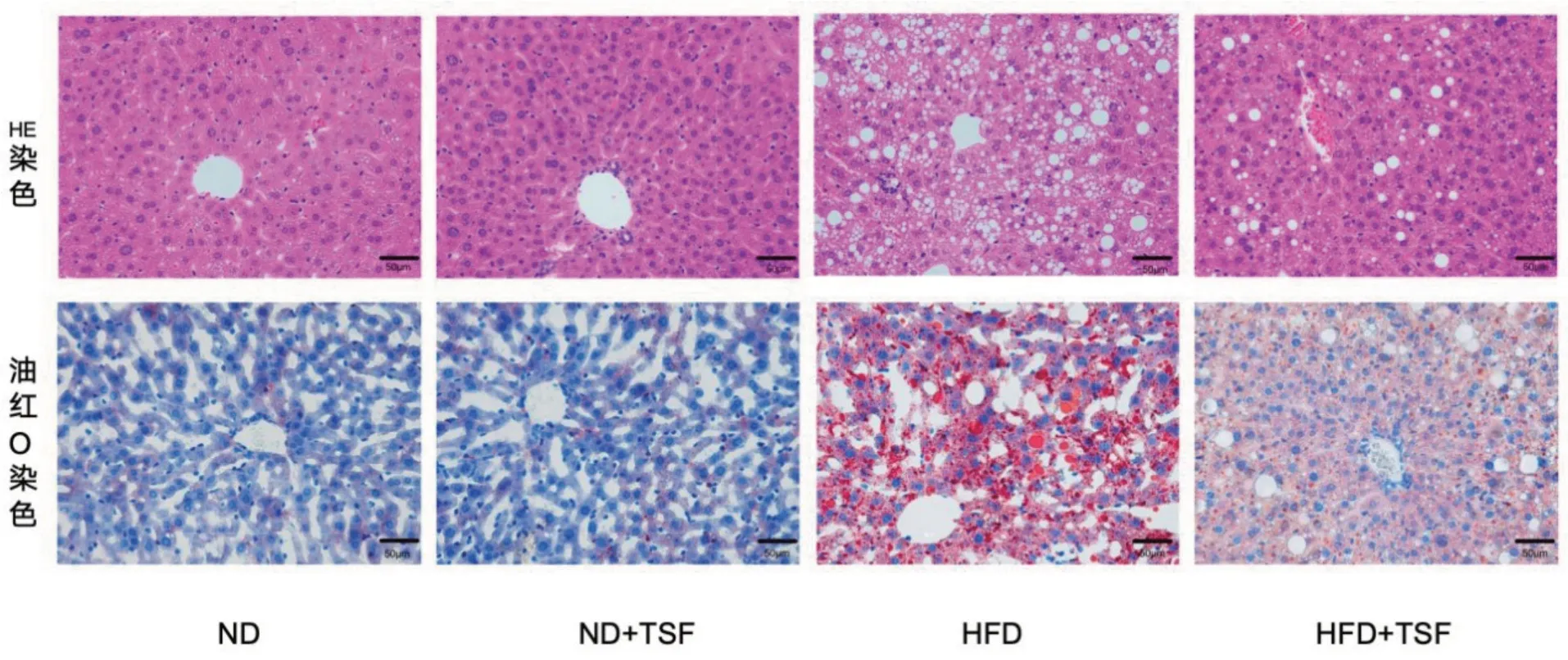
图1 各组小鼠肝组织病理形态变化 (×400)
在油红O 染色中,ND 组小鼠肝细胞结构正常,胞质呈淡蓝色,基本没有橙红色的脂滴;HFD组肝组织中广泛分布有大量、体积较大的橙红色脂滴,其中部分脂滴甚至融合成片状,说明肝组织中有严重的脂质沉积;相较于HFD 组,HFD+TSF组的肝脏脂质沉积明显减轻,见图1(封三)。
3.3 糖肾方(TSF)对NAFLD 小鼠肝组织自噬相关蛋白表达的影响
Western blot 结果显示,与ND 组相比,HFD组肝脏SIRT1、LC3B-Ⅱ蛋白表达水平明显下降(P<0.01),p-mTOR、p62 蛋白表达水平明显上调(P<0.01);经过TSF处理后,与HFD组相比,HFD+TSF 组小鼠肝脏p-mTOR/mTOR 蛋白表达水平比值和SIRT1、LC3B-Ⅱ、p62 蛋白表达水平得到恢复(P<0.05,P<0.01),见表2、图2。
表2 TSF对自噬相关蛋白表达的影响 (n=6,±s)
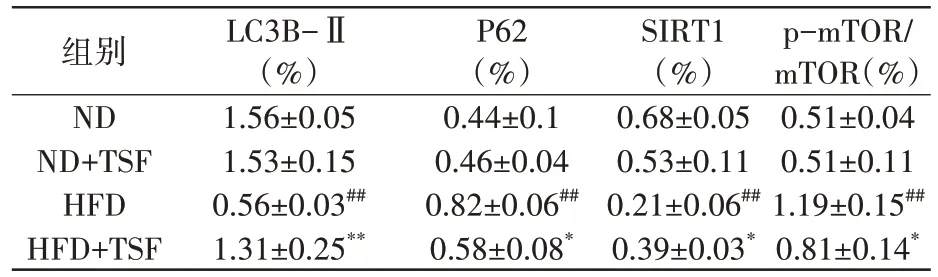
表2 TSF对自噬相关蛋白表达的影响 (n=6,±s)
注:HFD 组与ND 组比较,## P<0.01;HFD+TSF 组与HFD 组比较,* P<0.05,** P<0.01
LC3B-Ⅱ(%)1.56±0.05 1.53±0.15 0.56±0.03##1.31±0.25**P62(%)0.44±0.1 0.46±0.04 0.82±0.06##0.58±0.08*SIRT1(%)0.68±0.05 0.53±0.11 0.21±0.06##0.39±0.03*p-mTOR/mTOR(%)0.51±0.04 0.51±0.11 1.19±0.15##0.81±0.14*组别ND ND+TSF HFD HFD+TSF
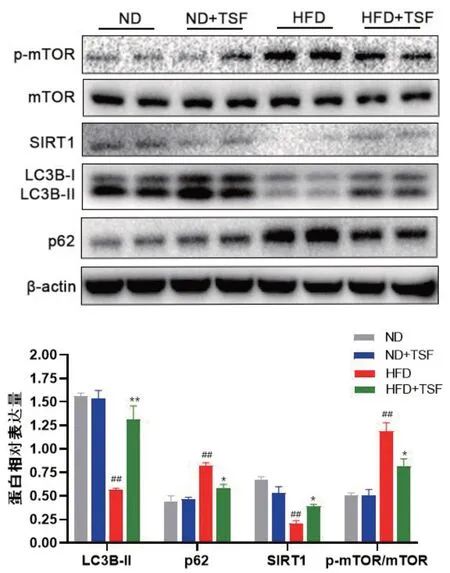
图2 TSF对自噬相关蛋白表达影响的Western blot结果
4 讨论
NAFLD 是一种复杂的慢性肝病,常与肥胖、糖尿病和高脂血症等疾病密切相关,其发病率逐年增加。对于NAFLD,西医尚无有效的药物治疗,治疗多为干预生活方式及调节代谢水平,但治疗效果不佳,因此寻找有效的治疗手段日益迫切。中医学并无NAFLD 这一病名,根据NAFLD 的临床表现可将此病归属“肝癖”“肋痛”“肥胖”等病症范畴[8]。此类疾病常因饮食不节,劳逸失常等诱发,病机总属本虚标实,以脏腑功能失调为本,痰湿瘀为标,气机运行不畅,脂肪积聚于肝脏,进而形成脂质沉积[9]。治疗NAFLD 可使用益气柔肝,活血通络的方法[10]。TSF 以黄芪为君,补气升阳,利水消肿;生地清热凉血,三七与鬼箭羽活血化瘀,逐血通经,大黄清热泻火,凉血解毒,四药为臣,与黄芪共奏阴阳调剂,补而不行滞;山萸肉、枳壳为佐药,二者收敛固涩,理气行滞,共同调畅气机[11]。方中三补四泻,起到扶正祛邪,攻补兼用的功效,既补气阴之不足又祛瘀浊之有余,达到益气柔肝、活血通络之效[12]。在本次实验中,我们使用高脂饮食喂养的方法构建NAFLD 小鼠模型。模型组小鼠血清中ALT、AST、TC 和TG 的水平明显提高,其肝脏组织出现炎性浸润、脂肪变性和脂质沉积等病理变化,这些指标均提示模型建立成功。实验数据进一步显示,糖肾方(TSF)能有效降低NAFLD 小鼠的血生化指标,并减轻其肝脏中的脂肪积累,证实具有益气柔肝、活血通络作用的TSF对NAFLD模型小鼠疗效显著。
尽管已有大量研究关注NAFLD 的发病原因,但其确切的发病机制尚不完全清楚[13]。近年来,自噬在NAFLD 的发病机制中的作用受到了广泛关注。自噬是溶酶体介导的细胞内降解途径,在维持肝脏代谢稳定方面发挥着关键作用[14]。mTOR 为自噬的负调节剂,通过影响自噬体的形成来抑制自噬的发生[4],在细胞处于饥饿状态下,mTOR 活化被抑制,促进细胞自噬,以回收再利用细胞内的营养物质[15]。SIRT1 是去乙酰化酶的一种,能够直接脱酸化自噬相关蛋白,如Atg5,Atg7和Atg8,进而促进自噬体的形成。SIRT1 通过抑制mTOR 信号途径来增强自噬。mTOR 是一个抑制自噬的关键蛋白,SIRT1 通过抑制其活性从而促进自噬的启动[16]。位于细胞核中的LC3B-Ⅰ被SIRT1 脱乙酰化,去乙酰化的LC3B-Ⅰ输出到细胞质中被转化为LC3B-Ⅱ,LC3B-Ⅱ是自噬膜形成的标志[17]。p62 是与LC3B-Ⅱ结合后被降解的产物,当自噬体与溶酶体之间的融合受到抑制时,会观察到p62 的积累[18]。既往研究表明,NAFLD患者和动物模型研究证实了自噬障碍与肝脏脂质沉积密切相关[19]。本研究结果发现,NAFLD 小鼠肝脏组织中,SIRT1、LC3B-Ⅱ蛋白表达水平明显下降,p-mTOR、p62 水平显著升高。TSF 干预后,各蛋白表达水平均明显恢复,提示TSF 可能通过增强自噬改善肝细胞脂肪累积及肝脏破坏程度。
本研究表明TSF 可通过调节自噬来减少NAFLD 小鼠的肝脏脂肪积累,改善肝功能异常。尽管如此,TSF 调控自噬改善NAFLD 的确切机制尚待进一步研究,其发挥主要治疗作用的药效物质基础还尚不明确,需要进行更系统的研究,揭示其疗效机制,为TSF的临床应用提供研究依据。
