SMILE与FS-LASIK治疗高度近视散光患者5年疗效对比△
2023-03-07夏丽坤刘鹤南
马 晶 夏丽坤 刘鹤南
飞秒激光技术在屈光领域的广泛应用使角膜屈光手术向微创甚至无创方向发展,其中具有代表性的术式包括飞秒激光辅助准分子激光原位角膜磨镶术(FS-LASIK)和飞秒激光小切口角膜基质透镜取出术(SMILE)。已有较多文献报道证实了FS-LASIK和SMILE矫正近视及散光的有效性和安全性[1-2],在两者的对比中,SMILE显示出一定的优势,但随访时间一般为6个月~3年,缺乏更长期的随访。此外,有研究显示,高度近视患者术前角膜越陡,过度矫正越明显[3],提示术后屈光状态可能与术前屈光度相关。我们曾初步对比研究了FS-LASIK和SMILE 矫治高度近视散光患者3年的临床效果[4],本研究即在前期成果的基础上,进一步随访,得到了术后5年的观察数据,现将结果报告如下。
1 资料与方法
1.1 一般资料前瞻性非随机对照研究。本试验纳入2013年1月至2015年1月于中国医科大学附属盛京医院自愿接受SMILE或FS-LASIK的患者,所纳入患者均知晓手术过程、风险及获益,并签署知情同意书。纳入标准:年龄18~40周岁;中央角膜厚度(CCT)≥500 μm,预期剩余角膜基质床厚度≥280 μm;过去1年内屈光度改变量在±0.50 D以内;最佳矫正远视力(BCDVA)在20/20及以上;球镜度为-6.0~-10.0 D,柱镜度为-3.5~0 D;术前14 d停戴软性角膜接触镜,术前3个月停戴硬性角膜接触镜;随访期内按时复查,数据记录完整。排除标准:已确诊及可疑的圆锥角膜及其他角膜扩张性疾病;活动性的眼部感染及炎症反应;重度干眼以及全身结缔组织疾病、自身免疫疾病;严重影响视力的白内障、尚未控制的青光眼、严重的眼底疾病以及角膜斑翳等屈光不正以外的其他严重眼病;合并认知功能障碍或焦虑、抑郁等严重心理、精神疾病。本试验符合《赫尔辛基宣言》原则,通过中国医科大学附属盛京医院伦理委员会审批(伦理批号:2021PS062K)。
1.2 术前准备术前检查包括裸眼远视力(UDVA)、小瞳及散瞳验光检查、BCDVA、眼压、CCT、角膜地形图检查、像差检查、对比敏感度(CS)、眼轴长度、角膜内皮镜、干眼系列检查及眼底检查等。术前3 d常规使用5g·L-1左氧氟沙星滴眼液(参天制药,日本)及1 g·L-1玻璃酸钠滴眼液(参天制药,日本)滴眼,均为每天4次,每次1滴。术前行结膜囊冲洗及眼周消毒。
1.3 手术过程
1.3.1 SMILE所有手术均由同一位医师使用同一台飞秒激光设备(Carl Zeiss,VisuMax,德国)完成。术中设置双层扫描模式制作完整的角膜基质透镜和帽,通过小切口分离角膜透镜的上、下层,取出透镜,平衡盐液冲洗角膜帽下及结膜囊,术毕。参数设置:激光脉冲频率为500 kHz,能量为175 nJ,微透镜的直径为 6.5 mm,角膜帽的直径为7.6 mm,帽的厚度为110 μm,边切口长度为2 mm,切口位置选 90°。
1.3.2 FS-LASIK所有手术均由同一位医师使用同一台飞秒激光设备(Carl Zeiss,VisuMax,德国)和同一台准分子激光设备(Carl Zeiss,MEL 80TM,德国)完成。术中使用飞秒激光设备完成角膜瓣的制作,将患者头部转至准分子激光设备下,掀开角膜瓣,用准分子激光在角膜基质床进行屈光性消融,然后再将角膜瓣复位,完成FS-LASIK。参数设置:飞秒激光脉冲频率为 500 kHz,能量为 175 nJ,角膜瓣的直径为7.9 mm,瓣的厚度为110 μm,准分子激光切削光学区直径为6.0 mm,过渡区直径为2.0 mm。
1.4 随访时间及项目术后1个月、3个月、6个月和1年、3年、5年随访。UDVA 和 BCDVA转换为logMAR视力进行统计学分析。用验光仪(Topcon,auto refractometer RM8800,日本)检查球镜度和柱镜度,并按照等效球镜度(SE)= 球镜度+1/2柱镜度,统计分析SE的变化。采用矢量分析描述散光的变化,记算目标矫正散光量(TIA)、手术矫正散光量(SIA)、差异矢量(DV)、 误差角度(AofE)和矫正指数(Correction Index)。用波前像差仪(Carl Zeiss,WASCA Analyser,德国)测量各像差值,包括总高阶段像差(HOAs)、球差和彗差。像差检查在暗适应下进行,记录瞳孔直径6 mm以上的数据,以均方根值(RMS)统计。干眼检查:包括泪液分泌功能、泪膜破裂时间(TBUT)和眼表疾病指数量表(OSDI)评分。
1.5 术后用药两组患者术后1周均常规使用5 g·L-1左氧氟沙星滴眼液滴眼,之后停药。术后第1周使用1 g·L-1氟米龙滴眼液滴眼,每天4次,每次1滴,之后每周减少1滴,直至28 d停药。术后3个月常规使用1 g·L-1玻璃酸钠滴眼液滴眼,每天4次,每次1滴。
2 结果
2.1 一般情况所有纳入患者均顺利完成手术,并能按时复查,术后复查均未见严重并发症发生。两组患者术前一般资料见表1,SMILE组共纳入35例(70眼),男21例,女14例;FS-LASIK组共纳入30例(59眼),男18例,女12例。独立样本t检验结果显示,2组患者术前年龄、SE、球镜度、柱镜度、CCT和BCDVA的差异均无统计学意义(均为P>0.05)。
表1 SMILE组和FS-LASIK组患者术前一般资料对比
2.2 视力和屈光情况
2.2.1 UDVA重复测量资料的方差分析结果显示,SMILE组和FS-LASIK组患者组内不同时间点UDVA相比差异均有统计学意义(均为P<0.05)。LSD-t检验结果显示,SMILE组、FS-LASIK组患者术后各时间点的UDVA均较术前明显提高(均为P<0.05),术后各时间点两两比较,差异均无统计学意义(均为P>0.05)(图1A)。
2.2.2 BCDVA重复测量资料的方差分析结果显示,SMILE组和FS-LASIK组患者组内不同时间点BCDVA相比差异均无统计学意义(均为P>0.05)(图1B)。SMILE组患者视力提高2行者1眼(1.4%),提高1行者4眼(5.7%),视力不变者65眼(92.9%)。 FS-LASIK组患者视力提高1行者3眼(5.1%),视力不变者55眼(93.2%),视力丢失1行者1眼(1.7%),2组患者均未见视力丢失2行或以上者。
2.2.3 SE重复测量资料的方差分析结果显示,SMILE组和FS-LASIK组患者组内不同时间点SE相比差异均有统计学意义(均为P<0.05)。LSD-t检验结果显示,SMILE组、FS-LASIK组患者术后各个时间点的SE均较术前明显降低,差异均有统计学意义(均为P<0.05)。独立样本t检验显示,SMILE组患者术后1个月的SE低于FS-LASIK组,SMILE组患者术后1~5年的SE均高于FS-LASIK组,差异均有统计学意义(均为P<0.05),SMILE组患者术后1个月~5年SE的变化量为 (0.15±0.78) D,明显低于FS-LASIK组患者术后1个月~5年SE的变化量(0.94±0.84) D,差异均有统计学意义(t=5.868,P=0.000)(图1C)。
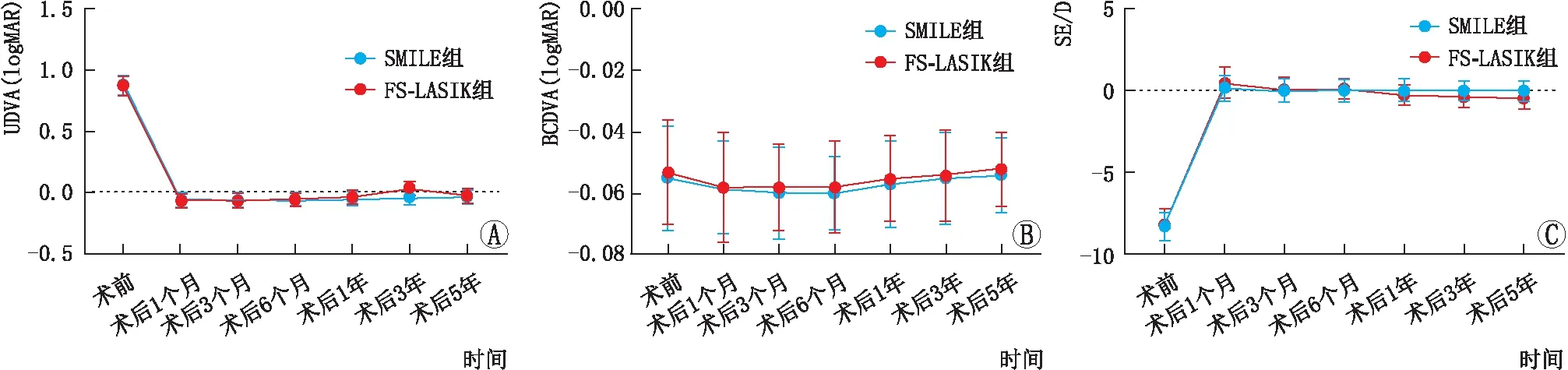
图1 SMILE组和FS-LASIK组患者术前及术后不同时间点UDVA、BCDVA和SE A:UDVA;B:BCDVA;C:SE。
2.2.4 散光重复测量资料的方差分析结果显示,SMILE组和FS-LASIK组患者组内不同时间点散光相比差异均无统计学意义(均为P>0.05)。2组患者术后5年散光矢量分析数据见表2,2组患者间各参数相比差异均无统计学意义(均为P>0.05)。
表2 SMILE组和FS-LASIK组患者术后5年散光
2.3 像差
2.3.1 HOAs重复测量资料的方差分析显示,SMILE组和FS-LASIK组患者组内不同时间点HOAs相比差异均有统计学意义(均为P< 0.05)。LSD-t检验结果显示,SMILE组患者术后1个月和3个月的HOAs均较术前明显升高(均为P<0.05),术后6个月恢复至术前水平(P>0.05);FS-LASIK组患者术后各个时间点的HOAs均较术前明显升高(均为P<0.05),术后各时间点间两两比较差异均无统计学意义(均为P>0.05)。独立样本t检验显示,SMILE组患者术后3~6个月、3~5年时HOAs均明显低于FS-LASIK组(均为P<0.05),其余时间点两组患者间HOAs相比差异均无统计学意义(均为P>0.05)(图2A)。
2.3.2 球差重复测量资料的方差分析显示,SMILE组和FS-LASIK组患者组内不同时间点间球差相比差异均有统计学意义(均为P<0.05)。LSD-t检验结果显示,SMILE组患者术后各时间点的球差均较术前明显改变,术后5年仍未恢复至术前水平(均为P<0.05),但术后3~5年均较术后1~6个月的球差绝对值明显减小(均为P<0.05);FS-LASIK组患者术后各时间点的球差均较术前明显改变,术后5年仍未恢复至术前水平(均为P<0.05),但术后1~5年较术后1~6个月的球差绝对值均明显减小(均为P<0.05)。独立样本t检验显示,SMILE组患者术后3~5年的球差绝对值均明显低于FS-LASIK组(P<0.05),2组患者间其余时间点球差绝对值相比差异均无统计意义(均为P>0.05)(图2B)。
2.3.3 彗差重复测量资料的方差分析显示,SMILE组和FS-LASIK组患者组内不同时间点彗差相比差异均有统计学意义(均为P<0.05)。LSD-t检验结果显示,SMILE组患者术后各时间点的彗差均较术前明显升高,术后5年仍未恢复至术前水平(均为P<0.05);FS-LASIK组患者术后1个月~3年的彗差均较术前明显升高(均为P<0.05),但术后5年时恢复至术前水平(P>0.05)。独立样本t检验显示,SMILE组患者术后1个月、1~5年的彗差均高于FS-LASIK组(均为P<0.05)(图2C)。
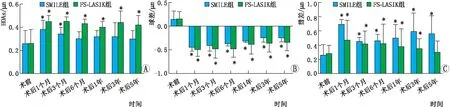
图2 SMILE组和FS-LASIK组患者术前及术后不同时间点6 mm瞳孔直径下HOAs、球差、彗差的RMS值 A:HOAs;B:球差;C:彗差。与术前相比,*P<0.05。
2.4 干眼检查
2.4.1 TBUT重复测量资料的方差分析显示,SMILE组和FS-LASIK组患者组内不同时间点TBUT相比差异均有统计学意义(均为P<0.05)。LSD-t检验结果显示,SMILE组患者术后1个月的TBUT较术前缩短(P<0.05),但术后3个月~5年均较术后1个月明显延长(均为P<0.05),并于术后3个月恢复至术前水平(均为P>0.05);FS-LASIK组患者术后1~6个月的TBUT均较术前缩短(均为P<0.05),但术后6个月~5年均较术后1个月明显延长(均为P<0.05),术后1~5年较术后3~6个月均明显延长(均为P<0.05),并于术后1年恢复至术前水平(P>0.05)。独立样本t检验显示,SMILE组术后1~6个月的TBUT均明显长于FS-LASIK组(均为P<0.05),但术后1~5年的差异均无显著统计学意义(均为P>0.05)(图3A)。
2.4.2 OSDI评分重复测量资料的方差分析显示,SMILE组和FS-LASIK组患者组内不同时间点OSDI相比差异均有统计学意义(均为P<0.05)。LSD-t检验结果显示,SMILE组患者术后1~6个月的OSDI均较术前升高(均为P<0.05),但术后1~5年均较术后1~3个月有所降低(均为P<0.05),并于术后1年恢复至术前水平(P>0.05);FS-LASIK组中术后1个月~3年的OSDI均较术前升高(均为P<0.05),术后3个月~5年均较术后1个月有所降低(均为P<0.05),术后6个月~5年均较术后3个月有所降低(较为P<0.05),并于术后5年恢复至术前水平(图3B)。
2.4.3 泪液分泌功能泪液滤纸条可能损伤角膜,为避免滤纸条影响角膜愈合,术后1个月和3个月未行泪液分泌功能试验。重复测量资料的方差分析显示,SMILE组和FS-LASIK组患者组内不同时间点泪液分泌功能相比差异均有统计学意义(均为P<0.05)。LSD-t检验结果显示,SMILE组患者术后6个月的泪液分泌功能较术前下降(P<0.05),术后1~5年均较术后6个月有所提高(均为P<0.05),并在1年时恢复至术前水平(P>0.05);FS-LASIK组患者术后6个月~1年的泪液分泌功能均较术前明显下降(均为P<0.05),术后1~5年均较术后6个月有所提高(均为P<0.05),并于术后1年恢复至术前水平(P>0.05)(图3C)。
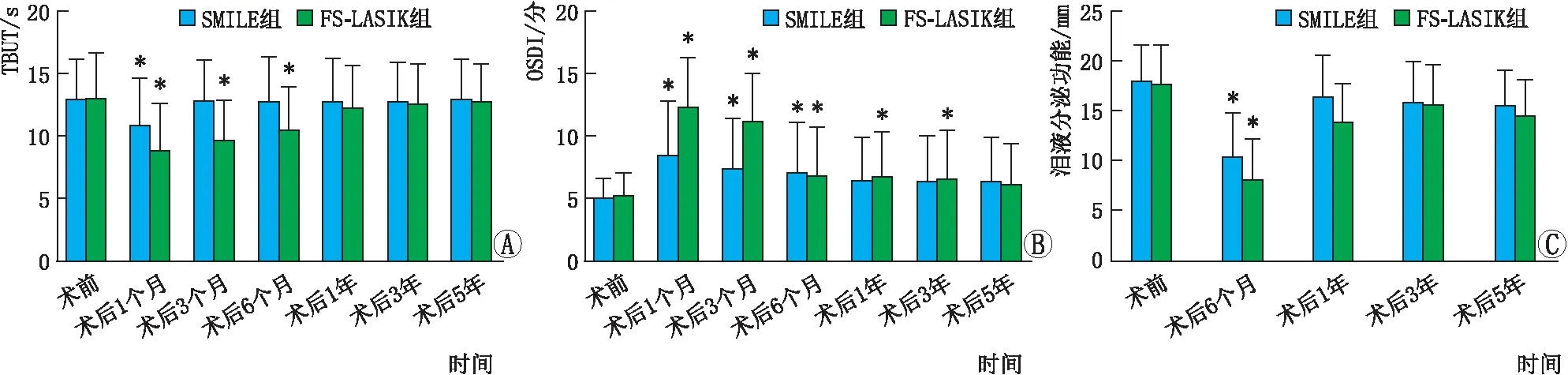
图3 SMILE组和FS-LASIK组患者术前及术后不同时间点TBUT、OSDI和泪液分泌功能 A:TBUT;B:OSDI;C:泪液分泌功能。与术前相比,*P<0.05。
3 讨论
FS-LASIK作为治疗近视和散光的一种安全有效的方法得到了临床医师和患者的广泛认可。在 FS-LASIK中,角膜瓣的制备可能会引起干眼等并发症,术后高阶像差的变化也可能导致光晕及眩光的产生[5],因此不需要制备角膜瓣的SMILE应运而生。
既往大量研究[6-7]表明,FS-LASIK和 SMILE 术后UDVA、BCDVA和SE比较差异均无统计学意义,均取得了良好的治疗效果,这与本研究结果一致,但专门针对高度近视散光的临床观察并不多见。既往有研究[7]报道了SMILE矫正高度近视3个月的临床效果,结果显示,高度和中度近视患者术后的视力情况和屈光状态相同,但随访时间太短。本文通过对比 SMILE 和FS-LASIK 治疗高度近视散光5年的临床效果,证实了SMILE比FS-LASIK拥有更长期的稳定性。这有可能是因为SMILE保留了角膜基质的前板层,而角膜基质前板层被认为是基质层最坚固的区域[8],保留其完整性对于维持角膜生物力学的稳定性具有重要作用,所以 SMILE 术后屈光度能够更稳定。
眼球的旋转可能影响散光的矫正效果。术中患者由坐位调整为平卧位,由于前庭系统的生理功能或隐蔽性轴向斜视的暴露,以及术中无意识的单眼凝视,患者会有一定的眼球转动。当旋转大于2°且未矫正时,散光矫正效果可能会受影响[9]。较早的研究[10]已经发现了角度误差的存在,Pedersen等[11]12个月的随访也证明了该角度误差并没有随时间消失。这可能是因为SMILE缺乏客观的眼动跟踪或虹膜定位系统,难以在手术显微镜下准确捕捉患者眼球轴向变化。也有研究[12]比较了SMILE和LASIK对低度、中度散光的矫正效果,发现SMILE实际散光矫正量小于LASIK。Pedersen等[11]发现,SMILE术后1年,仍有11%的患者近视散光矫正不足。为了解决这个问题,学者们想出了不同的方法。Jun等[13]在手术中使用三重定位技术以获得更好的中心定位。Alió del Barrio等[14]在对SMILE 2010年至2017年近视散光矫正进行荟萃分析后,也建议对近视散光额外增加10%的矫正。在本研究中,两组患者间术前及术后5年的散光差异均没有统计学意义(均为P>0.05),这印证了上述学者[9-14]所得出的角膜屈光术后散光欠矫的结论。此外,由于所纳入患者主要表现为高度近视,患者术前散光相对较低,而手术预期矫正的散光则更低,导致数据变化趋势并不明显;加之本研究样本量不大,散光相关数据可能在一定程度上存在统计学上的偏倚。总之,准确的术前检查、良好的手术设计和术中误差的控制对近视散光的准确矫正起着至关重要的作用。
对于像差,本研究结果发现,两组患者术后的HOAs、球差和彗差均有所增加,SMILE主要表现在彗差的增加,而引入的HOAs和球差较少,这与Sekundo等[15]、Lin等[16]和Ganesh等[17]的研究结论一致。在我们的手术设计中,SMILE的切口位于120°~150°的方向,愈合力也将角膜拉向这个方向,因此,在垂直和水平方向都引入了彗差。此外,SMILE手术过程中没有虹膜跟踪,不能准确跟随眼球的轻微旋转,常规将角膜顶点视为光学中心也可能导致彗差增加。球差主要反映角膜的非球面性。SMILE术后球差改变更少的原因可能是SMILE扫描过程中角膜始终处于负压吸引和固定状态,能量损失小,受环境影响小,表面切口小。在SMILE手术中,外周光学区角膜帽和角膜基质床的黏附更符合角膜的非球面性。而FS-LASIK手术切口较大,角膜非球面性改变较大,角膜基质床术后水肿,从而导致球差明显改变。此外,FS-LASIK术中切割基质床时使用的过渡区切割可能是影响球差的另一个重要原因[18]。
对于干眼,本研究结果显示,患者的TBUT在SMILE术后3个月逐渐恢复,而在FS-LASIK术后1年恢复。OSDI评分在SMILE术后1年恢复至术前,而在FS-LASIK术后5年恢复至术前。以上结果发现,SMILE术后干眼症状较FS-LASIK轻,恢复更快,这可能与FS-LASIK手术中角膜瓣的形成有关。角膜瓣的切削导致角膜上皮、基质层和角膜神经受损,降低了角膜的敏感性,破坏了泪膜稳定性[19]。据报道[20],角膜瓣越大,角膜蒂越小,角膜神经纤维被切断越多,术后发生干眼症的可能性越大,恢复越慢。SMILE手术只在帽边缘做2 mm的切口,不制作角膜瓣,不仅保留了角膜结构的完整性,而且对角膜神经的损伤较小[13,26],同时也最大限度地保持了角膜生物力学的稳定性[21-22]。
综上所述,SMILE与FS-LASIK在矫正高度近视散光方面具有同等的安全性和有效性,但在远期疗效方面,SMILE比FS-LASIK更稳定,术后屈光退行更少。在像差方面,SMILE引入了较少的HOAs和球差,但引入了较多的彗差。在干眼方面,SMILE后干眼症状较轻,恢复较快,患者满意度较高。但是,本研究仍有一定的局限性。首先,本研究是非随机研究,患者的意愿决定了进行哪种手术。这可能会导致我们的研究存在一定的选择偏倚。其次,我们的研究随访时间较长,且排除了出现严重并发症和临床资料收集不全的患者,这可能会在某种程度上导致数据选择的偏倚。此外,本研究纳入的患者主要表现为高度近视,而散光均相对较低,因此散光的统计结果可能存在偏差。未来还需要更严格的随机临床试验和更大样本量的研究来验证SMILE和FS-LASIK术后的长期临床效果,进而指导临床工作,造福患者。
