羊传染性脓疱灭活疫苗的制备及临床免疫效果观察
2023-03-06李璋赟金映红陈古丽
李璋赟,汪 萍,金映红,薛 晶,汪 阳,陈古丽,夏 俊*
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆畜牧科学院兽医研究所/新疆畜牧科学院动物临床医学研究中心,乌鲁木齐 830000;3.新疆农业大学动物医学学院,乌鲁木齐 830000)
羊传染性脓疱(contagiousecthyma)俗称羊口疮(orf)、羊传染性脓疱皮炎(contagiouspustular dermatitis,CPD),是由羊传染性脓疱病毒引起的人畜共患病。该病主要引起羔羊口唇等部位的皮肤、黏膜形成丘疹、脓疱、溃疡及疣状厚痂[1]。
目前还没有商用疫苗能够完全预防羊传染性脓疱病毒感染。弱毒疫苗进行皮肤划痕免疫能够预防羊传染性脓疱病毒感染[2],但存在免疫方法繁琐、保护期短的缺陷,在基层难以推广使用。使用灭活疫苗对产前孕羊进行免疫,羔羊可通过初乳获得抗体[3]产生对羊传染性脓疱的抵抗力。
1 材料与方法
1.1 细胞与病毒
羔羊睾丸细胞取自20日龄雄性羔羊睾丸;病毒为新疆畜牧科学院兽医研究所保存的羊传染性脓疱强毒株。
1.2 试剂与仪器
1.3 羔羊睾丸细胞的制备
制备细胞前配置细胞生长液,500 mL MEM培养基中加入50 mL胎牛血清和10 mL青霉素-链霉素溶液,混匀置4℃备用。
无菌采集20日龄雄性羔羊睾丸,用无菌剪刀和镊子剥离睾丸外部组织,并用MEM冲洗2~3次;将清洗完毕的睾丸组织剪碎,称重,置入无菌锥形瓶内;按净重的4倍加入0.25%胰酶消化液,置4℃冰箱消化12 h,待组织表面呈绒毛状,弃消化液,用玻璃珠振摇加入细胞生长液收集细胞悬液,细胞悬液用4层纱布过滤后1 000 rpm离心5 min,弃去上清液,用细胞培养液重悬细胞后将细胞悬液以适宜浓度培养于细胞培养瓶中,置37℃培养2~3 d即获得羔羊睾丸原代细胞。
1.4 接种病毒
接种病毒前需配置维持液,在500 mL MEM培养基中加入10 mL胎牛血清和10 mL青霉素-链霉素溶液,混匀置4℃备用。
取已生长至细胞瓶底70%的羔羊睾丸细胞,弃去培养液,用加入10 mL青霉素-链霉素溶液的MEM培养液清洗细胞2~3次。以5%的浓度接种羊传染性脓疱病毒,置37℃培养箱吸附1 h,后加入维持液,约24 h出现明显细胞病变,当细胞病变达80%时收毒,于-20℃室温反复冻融3次。
1.5 超滤膜包大小的选择及病毒液的浓缩
超滤膜的选择原则是超滤膜的孔径要小于待浓缩蛋白分子直径,一般为目标蛋白分子直径的1/5~1/3[4],为减少传染性脓疱病毒分子损失,选择使用100 KD超滤膜。
将大量培养的羊传染性脓疱病毒液用超滤膜进行10倍浓缩。将待浓缩病毒液离心后取上清液混匀,将膜包及进液管、出液管和滤出管安装完毕并与蠕动泵连接完全。打开蠕动泵,速度调整为200~300 mL/min。将待测病毒液浓缩至10倍时,将进液管从待测浓缩病毒液中取出,超滤膜包内所有液体泵入收集杯内时,关闭蠕动泵,收集杯内病毒液即为浓缩完毕的10倍浓缩病毒液。
1.6 测定病毒毒力
将正常羔羊睾丸细胞弃去培养液,加入少量胰酶清洗细胞2~3次,弃去液体后再加入胰酶溶液进行细胞消化,待培养瓶底部细胞由透明变为毛玻璃样时弃去胰酶,轻轻摇晃培养瓶,将羔羊睾丸细胞从培养瓶上摇下,加入少量细胞培养液终止胰酶反应,用移液器多次吹打细胞悬液,将细胞团块吹散。将细胞悬液加入到96孔板中,每孔加入细胞悬液100μL,轻轻摇晃96孔板,使细胞均匀分布于96孔板。置37℃,5%CO2培养箱培养24 h。收获的病毒原液和10倍浓缩病毒液用维持液做10倍梯度稀释,取8个梯度各100μL加到96孔板内,同时设定只加入维持液100μL的孔作为阴性对照,加入100μL病毒原液的孔为阳性对照。置37℃,5%CO2培养箱培养,观察细胞病变,并记录每个细胞病变孔出现的时间及稀释的浓度,用Reed-Muench法计算病毒液TCID50[5]。
1.7 制备传染性脓疱灭活疫苗
1.7.1 10倍浓缩病毒液的灭活
取浓缩后病毒液,按体积比为1∶4 000比例加入β-丙内酯灭活,4℃作用24 h,每隔3 h颠倒摇动一次,24 h后病毒液置37℃水浴2 h脱毒。取少量已灭活的羊口疮病毒液样品,接种于羔羊睾丸原代细胞和Vero细胞,观察羊睾丸原代细胞和Vero细胞是否发生病变来判断病毒液是否灭活完全。
1.7.2 灭活病毒液的乳化及相关检验
取已灭活的病毒液与法国206佐剂以1:1的比例混合,使用磁力搅拌棒以300 r/min的速度将其搅拌均匀。稳定性检验,取10 mL已乳化的疫苗加到15 mL离心管中,3 000 r/min,15 min,若无分层则可保存一年。黏度检验,取内口直径为1.2 mm的吸管,在室温下吸满1 mL乳剂,垂直放出0.4 mL所需时间作为黏度单位,若流出时间为2~6 s即为合格。将已乳化好的疫苗以接种病毒的方式接种到羔羊睾丸细胞上,若无细胞病变即疫苗安全。
1.8 免疫程序
免疫试验羊场为常发羊传染性脓疱羊场,未免疫羔羊在出生后15~30 d自然条件下发病率100%。
1.8.1 孕羊免疫程序
选取产前30 d体况良好的孕羊60只,分为A、B、C三组,每组孕羊20只,A组孕羊于产前28 d免疫一次,产前14 d免疫第二次,两次免疫均为3 mL/只。B组孕羊于产前28 d免疫一次,不进行二次免疫。C组为空白对照组,不进行免疫。
1.8.2 羔羊免疫程序
A、B、C三组孕羊产出的羔羊均分为A1、A2、A3、B1、B2、B3、C1、C2、C3九组,A1、B1、C1组羔羊分别于出生1 d和14 d注射羊传染性脓疱灭活疫苗两次,均为肌内注射2 mL/只。A2、B2、C2组羔羊于出生1 d进行一次免疫,2 mL/只。C1、C2、C3组羔羊出生后不做处理。观察羔羊免疫后60 d内的发病情况并记录。
2 结果与分析
2.1 羔羊睾丸细胞
制备的羔羊睾丸原代细胞24 h后有细胞贴壁,有明显圆形高透光悬浮细胞,部分细胞出芽明显。培养至48 h时细胞呈三角形。培养至72 h时细胞铺满T225细胞培养瓶底面,细胞界限清晰,细胞呈条索状,部分细胞可见明显漩涡状。见图1。
图1 正常羔羊睾丸原代细胞
2.2 细胞病变结果
羔羊睾丸原代细胞接种羊传染性脓疱病毒24 h后细胞边界模糊;48 h细胞核质颜色加深,细胞折光性增强,细胞间隙增大,细胞变圆,无明显漩涡状;72 h时细胞大量脱落,无明显细胞形态,细胞漩涡状完全消失不见,细胞聚集似葡萄。见图2。
图2 接种羊传染性脓疱病毒的羔羊睾丸细胞
2.3 TCID50结果
根据表1、表2统计,可计算出羊传染性脓疱病毒液TCID50效价为106.3TCID50/0.1 mL,10倍浓缩羊传染性脓疱病毒液TCID50效价为107.5TCID50/0.1 mL。

表1 羊传染性脓疱病毒液TCID50测定结果
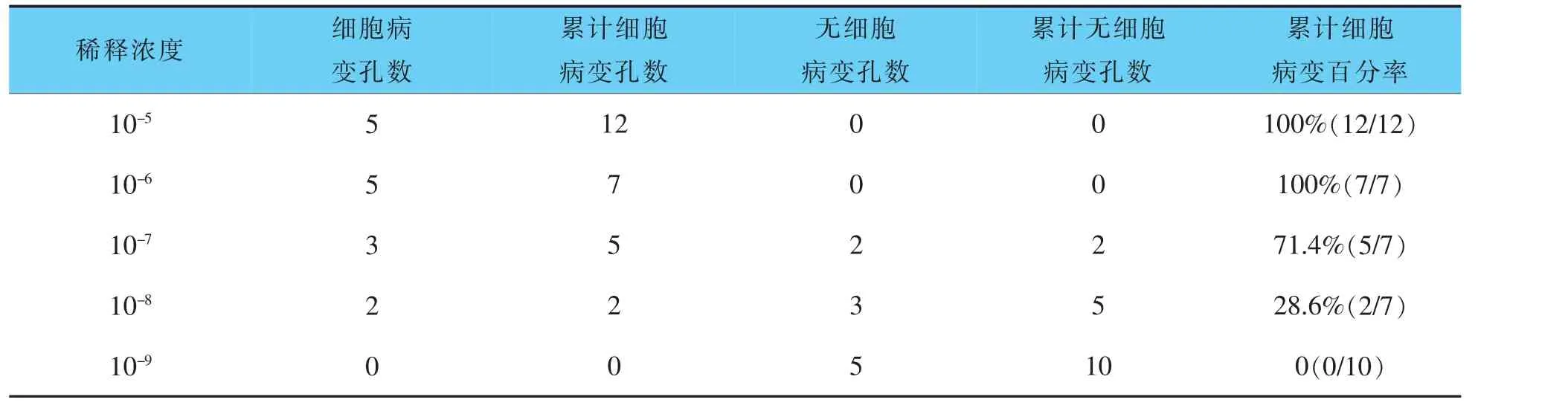
表2 10倍浓缩后的羊传染性脓疱病毒液TCID50测定结果
2.4 制备灭活疫苗结果
2.4.1 病毒液的灭活结果
10倍浓缩羊传染性脓疱病毒液灭活后接种羔羊睾丸细胞和Vero细胞并盲传三代,无细胞病变产生,证明病毒液灭活、脱毒完全。见图3、图4。
图3 灭活病毒液接种羔羊睾丸细胞
图4 灭活病毒液接种Vero细胞
2.4.2 灭活疫苗的乳化
乳化后疫苗经检测均为合格。
2.5 动物免疫试验结果
依据免疫程序进行灭活疫苗免疫后,对自然感染状态下的免疫组羔羊和对照组羔羊的发病率及发病情况进行统计,统计结果见表3。免疫组羔羊口唇部未见脓疱、痂皮等典型病变,如图5。发病羔羊口唇部有痂皮产生,口腔内有溃疡,如图6。试验结果证明本次制备的传染性脓疱灭活疫苗在正确免疫程序下能对羔羊产生保护力。
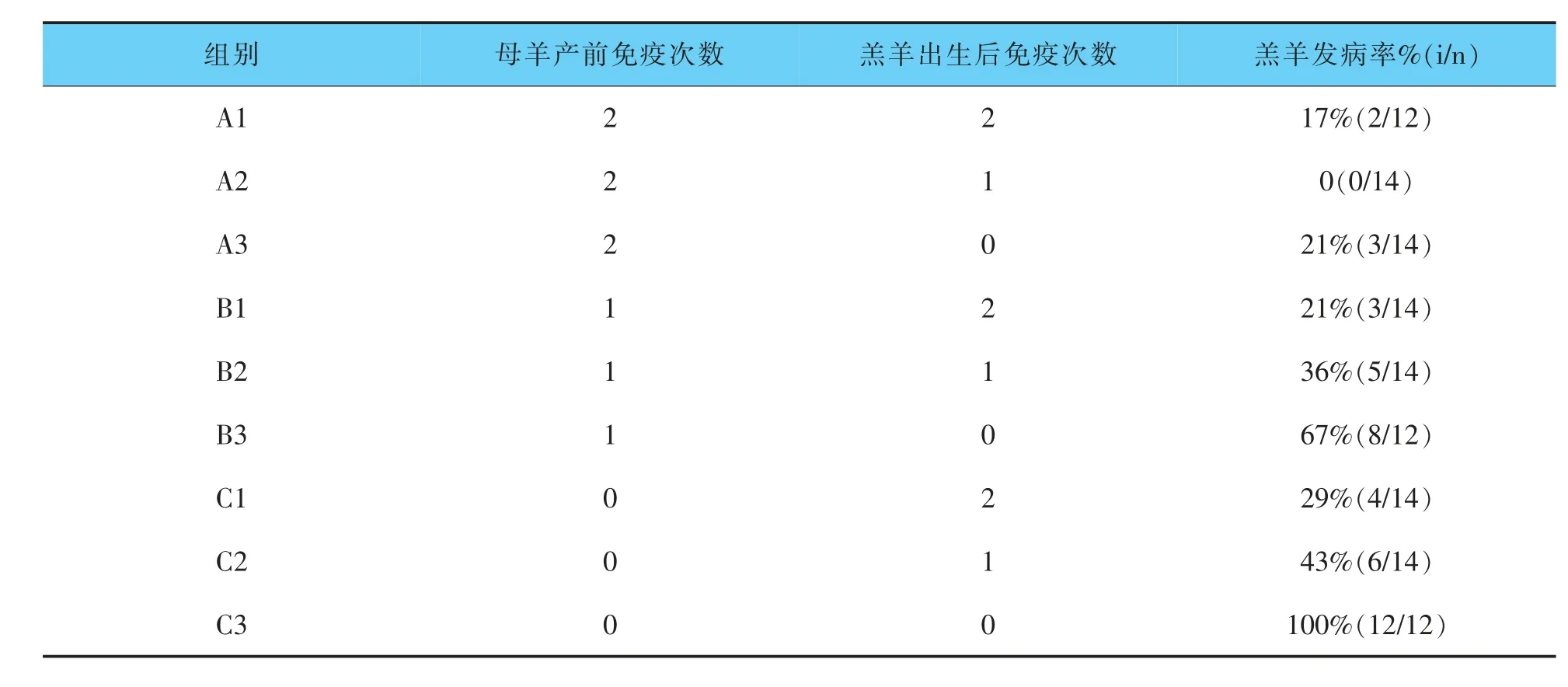
表3 羔羊发病情况

图5 免疫组未发病羔羊
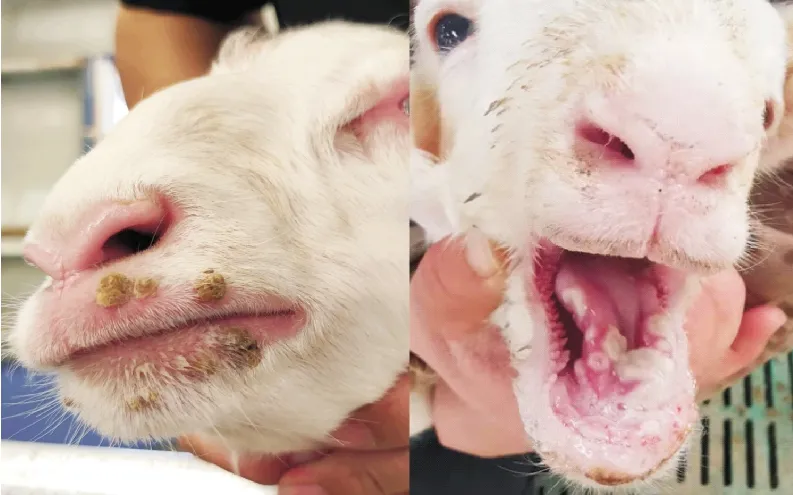
图6 未免疫组发病羔羊
3 讨 论
超滤技术是以特制超滤膜质材料为分离介质,利用滤膜的筛分性能。以超滤膜两侧压差作为推动力,在把提取液从滤膜高压一侧推至低压一侧过程中,将直径大于滤膜孔径的分子截流在高压一侧,从而克服了滤膜经常被堵塞的问题。本实验中对浓缩前后病毒液TCID50的检测可证明超滤膜浓缩对提高病毒效价效果明显。
本实验中采了1∶4 000β-丙内酯作为灭活剂进行灭活,β-丙内酯作为灭活剂可以直接作用于病毒核酸,而不作用于壳蛋白,不会破坏病毒的免疫原性;而且β-丙内酯极易水解,37℃作用2 h即可水解为无毒性的代谢产物β-羟基丙酸[6]。
羊传染性脓疱病流行于世界各地,主要影响绵羊和山羊,幼龄动物多因口腔病变造成的继发感染而致严重死亡,对养羊业造成一定的损失[7]。疫苗接种免疫是预防该病的最简便有效的解决方式。羊传染性脓疱灭活疫苗在1975年由L‘Haridon等已经证明了羔羊可以受血清抗体或母乳的保护。1978年C.LE JAN等人进行了关于预防羊传染性脓疱病时改变接种时间对哺乳期羊群初乳中免疫球蛋白有无影响的实验,结果证明:在母羊怀孕期将进行免疫,初乳中免疫球蛋白对羔羊的保护可以持续3~4周并建议在自然哺乳的状况下进行疫苗接种以保护羔羊[8]。2014年李娜用0.4%甲醛灭活传染性脓疱病毒48 h后混合201佐剂和11R佐剂对2~3月龄羔羊进行皮下注射免疫,对照组皮下注射等量生理盐水,攻毒保护试验结果证明201佐剂保护率67%,11R佐剂保护率50%,对照组全部发病[9]。2018年李星明采用0.4%甲醛灭活传染性脓疱病毒后混合转移因子铝胶盐佐剂对孕羊进行颈部皮下注射可以降低孕羊传染性脓疱病原的携带率,新生羔羊的病原携带率降低,对新生羔羊有一定的保护作用[10]。羊传染性脓疱病毒能够引起宿主强烈的免疫反应,但由于病毒中一些毒力因子和免疫调节基因的存在,使该病毒能够对宿主进行免疫调节进而发生免疫逃避[11]。
本实验中制备的灭活疫苗采用了简单安全的肌内注射,免疫接种结果显示对孕羊进行肌肉注射也可对羔羊产生有效的保护作用。
4 结 论
采用切向流超滤膜系统可有效提高病毒液效价,1∶1混合206佐剂制备的羊传染性脓疱灭活疫苗对羔羊有明显保护作用。
