桃色欧文氏菌Cp2脂多糖对紫花苜蓿幼苗生长的影响
2023-03-05张玉娟张振粉
张 宏, 黄 荣, 姚 博, 张玉娟, 张振粉
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
紫花苜蓿(Medicagosativa)因其产草量高、适口性好和适应性广等优点,素有“牧草之王”的美誉,是我国西北干旱半干旱地区种植面积最广的优质多年生豆科牧草之一,也是当今世界上种植最广泛的豆科牧草之一[1-3]。细菌性病害是导致紫花苜蓿产量损失的主要因素之一,这类致病细菌大多数为革兰氏阴性细菌(Gram-negative bacteria),如桃色欧文氏菌(Erwiniapersicina)、成团泛菌(Pantoeaagglomerans)等,它们对紫花苜蓿有致病作用,可引起紫花苜蓿芽细菌性萎蔫病、腐烂病,紫花苜蓿种子细菌性坏死病等[4]。分离于紫花苜蓿的种带细菌桃色欧文氏菌Cp2,是引起其萎蔫病的主要病原菌[5-6]。病原细菌的脂多糖(Lipopolysaccharides,LPS)、胞外多糖(Extracellular polysaccharide,EPS)等多种代谢产物是引起植物细菌性病害的重要毒力因子。
LPS也叫内毒素(Endotoxin),是革兰氏阴性细菌外膜的主要成分,是细菌代谢产物的一种,由类脂A、核心多糖和O-抗原三部分组成[7],作为一种典型的微生物相关分子模式(Microbe-associated molecular patterns,MAMP)可以诱导动植物产生免疫反应[8]。LPS低浓度时可刺激机体免疫系统,增强固有免疫功能,高浓度时会引起广泛而强烈的炎症反应[9]。研究表明,在微生物-植物相互作用中,植物识别LPS后,不仅会直接触发一些植物防御相关的反应,还会使植物组织对随后接种的植物病原细菌的反应更迅速[10]。LPS介导细菌与宿主细胞的直接接触,经LPS前处理可预防野油菜黄单胞菌变种引起的过敏反应[11-12]。促进植物生长的联合细菌巴西固氮菌(Azospirillumbrasilense) Sp245的LPS特异性地增强了小麦体细胞组织的形态发生活性[13];成团泛菌的脂多糖(PantoeaagglomeransLipopolysaccharide,LPSp)是一种低毒安全、纯度活性高的免疫增强剂[14],可以有效调节作物的生长发育进程,会影响幼苗内生细菌的多样性及数量,促进紫花苜蓿的生长和结瘤[15-16]。然而,关于桃色欧文氏菌Cp2的LPS对紫花苜蓿生长作用的研究鲜有报道。
因此,本试验以紫花苜蓿‘巨能551’品种为供试材料,测定了不同浓度桃色欧文氏菌脂多糖(ErwiniapersicinaCp2 Lipopolysaccharides,Cp2-LPSe)对紫花苜蓿幼苗生长的影响,阐明内毒素LPS对桃色欧文氏菌Cp2-LPSe浓度的响应机理,以期为Cp2-LPSe的后续研究奠定基础。
1 材料与方法
1.1 试验材料
供试菌株:菌株桃色欧文氏菌Cp2分离于紫花苜蓿种子,由甘肃农业大学草业学院牧草病理实验室提供。
供试植物种子:以甘肃农业大学牧草种质资源实验室的‘巨能551’紫花苜蓿种子为供试材料。
供试营养琼脂/液体培养基(Nutrient agar,NA/NB)[17]用于Cp2菌株的培养和短期保存。
大豆酪蛋白琼脂培养基(Tryptose soya agar,TSA/TSB)[18]主要用于Cp2的富集培养。
1.2 试验方法
1.2.1Cp2-LPSe的提取 Cp2-LPSe的提取方法参照热酚水法[19],并进行了改进。分别将Cp2菌株接种于3组1 000 mL TSB培养基中培养48 h,11 000 r·min-1离心20 min收集菌体,用磷酸缓冲液洗涤菌体两次,12 000 r·min-1离心20 min沉淀称取湿重。加入5倍体积的去离子水悬起细菌,反复冻融3次,每次液氮5 min,沸水5 min,冰上超声10 min(26℃,350 w,超5 s,间7 s,70次)。加入等体积90%苯酚溶液于磁力加热搅拌器68℃震荡混合30 min,冰上冷却5 min,4 000 r·min-1离心30 min,收集上层水相,下层酚相加入等量去离子水重复抽提1次,即68℃震荡混合30 min,冰上冷却5 min,4 000 r·min-1离心30 min,收集上层水相。合并两次水相再加苯酚重复抽提1次,即加入等体积90%苯酚溶液于68℃震荡混合30 min,冰上冷却5 min,4 000 r·min-1离心30 min,收集上层水相。
收集所有水相置于透析袋中,流水透析24 h,蒸馏水透析24 h,每5~6 h换一次水,到FeCl3检测无紫色出现为止;按每100 mL溶液加入4 g聚乙二醇6000固体的比例,将含有水相的透析袋包埋于聚乙二醇6000固体中,将溶液浓缩为原来的1/4。经冷冻干燥得到LPS粗提的样品,取10 mL的100 mmol·L-1Tris-HCL复溶,加100 μg·mL-1的DNaseⅠ和50 μg·mL-1RNase A,37℃消化过夜,而后加入终浓度为100 μg·mL-1的蛋白酶K,65℃作用2 h,100℃沸水中加热10 min,冷却至室温,12 000 r·min-1离心30 min取上清液,加入2倍体积丙酮,4℃静置过夜,4℃ 3 500 r·min-1离心15 min,沉淀称重;用无菌超纯水配成浓度为15~20 mg·mL-1溶液后超离,4℃ 12 000 r·min-1离心2 h,下层冷冻干燥,即得到Cp2-LPSe纯品,—20℃保存备用。
1.2.2发芽试验 前期准备参照《牧草种子检验规程GB/T2930.4-2001》[20],挑选籽粒饱满、无病虫害的干净种子,每个发芽瓶25粒,共5个梯度,每个梯度4个重复,共500粒种子(防止试验过程中种子遗失,应多准备100粒种子)。生长瓶[21]中加入200 mL蒸馏水和不同浓度的Cp2-LPSe,将生长瓶正面放置发芽床,高温高压灭菌锅(121℃,0.11 Mpa,21 min)灭菌。
发芽试验在无菌操作台中,根据预实验结果确定的浓度,设0 (CK),0.157,0.314,0.471,0.628 EU·mL-1Cp2-LPSe 5种浓度,每个处理4次重复,每个生长瓶接入25粒种子,在温度23℃、湿度45%、光照(23 500 lx)18 h+黑暗6 h的组培室进行培养。进一步观察各个处理下的种子生长状态,并且统计种子每天的发芽数、发芽势、发芽率和发芽指数,第14 d的鲜重、干重、苗长、根长、叶绿素和根系形态指标[15]。
1.2.3测定指标 发芽势(Sprouting potential,GP)(%)=第7 d发芽的种子数/供试种子数×100%;种子发芽率(Germination rate,GR)(%)=第10 d的发芽的种子数/25×100%;发芽指数(Germination index,GI)=∑Gt/Dt(Gt:当天的发芽数;Dt:发芽日数)。
鲜重、干重的测定:从每个生长瓶中随机取出10株幼苗进行称重,每个浓度梯度3个重复。在称鲜重时注意先用滤纸吸取表面多余水分,以精确其幼苗的鲜重。之后将所选取的幼苗放入75℃烘箱烘48 h左右称量恒重,为其干重。
根长、苗长的测定:从每个发芽瓶中随机取出4株幼苗,每个浓度梯度3个重复,共12株。从根尖到根基部的长度为根长,而从幼苗的最高部位到幼苗的根基部为苗长。
根系形态指标是将植株根系取出,整理后用根系扫描系统(WinRH120)进行扫描,然后将输出的图片使用Win-RHIZO根系分析系统软件(Regent Istruments Canada Ine)进行分析,分析后分别得出平均根直径(单个测量植株的所有根的平均直径,mm)、总根面积(单个测量植株的所有根的面积,cm2)、总根体积(单个测量植株的所有根的体积,cm3)。
叶绿素的测定则采取乙醇法测定,剪取幼苗叶片部分,称取0.1 g左右的叶片,每个浓度3个重复,将所称取叶片放入离心管中并加入25 mL95%的乙醇密封保存24 h后,将提取液稀释一定的倍数,然后用酶标仪(Gen5 CHS3.05)测定波长分别为665,649,470 nm波长下的OD值,代入公式计算叶绿素的含量[22]。叶绿素a的浓度=13.95×OD665—6.88×OD649;叶绿素b的浓度=24.96×OD649—7.32×OD665;叶绿素在叶片中的含量(mg·g-1)=色素浓度(mg·L-1)×提取浓度(mL)×稀释倍数/样品质量(g)[23]。
1.3 Cp2-LPSe活性
根据黄荣等测定CQ10-LPSp活性得出的标准曲线[16],将三次测定的样品的平均值代入到标准曲线中求得Cp2-LPSe活性为0.157 EU·mL-1。
1.4 数据分析
用Excel 2019软件进行数据的统计整理;运用SPSS 26.0统计软件进行差异性分析,比较种子处理和Cp2-LPSe浓度对种子发芽及幼苗生长的影响;运用Origin pro 2021分析指标间的相关性以及主成分,并绘图。
2 结果与分析
2.1 Cp2-LPSe提取(次数)、纯化与产率
由表1可知:Cp2在1 000 mL TSB培养基中培养48 h后,收集的平均菌体湿重8.97 g,平均纯化的Cp2-LPSe 0.38 g,平均产率为4.27%。

表1 Cp2-LPSe提取次数与产率Table 1 Cp2-LPSe extraction and yield
2.2 不同浓度的Cp2-LPSe对紫花苜蓿种子的发芽的影响
由图1可知,随着Cp2-LPSe浓度的升高,各处理下紫花苜蓿种子的发芽率和发芽势均低于对照,但差异性不显著,发芽指数随着Cp2-LPSe浓度的升高也逐渐下降,其中 0.157,0.314,0.471和0.628 EU·mL-1处理比对照分别下降了2.74%,8.26%,11.00%和13.74%,且0.314,0.471和 0.628 EU·mL-1和对照间均存在显著差异(P<0.05)。表明Cp2-LPSe处理抑制了紫花苜蓿种子的发芽。
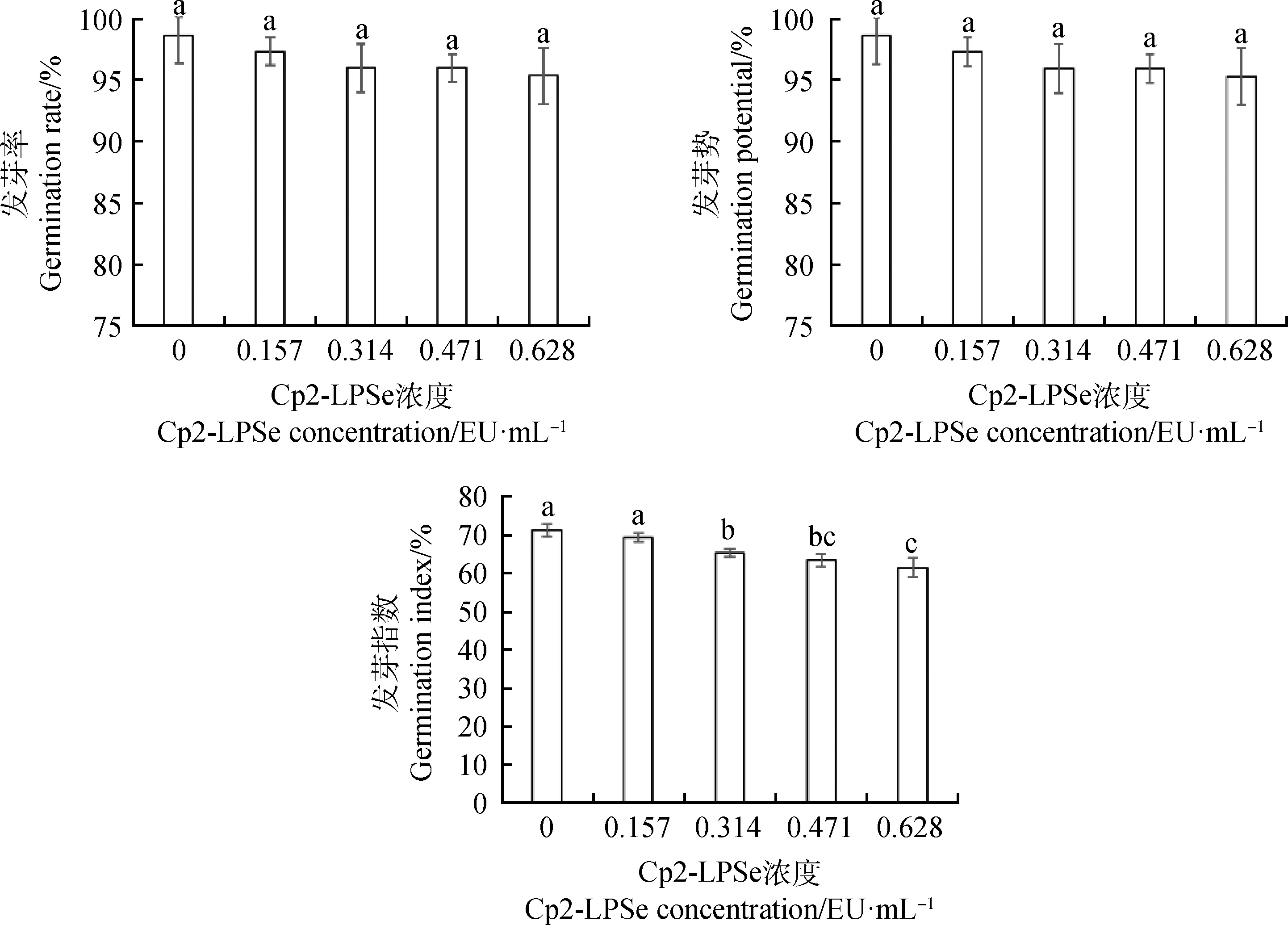
图1 紫花苜蓿在5个不同浓度Cp2-LPSe处理下发芽率、发芽势和发芽指数Fig.1 Germination rate,Germination potential,and Germination index of alfalfa seeds treated with 5 different concentrations of Cp2-LPSe注:不同小写字母表示在不同Cp2-LPSe浓度间差异显著(P<0.05)Note:Different lowercase letters indicate significant differences between different concentrations of Cp2-LPSe at the 0.05 level
2.3 不同浓度的Cp2-LPSe对紫花苜蓿幼苗生长指标的影响
2.3.1不同浓度的Cp2-LPSe对紫花苜蓿幼苗地上、地下鲜重和地上、地下干重的影响 由图2可知,各Cp2-LPSe浓度下紫花苜蓿的鲜重和干重总体呈先增加后减少的趋势,其中0.157 EU·mL-1处理较对照总鲜重、总干重分别增加了20.72%,20.22%(P<0.05);0.314,0.471和0.628 EU·mL-1处理的总鲜重比对照减少4.54%,6.28%和37.88%,总干重减少4.18%,24.86%和45.36%。表明当Cp2-LPSe的浓度为0.157 EU·mL-1时对紫花苜蓿幼苗的生长起促进作用,大于0.157 EU·mL-1时,对其幼苗的生长会产生抑制作用。
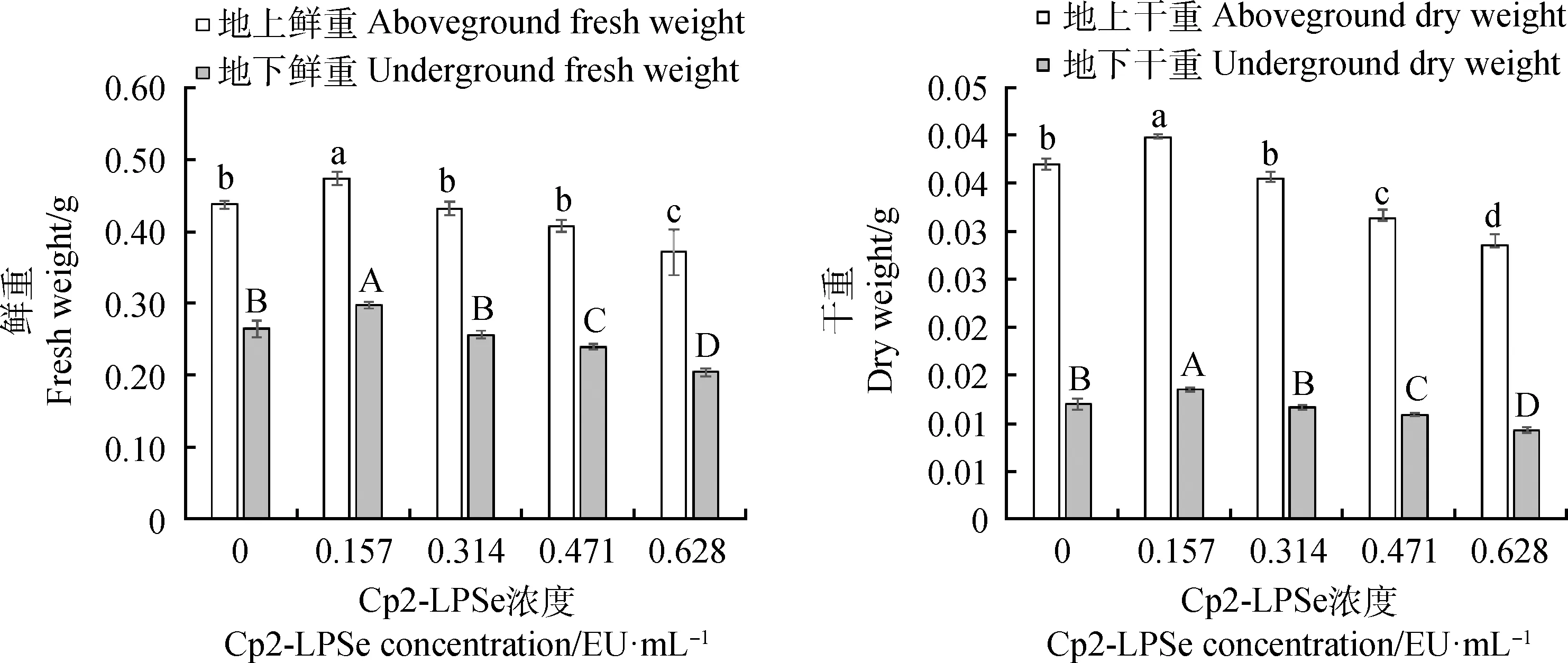
图2 紫花苜蓿在5个不同浓度Cp2-LPSe处理下的鲜重和干重Fig.2 Fresh weight and dry weight of alfalfa treated with 5 different concentrations of Cp2-LPSe注:不同小写字母表示在不同Cp2-LPSe浓度间差异显著(P<0.05);不同大写字母表示在不同Cp2-LPSe浓度间差异显著(P<0.05)Note:Different lowercase letters indicate significant differences between different concentrations of Cp2-LPSe at the 0.05 level;Different capital letters indicate significant differences between different concentrations of Cp2-LPSe at the 0.05 level
2.3.2不同浓度的Cp2-LPSe对紫花苜蓿幼苗根长、苗长、平均根直径、总根面积和总根体积的影响 由图3可知,随Cp2-LPSe浓度的升高,紫花苜蓿的根长和苗长总体呈现先增加后降低的趋势,0.157 EU·mL-1处理根长和苗长分别比对照增加了15.31%,15.51%(P<0.05),0.314,0.471和0.628 EU·mL-1处理分别比对照根长降低了15.91%,29.30%和49.36%(P<0.05),苗长分别降低了7.41%,6.93%和22.60% (P<0.05);在0.157 EU·mL-1处理下总根面积和总根体积较对照分别增加了16.17%和55.64%(P<0.05),0.314,0.471和0.628 EU·mL-1处理较对照总根面积减少了14.67%,10.76%和25.83%(P<0.05),总根体积减少了30.35%,42.78%和60.06%(P<0.05);平均根直径随Cp2-LPSe浓度的升高,各处理比对照分别增加了18.73%,5.85%,17.33%和22.48%(P<0.05);表明0.157 EU·mL-1的Cp2-LPSe对紫花苜蓿苗和根的生长产生了促进作用,超过此浓度时,随着浓度的增大,根系变短变粗,生长受到抑制。
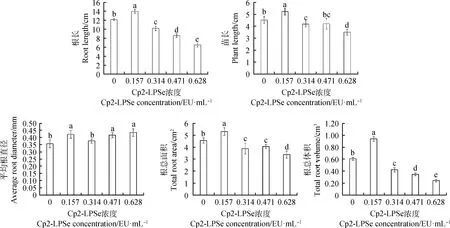
图3 紫花苜蓿在5个不同浓度Cp2-LPSe处理下根长、苗长、平均根直径、总根面积和总根体积Fig.3 Root length,plant length,mean root diameter,total root area,and total root volume of alfalfa treated with 5 different concentrations of Cp2-LPSe
2.3.3不同浓度的Cp2-LPSe对紫花苜蓿叶绿素含量的影响 由图4可知,叶绿素的含量随着Cp2-LPSe浓度升高呈现先增加后减少的趋势,0.157 EU·mL-1处理比对照的叶绿素含量上升了5.31%,0.314,0.471和0.628 EU·mL-1处理与对照相比分别下降了7.48%,14.55%,16.59%;0.314,0.471和0.628 EU·mL-1处理叶绿素含量显著低于0.157 EU·mL-1处理(P>0.05)。表明0.157 EU·mL-1的Cp2-LPSe对紫花苜蓿幼苗叶绿素的生成有促进作用,超过此浓度会抑制紫花苜蓿幼苗叶绿素的生成。
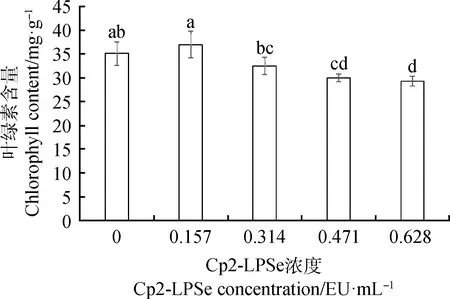
图4 紫花苜蓿在5个不同浓度Cp2-LPSe处理下的叶绿素含量Fig.4 Chlorophyll content of alfalfa treated with 5 different concentrations of Cp2-LPSe
2.4 不同浓度的Cp2-LPSe处理下紫花苜蓿各指标间的相关性分析
由图5可知,对不同浓度的Cp2-LPSe处理下紫花苜蓿各指标间的相关性分析表明,发芽率与发芽势、发芽指数呈显著正相关关系(P<0.05);地上鲜重、地下鲜重、地下干重、苗长、根总面积和根总体积,与除发芽率、发芽势、发芽指数、平均根直径外的其他9个指标呈显著正相关关系(P<0.05);地上干重、根长和叶绿素,与除发芽率、发芽势以及平均根直径外的10个指标呈显著性正相关关系(P<0.05)。平均根直径与其他12个指标间呈负相关关系。
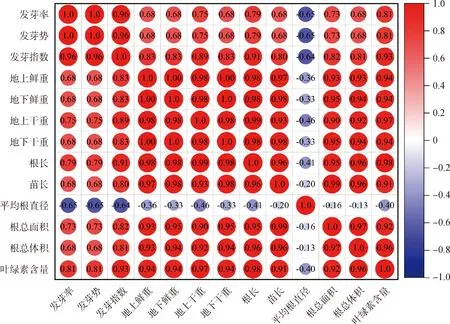
图5 不同浓度的Cp2-LPSe各指标间的相关性分析Fig.5 Correlation analysis among different concentrations of Cp2-LPSe indicators注:≥0.9表示显著相关(P<0.05)Note:≥0.9 indicates a significant correlation (P<0.05)
2.5不同浓度的Cp2-LPSe处理下紫花苜蓿各指标的主成分分析(PCA)
由图6可知,对不同浓度的Cp2-LPSe处理下紫花苜蓿各指标(苗长、根长、平均根直径、总根面积和总根体积)主成分分析(Principal component analysis,PCA)结果表明,第一主成分根长(PC1)贡献率为72.7%,第二主成分苗长(PC2)贡献率为19.9%,二者贡献率之和为92.6%,是紫花苜蓿幼苗中各指标组成差异的主要因素,可以很好的解释各指标的分布情况。0.157EU·mL-1的Cp2-LPSe与其余浓度的Cp2-LPSe没有重叠部分,相对较离散,此浓度下各指标间都呈正相关性且离散程度较小;0.471和0.628 EU·mL-1与对照虽没有重叠,但离散度不高;0.314,0.471和0.628 EU·mL-1三者相互重叠,离散度不高。表明,在两个主成分下,0.157 EU·mL-1的Cp2-LPSe对紫花苜蓿幼苗各指标都有很大的影响。
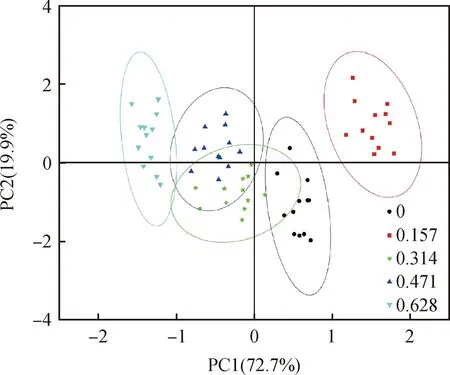
图6 不同浓度的Cp2-LPSe各指标主成分分析(PCA)Fig.6 Principal component analysis (PCA) of the alfalfa indexes under different concentrations Cp2-LPSe
3 讨论
3.1 Cp2-LPSe的提取纯化
不同的LPS提取方法对其的产率影响很大,当前通用的是改良热酚水法和细菌LPS提取试剂盒法,而热酚水法适用于大量提取,试剂盒法仅适合少量LPS提取[15]。康洁等分别用改良热酚水法、超声波处理法和煮沸法提取大肠杆菌(Escherichiacoli)脂多糖后,发现改良热酚法提取的大肠杆菌脂多糖浓度高、免疫活性强,是相对比较好的一种提取方法[24];杨成兰等、杨杰等和冯将等用改良的热酚水法分别提取天鹅源丙型副伤寒沙门氏菌(Swanhirschfeldii)、副猪嗜血杆菌(Haemophilusparasuis)和猪源大肠杆菌(Porcine-derivedcoli)的LPS,产率分别为1.48%,2.56%和3.74%[19,25-26]。在本试验中用改良的热酚水法提取Cp2-LPSe,平均产率为4.27%,高于上述三个学者所用方法,其原因主要有三点:(1)是在提取时用液氮-沸水冻融Cp2菌体,缩短了冻融所需时间;(2)是优化程序后的冰上超声更易使细胞破裂,加速Cp2细胞膜释放Cp2-LPSe;(3)是用加热磁力搅拌器使苯酚能够充分与悬浮液混合反应;经过DNase I,RNase A和蛋白酶K处理,去除DNA,RNA和蛋白质,用丙酮沉淀,得到更纯净的LPS。综上,本试验改良的热酚水法提取LPS产率较高,为LPS的提取提供了一种新的方法,也为LPS的体外互作试验提供了物质基础。
3.2 Cp2-LPSe对紫花苜蓿幼苗生长的影响
LPS作为革兰氏阴性细菌细胞膜的主要成分,是一种重要的生物类激发子[27],在病原菌和植物的相互作用中有着重要的作用,它能够增强植物预防病害侵染的能力[28]。例如来自不同细菌的LPS制剂在许多植物中诱导防御反应,能够诱导拟南芥(Arabidopsisthaliana)中活性氧的爆发与NO合成[9,29];LPS预处理会提高拟南芥对细菌侵染的抵抗力,LPS预处理也会抑制水稻(Oryzasativa)中相关感病基因的表达[30]。LPS不仅直接诱导植物防御反应,而且在细菌接种时促进或启动防御反应的早期触发,例如在LPS处理辣椒叶片后,导致其不能合成抗微生物化合物阿魏酰酪胺和对香豆酰酪胺[31-32]。LPS还可以促进细菌对植物表面的黏附,LPS缺陷突变体活细菌在体外对抗生素和抗菌肽表现出更高的敏感性,从而导致该细菌定殖植物后数量迅速下降[33]。此外,有研究发现成团泛菌LPS会影响紫花苜蓿种子的生长发育,当其浓度为0.267 EU·mL-1时,对紫花苜蓿的生长具有促进作用,浓度升高时则会抑制紫花苜蓿的生长发育[15]。
本试验证实,0.157 EU·mL-1Cp2-LPSe处理下,紫花苜蓿发芽指标与对照无显著差异,各生长指标均高于对照,0.157 EU·mL-1Cp2-LPSe使紫花苜蓿地上生物量和地下生物量增加,根系的活力也得到了提高,总生物量较对照提高了9.81%。这与Estefanía等研究发现5 μg·mL-1巴西固氮菌(Azospirillumbrasilense) Sp245 的LPS能够增加盆栽小麦叶片长度,使小麦快速生长并增加其干重相一致[34]。但当浓度超过0.157 EU·mL-1时,紫花苜蓿幼苗生长随着Cp2-LPSe浓度的增大而受到抑制,这与黄荣等低浓度成团泛菌CQ10脂多糖促进紫花苜蓿生长,高浓度则抑制紫花苜蓿生长相一致[15]。由此推测LPS对植物的生长具有双重作用,适宜浓度的LPS促进植物种子的生长发育,而高浓度LPS导致植物激素水平不平衡和活性氧过量而抑制植物种子的生长发育[35-36]。综上,0.157 EU·mL-1Cp2-LPSe可作为一种植物生长调节剂。
4 结论
本试验探究了Cp2-LPSe对紫花苜蓿幼苗生长的影响,结果表明随着Cp2-LPSe浓度的升高,紫花苜蓿幼苗的总趋势呈现先上升后下降的趋势,在0.157 EU·mL-1的Cp2-LPSe的处理下,种子的发芽情况与对照无明显差异,但幼苗的鲜重、干重、根长、苗长、叶绿素含量以及其他根系指标均高于对照;表明该处理可以促进紫花苜蓿幼苗的生长,使紫花苜蓿生物量提高了9.81%。本研究为Cp2-LPSe作为一种植物生长调节剂的开发提供理论依据与实践基础。
