受体酪氨酸激酶对子宫内膜异位症患者哺乳动物雷帕霉素靶蛋白信号通路的影响
2023-03-04易金玲吐比克孜依比力古丽胡马尔艾尼瓦尔腊晓琳
易金玲, 吐比克孜·依比力, 古丽胡马尔·艾尼瓦尔, 腊晓琳
(1. 新疆医科大学第一附属医院 生殖助孕中心, 新疆 乌鲁木齐, 830053; 2. 新疆医科大学第五附属医院 妇科, 新疆 乌鲁木齐, 830011)
子宫内膜异位症(EMS)是一种具有恶性肿瘤细胞侵袭、转移特点的常见妇科疾病[1], 在全球育龄期女性中的患病率为5%~10%[2]。EMS的临床表现包括盆腔疼痛、痛经和不孕症等,近期研究[3]表明EMS是一种全身性慢性疾病,发病机制涉及多种因素,目前尚无早期诊断的标志物,药物治疗以激素治疗为主,但个体疗效差异大,长期管理较为困难。研究[4]证实卵巢透明细胞癌和卵巢子宫内膜样癌在组织学方面与EMS密切相关。受体酪氨酸激酶(Axl)参与细胞生长、增殖、分化、黏附和迁移等过程的调节,而生长停滞特异性蛋白6(Gas6)作为Axl的配体,则具有高度结合亲和力[5]。当Axl与Gas6A结合触发下游PI3K/AKT信号通路,则能促进肿瘤细胞的侵袭和转移,因此Axl作为癌症治疗的新靶点而受到广泛关注[6]。哺乳动物雷帕霉素靶蛋白(mTOR)是多种信号通路的枢纽,可调节细胞生长、细胞周期和营养代谢过程[7],是PI3K/AKT信号通路的下游激酶之一[8]。研究[9]发现EMS患者异位内膜Gas6表达上调,但Axl在EMS患者中的表达水平却鲜有报道。本研究探讨Axl对EMS患者mTOR信号通路的影响,现报告如下。
1 资料与方法
1.1 一般资料
选择2019年1月—2021年12月新疆医科大学第五附属医院确诊卵巢子宫内膜异位囊肿患者5例为研究对象,年龄35~50岁,中位年龄38.9岁,术中切除卵巢EMS病灶取得异位子宫内膜组织,同时刮宫取得患者在位子宫内膜组织。对照组为5例健康者,年龄23~45岁,中位年龄31.4岁,也获得正常子宫内膜组织。所有患者均有规律的月经周期(27~35 d)。纳入标准: 明确诊断为卵巢EMS者,且术后病理学确诊为EMS。排除标准: ① 不明原因的不孕症者; ② 合并恶性肿瘤者; ③ 6个月内使用类固醇激素者; ④ 合并自身免疫性疾病者; ⑤ 孕妇和哺乳期妇女; ⑥ 病理标本采集不全者。本研究已通过新疆医科大学第五附属医院伦理委员会审核 (伦理审批号: XYDWFYLSK-2022-17), 所有患者入组前均被明确告知其临床信息的使用情况、标本采集的过程、实验的目的及个人信息的风险保护等,并签署知情同意书。
1.2 样本的采集与保存
手术切除即刻收集5例异位子宫内膜组织最典型部位组织以及在位内膜组织,刮取5例正常子宫内膜组织,并立即投入4 ℃灭菌盛有含青霉素、链霉素及两性霉素B的Ham′s F12/DMEM培养液的离心管中,置于干冰壶, 2 h内送入实验室进行细胞培养。
1.3 分离和培养
将收集的新鲜异位子宫内膜组织、在位子宫内膜组织和正常子宫内膜组织切碎,并分别在含有HEPES(25 mmol/mL)、1%青霉素/链霉素、胶原酶(1 g/L,酶活单位15 U/mg)和DNAse(0.1 g/L, 酶活单位1 500 U/mg)的Hank平衡盐溶液中消化。混合物在37 ℃下摇晃60 min。采用40 μm细胞过滤器过滤溶液并分离细胞,然后接种在培养瓶中,并置于含10%FBS和抗生素(100 IU/mL青霉素、100 μg/mL链霉素和0.25 μg/mL两性霉素B)的Ham′s F12/DMEM培养基中,细胞在37 ℃、5%CO2环境中培养。后续实验步骤使用第3~5代培养细胞。
1.4 免疫组化法鉴定细胞
将细胞用4%多聚甲醛(PFA)固定在黏合玻璃载玻片中20 min, 采用0.5%Txition-100处理5 min, 然后用3%H2O2处理15 min, 再用5%正常山羊血清封闭1 min作为一级抗体; 将波形蛋白(1∶100,ab92547, Abcam)和CK19(1∶100)孵育过夜,然后将酶标记的山羊抗小鼠/兔IgG聚合物在室温下孵育20 min, 再次用PBS洗涤。加入新制备的DAB显色溶液,将载玻片在室温下孵育5 min, 然后用自来水洗涤。细胞用苏木精染色20 s, 然后在光学显微镜下观察。
1.5 Axl-siRNA细胞转染及雷帕霉素干预mTOR
Axl的siRNA购自GeneChem Corporation. Si-Axl, 序列为5′-GCGGTCTGCATGAAGGAATTT-3′。使用Lipo8000TM(Beyotime Biotechnology, 上海,中国)进行细胞转染。雷帕霉素干预子宫内膜异位细胞浓度为1 mmol/L, 干预时间为4 h, 用DMSO溶解。
1.6 细胞实验分组
选择融合率高达90%的异位子宫内膜间质细胞,分为以下4组: ① 异位子宫内膜间质细胞组(空白对照),细胞正常培养48 h; ② 异位子宫内膜间质细胞+雷帕霉素组,细胞正常培养44 h后,采用1 mmol/L雷帕霉素干预4 h; ③ 异位子宫内膜间质细胞+阴性对照组,细胞转染siRNA NC (0.1 μmol/L) 48 h; ④ 异位子宫内膜间质细胞+AXL-siRNA组,细胞转染siRNA-AXL (0.1 μmol/L) 48 h。
1.7 采用实时荧光定量聚合酶链反应(qRT-PCR)进行基因表达分析
根据制造商的说明,采用TRIzol(Thermo Fisher Scientific)从细胞中提取总RNA。使用PrimeScript RT Master Mix(日本Shija Takara Biotechnology Co. Ltd.)将提取的RNA反向转录为互补DNA(cDNA)。根据制造商(Takara)的说明,使用TB Green Premix Ex Taq进行实时PCR。使用2-ΔΔCt方法计算相对基因表达倍数的变化。购自上海生物工程公司的引物序列见表1。
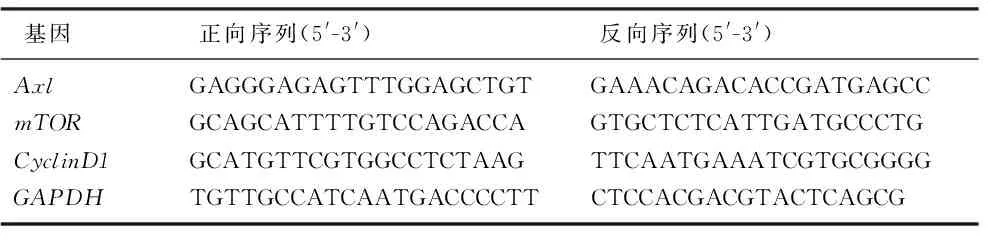
表1 PCR的引物序列
1.8 蛋白质印迹法(Western blot)检测蛋白质表达
使用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液分离细胞中的总蛋白。Western blot方法参考文献[7]。抗Axl抗体(1∶1 000, ab219652)、抗p-mTOR抗体(1∶11 000, ab109268)、抗mTOR(1∶1 000, ab32028)和抗CyclinD1抗体(1∶100,ab16663)购自Abcam Biotechnology。
1.9 统计学分析
采用GraphPad Prism 5.0软件和SPSS 25.0软件进行统计分析,计量资料符合正态分布时采用均数±标准差描述,比较采用t检验,不服从正态分布时采用中位数描述,组间分析采用Kruskal-Wallis秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1 子宫内膜间质细胞的培养及鉴定结果
显微镜下观察到子宫内膜间质细胞的大小不一,形态不规则,多为圆形或多边形。培养24 h后,椭圆形子宫内膜间质细胞基本黏附在培养板壁上,有些细胞变为纺锤形; 培养第7天后,细胞增殖速度加快(图1A); 传代3代后,细胞呈纺锤形,均匀健康; 培养至第5代后,细胞增殖率降低,成簇生长形状变为细长的纺锤形(图1B)。选择第3代细胞进行免疫组化鉴定,染色结果显示,波形蛋白在细胞浆呈深浅不一的棕褐色,表示其呈阳性(阳性率为100%); 细胞呈角蛋白(CK19)阴性,细胞质中未观察到棕色颗粒,显示出间充质细胞的特征(图1C)。
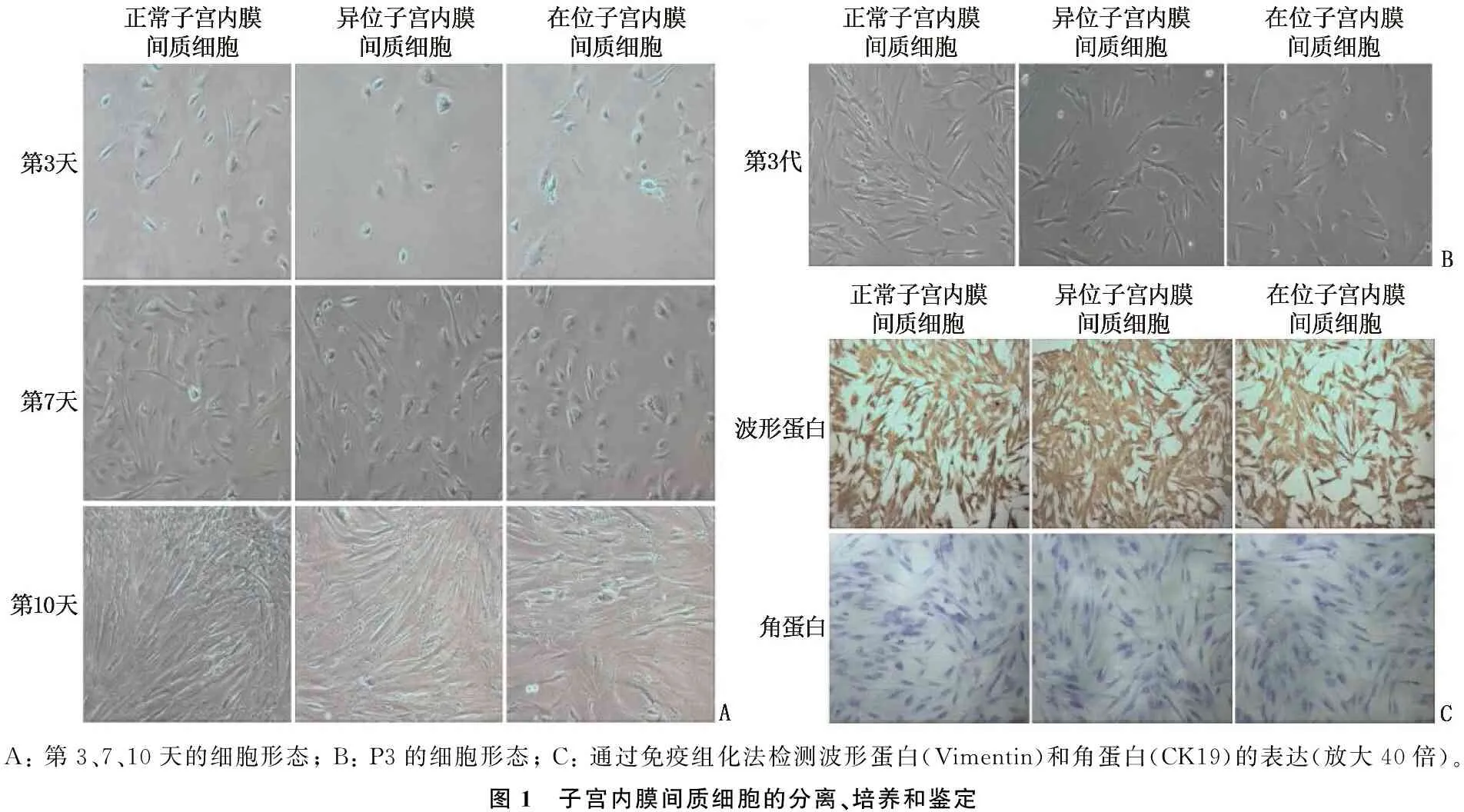
A: 第3、7、10天的细胞形态; B: P3的细胞形态; C: 通过免疫组化法检测波形蛋白(Vimentin)和角蛋白(CK19)的表达(放大40倍)。图1 子宫内膜间质细胞的分离、培养和鉴定
2.2 3组内膜细胞中Axl mRNA、mTOR mRNA的表达
采用qRT-PCR进行检测,与正常子宫内膜间质细胞比较,在位子宫内膜间质细胞、异位子宫内膜间质细胞中AxlmRNA、mTORmRNA的表达差异有统计学意义(P<0.05)。见表2。

表2 3组内膜细胞中Axl mRNA、mTOR mRNA表达水平比较
2.3 异位子宫内膜间质细胞最佳转染条件
选择生长状态良好、汇合率保持90%的子宫内膜异位间质细胞,按照90%灰褐绿分析异位子宫内膜间质细胞,在充分的胰蛋白酶消化下,单细胞悬浮液可以在无抗生素情况下进行培养,并接种至24孔板中, 500 μL/孔,随后在细胞培养箱中培养24 h, 条件为37 ℃、饱和湿度、5%CO2。配制siRNA/lipofectamin RNAiMAX复合物,混合后的复合物加入细胞培养板,置于细胞培养箱中培养(37 ℃、饱和湿度、5%CO2), 最佳转染时间为48 h。见图2。

图2 转染荧光图片(放大100倍)
2.4 调控Axl对异位子宫内膜间质细胞中mTOR通路及凋亡的影响
2.4.1 4组细胞中AxlmRNA、mTORmRNA、CyclinD1mRNA比较: 与异位子宫内膜间质细胞组比较,异位子宫内膜间质细胞+雷帕霉素组、异位子宫内膜间质细胞+Axl-siRNA组AxlmRNA、CyclinD1mRNA表达水平显著降低(P<0.05); 与异位子宫内膜间质细胞+雷帕霉素组比较,异位子宫内膜间质细胞+Axl-siRNA组AxlmRNA表达水平显著降低(P<0.05); 与异位子宫内膜间质细胞+阴性对照组比较,异位子宫内膜间质细胞+雷帕霉素组AxlmRNA、CyclinD1mRNA表达水平显著降低(P<0.05); 与异位子宫内膜间质细胞+阴性对照组比较,异位子宫内膜间质细胞+Axl-siRNA组中AxlmRNA、CyclinD1mRNA的表达水平显著降低(P<0.05); 与异位子宫内膜间质细胞组比较,异位子宫内膜间质细胞+雷帕霉素组中mTORmRNA相对表达水平显著降低(P<0.05)。见表3、图3A。

表3 4组细胞中Axl mRNA、mTOR mRNA、CyclinD1 mRNA比较

A: 采用qRT-PCR检测Axl mRNA、mTOR mRNA、CyclinD1 mRNA表达; B: Western blot检测Axl、mTOR、p-mTOR、CyclinD1的蛋白表达; C: 灰度值的定量分析。图3 调控Axl对异位子宫内膜间质细胞中mTOR通路及凋亡的影响
2.4.2 4组细胞中Axl、mTOR、磷酸化mTOR(p-mTOR)、CyclinD1蛋白比较: 与异位子宫内膜间质细胞组比较,异位子宫内膜间质细胞+雷帕霉素组p-mTOR、CyclinD1蛋白表达显著降低(P<0.05); 与异位子宫内膜间质细胞组比较,异位子宫内膜间质细胞+Axl-siRNA组Axl、p-mTOR、CyclinD1蛋白表达显著降低(P<0.05); 与异位子宫内膜间质细胞+阴性对照组比较,异位子宫内膜间质细胞+Axl-siRNA组Axl、p-mTOR、CyclinD1蛋白表达显著降低(P<0.05); 4组细胞中mTOR蛋白表达无显著差异(P>0.05)。见表4、图3B及图3C。

表4 4组细胞中Axl、mTOR、p-mTOR、CyclinD1蛋白比较
3 讨 论
EMS是一种常见的雌激素依赖性慢性炎性疾病,约50%不孕症及50%~80%盆腔痛患者最终会确诊EMS。目前国内外学者认为应从全身疾病的角度出发,研究EMS的发病机制[3], 其中异位子宫内膜间质细胞的增殖、侵袭和黏附以及新血管的形成特性与恶性肿瘤的生物学行为相似[10]。Axl是TAM家族的成员, Axl蛋白位于PI3K/AKT/mTOR信号通路的上游,该通路被认为是调节一系列生理活动如细胞增殖、存活和凋亡的经典信号通路[11]。EMS小鼠模型的体外和体内研究[12]表明, AKT/mTOR抑制剂可减少异位子宫内膜细胞的增殖。因此,研究[13]认为PI3K/AKT/mTOR信号通路可能在EMS的发生和发展中起作用。Axl是一种具有独特结构的跨膜蛋白,由Gas6编码[14]。Axl具有黏附分子的性质和酪氨酸激酶的活性,而酪氨酸激酶通常在正常人体组织中表达。在Gas6诱导下Axl二聚化后, Axl受体自身发生磷酸化,激活的Ax1受体本身具有催化下游分子的酪氨酸蛋白酶活性,从而诱导相关信号转导。在Axl受体的作用下, PI3K被激活,其产物在蛋白激酶的参与下进一步激活AKT, 从而影响下游因子的激活,其中一些下游因子参与细胞凋亡的调节[15]。AKT活化后,由于结构域的改变, PI3K与AKT结合, AKT产生催化活性并转导途径中的下一个分子。催化活性AKT从细胞膜转移到细胞质或细胞核,而后继续靶向调节下游信号分子,如mTOR、Bad、细胞周期蛋白D1和核转录因子κB(NF-κB)[16], 而mTOR是调节细胞生长、细胞周期和营养代谢的多种信号通路汇聚的中枢。
本研究结果表明,与正常子宫内膜间质细胞相比,在位子宫内膜间质细胞和异位子宫内膜间质细胞之间的Axl和mTOR基因表达差异有统计学意义(P<0.05), 这可能表明EMS患者的异位子宫内膜和在位子宫内膜具有一定相似的生物学特征,并且可能在组织学上相关,这支持了“在位内膜决定论”理论。本研究结果还表明,在分子水平上,子宫内膜异位间质细胞中Axl和mTOR基因表达水平增加,这可能与该疾病的炎症和激素依赖性特征有关。这种过度表达也可能导致异位子宫内膜间质细胞在子宫腔外持续增殖,参与子宫内膜异位病灶的形成。本研究结果还表明,异位子宫内膜间质细胞组中Axl、mTOR和CyclinD1基因表达无显著差异; 与异位子宫内膜间质细胞组相比,异位子宫内膜间质细胞+雷帕霉素组中Axl、mTOR和CyclinD1基因的表达存在显著差异; 与异位子宫内膜间质细胞+雷帕霉素组相比,异位子宫内膜间质细胞+阴性对照组的mTOR基因表达无显著差异; 与异位子宫内膜间质细胞组相比,异位子宫内膜间质细胞+雷帕霉素组中p-mTOR和CyclinD1基因的表达显著不同,这也证实了mTOR是Axl信号通路下游的关键因子。Axl被激活后,继续靶向调节下游信号分子mTOR, 从而最终调节细胞周期及其营养代谢。本研究还发现,与异位子宫内膜间质细胞+雷帕霉素组相比,异位子宫内膜间质细胞+Axl siRNA组中Axl、p-mTOR和CyclinD1基因表达水平显著不同,同时证实了mTOR信号的作用是通过PI3K/AKT/mTOR通路激活而发挥生物学效应,进一步调节下游蛋白的表达,从而调节细胞生长、增殖、自噬和凋亡等生理功能[17]。这一结果也支持了PI3K/AKT/mTOR信号通路可能在EMS的发生和发展中发挥作用的结论。总之,Axl和mTOR基因在异位内膜间质细胞中高度表达,使用雷帕霉素破坏调节细胞周期的mTOR可促进细胞凋亡,从而对异位子宫内膜细胞产生抑制作用。PI3K/AKT/mTOR信号通路和其他相关信号网络参与EMS的发病机制。Axl通过介导PI3K/AKT信号通路参与了异位子宫内膜间质细胞的活化与增殖, mTOR可能通过PI3K/AKT信号通路以外的其他机制与Axl共同参与EMS的发生。调控Axl、mTOR可促进异位子宫内膜间质细胞凋亡, Axl、mTOR激酶可成为非激素靶点药物的研究思路之一,需开展更深入的体内研究验证。
总之, EMS的发病机制涉及许多方面,例如异常的信号网络、自噬、氧化应激、新生血管和细胞凋亡。深入研究EMS发病机制涉及的完整信号网络,并更准确地在分子水平上筛选出有研究价值的治疗靶点,是非激素靶点药物的研究思路之一。
