原发性胆汁反流相关危险因素分析及其与胃黏膜病变的关系
2023-03-03刘贺勇张涛秦景娜陈杰叶行孙亚楠周英发
刘贺勇 张涛 秦景娜 陈杰 叶行 孙亚楠 周英发
胆汁反流又称十二指肠胃反流,是指十二指肠内容物,包括胆汁、胰液、十二指肠液逆行向上反流到胃内,是一种常见的消化道病理生理现象。近年来相关研究发现,胆汁反流与上消化道炎症、糜烂、肠化生和癌的发生密切相关[1],因此胆汁反流的防治对胃黏膜病变预防意义重大。幽门螺旋杆菌(HP)是能在人体胃中生存的唯一微生物,HP 感染可引起人类发生慢性胃炎、胃和十二指肠溃疡、消化性胃黏膜相关的淋巴样组织淋巴瘤和胃腺癌[2],是胃癌公认的独立危险因素。本研究旨在分析2022年2~8月我院消化内科住院的胆汁反流患者临床资料,探讨胆汁反流的相关危险因素,进一步讨论HP阴性患者中不同程度胆汁反流与胃黏膜病变发生发展的关系,为胃癌及癌前病变的预防和治疗提供新的思路。
1 材料与方法
1.1 一般资料选择2022年2~8月在我院消化内科住院接受普通胃镜检查以及HP 检查的患者,按照相关标准从中筛选810 例,分为胆汁反流组(n=178)和无胆汁反流组(n=632)。收集两组患者相关临床资料。包括年龄,性别,禁食时间(内镜检查时间),体重指数,是否吸烟,是否饮酒,是否饮食辛辣,是否焦虑,是否合并高血压、高血脂、糖尿病、HP 感染以及血清胃泌素水平,分析胆汁反流的相关危险因素。其中HP 阳性患者243 例,HP 阴性患者567 例。结合胃镜检查及病理结果将567 例HP 阴性患者,根据胃黏膜病变程度依次分为正常组、慢性胃炎组、癌前病变组、胃癌(GC)组,比较各组胆汁反流检出率及反流程度。
1.2 纳入与排除标准纳入标准:①年龄18~75 岁;②胃镜未见明显胃黏膜病变;③诊断为慢性胃炎(包括萎缩性和非萎缩性,伴或不伴糜烂);④诊断为慢性胃炎伴肠化生或低级别上皮内瘤变(轻、中度不典型增生),不包括高级别上皮内瘤变(重度不典型增生)患者;⑤确诊为GC。排除标准:①4 周内服用PPI、H2受体拮抗剂或抗生素者;②合并严重肝功能损伤者;③急慢性胆囊炎、胆管炎、胆道梗阻或胆囊切除术后者;④良性消化道溃疡者;⑤上消化道术后者;⑥有食管癌、胃良恶性肿瘤、十二指肠癌病史者。
1.3 研究方法
1.3.1 一般资料收集 通过问卷调查和医院病历系统收集患者的一般临床资料:性别、年龄、吸烟状态、饮酒状态、是否饮食辛辣、是否焦虑。
1.3.2 胆汁反流诊断标准 内镜检查和胆汁反流分级所有的内镜图片均由两位专业的内镜医师仔细审核。根据胃镜下粘液湖的状态,定义胆汁反流分级:0 级,无胆汁反流(透明粘液湖);Ⅰ级,粘液湖呈浅黄色;Ⅱ级,粘液湖呈黄绿色;Ⅲ级,粘液湖呈暗黄色,粘稠、浑浊伴胆斑阻塞。分析不同程度胃黏膜病变中胆汁反流的检出率及反流程度。
1.3.3 胃镜诊断及活检标准 对于无明显病变的非GC 患者,无需活检;对于胃镜下出现肠化生以外明显病变(如局部糜烂、浅表凸起等)的非GC 患者,进行1~5 次活检;对于胃镜下出现明显肠化生的非GC 患者,进行5 次活检(2 次取胃体,1 次取胃角,2次取胃窦);对于GC 患者,根据病变的位置和大小,由内镜医师决定活检的位置和次数,并根据诊断标准将患者分为:①正常组(胃镜未见明显胃黏膜病变);②慢性胃炎组(包括萎缩性和非萎缩性,伴或不伴糜烂,胃镜和病理学检查均无癌前病变);③癌前病变组(包括肠化生或低级别上皮内瘤变,不包括经病理学检查确诊的高级别上皮内瘤变);④GC组(确诊为GC)。
1.3.4 临床资料收集 ①采用焦虑自评量表(SAS),评分≥50 分即认为患者存在焦虑。②通过C13或C14呼气试验测定是否感染HP。患者检查前需停用抗生素4 周以上,停用质子泵抑制剂、H2受体拮抗剂或铋剂2 周以上。C13和C14试剂盒阳性判断值分别为≥4.0、≥10 可判定受检查者HP 阳性。③住院常规检验胃泌素水平,抽取空腹静脉血,结果回示后记录;④通过电子血压计测量血压,平静状态下收缩压≥140mmHg 或舒张压≥90mmHg 或既往有高血压病史现需药物维持血压正常可诊断为高血压。⑤抽取空腹静脉血测定血脂,总胆固醇≥5.2mmol/L、低密度脂蛋白≥3.4mmol/L 或甘油三酯≥2.3mmol/L 或既往有高脂血症病史现需药物维持血脂正常诊断为高脂血症。⑥抽取空腹静脉血,监测2 次空腹血糖≥7.0mmol/L 或既往有糖尿病病史现需药物维持血糖正常可诊断为糖尿病。⑦禁食时间:将不同时间段行胃镜检查的患者分为上午组(8:00~11:30)和下午组(14:00~17:30),比较相对的禁食时间长短。⑧其他一般资料如性别、年龄、吸烟状态(每周≥3 次)、饮酒状态(每周≥3 次)、饮食状态(每周辛辣饮食≥3 次)等通过入院问诊及住院病历系统收集。
1.4 统计学分析采用SPSS 26.0 统计软件进行统计分析,计量资料用±s表示,组间比较采用t检验;计数资料采用χ2检验。将存在差异的因素进行Logistic 回归分析,寻找胆汁反流的相关危险因素;使用卡方检验比较不同胃黏膜病变之间的胆汁反流检出率,使用Spearman 相关系数评估胃黏膜病变程度与胆汁反流分级之间的关系。P<0.05 为差异有统计学意义。
2 结果
2.1 胆汁反流组与无胆汁反流组一般资料比较810例患者中178 例发生胆汁反流,总检出率21.98%。两组年龄、体重指数、是否饮食辛辣、是否合并高血压、高血脂、糖尿病、HP 感染比较,差异无统计学意义(P>0.05)。胆汁反流组18~45 岁占比明显高于无胆汁反流组,差异有统计学意义(P<0.05);胆汁反流组胃泌素17 水平、女性、检查时间为下午、吸烟、饮酒、合并焦虑占比明显高于无胆汁反流组,差异有统计学意义(P<0.05),见表1。
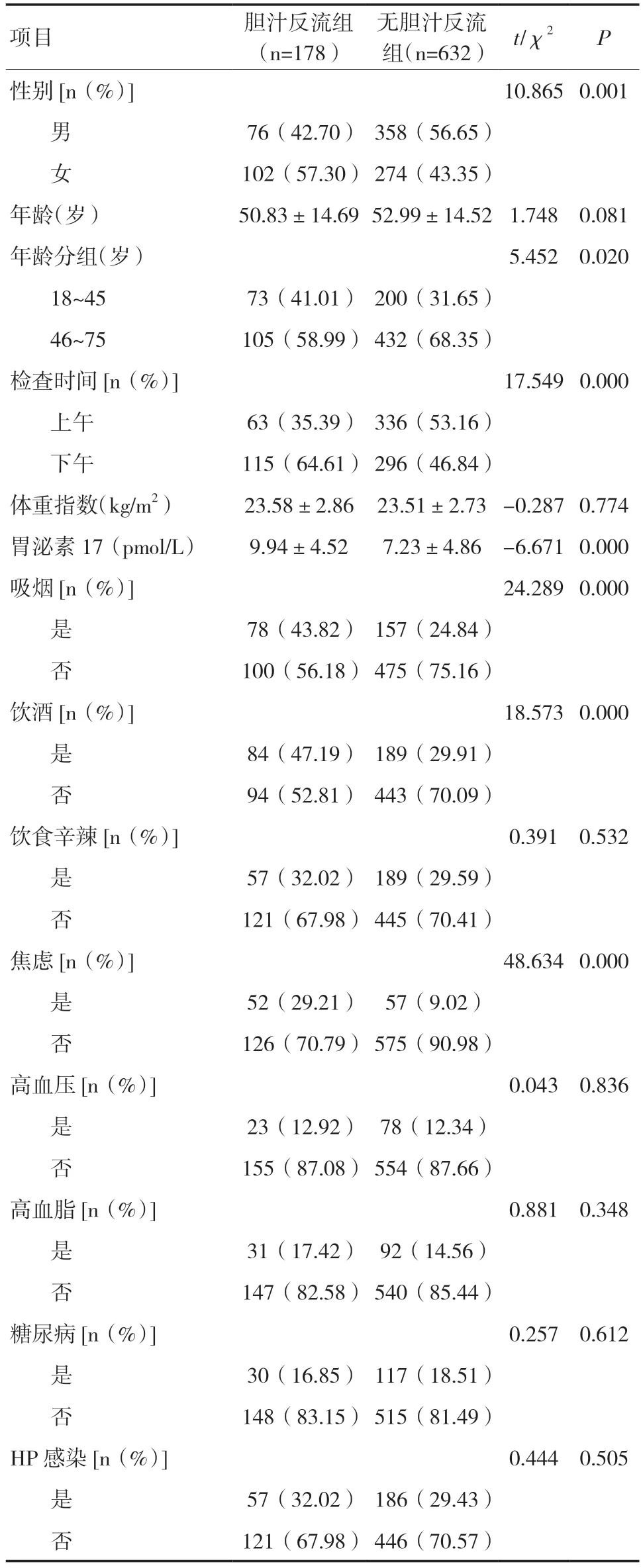
表1 两组一般资料比较
2.2 发生胆汁反流的多因素Logistic 回归分析将上述有统计学差异的因素纳入Logistic 回归模型,结果显示年龄不是胆汁反流的危险因素,女性、禁食时间过长、吸烟、饮酒、焦虑、胃泌素17 水平升高可能是胆汁反流的相关危险因素,见表2、3。
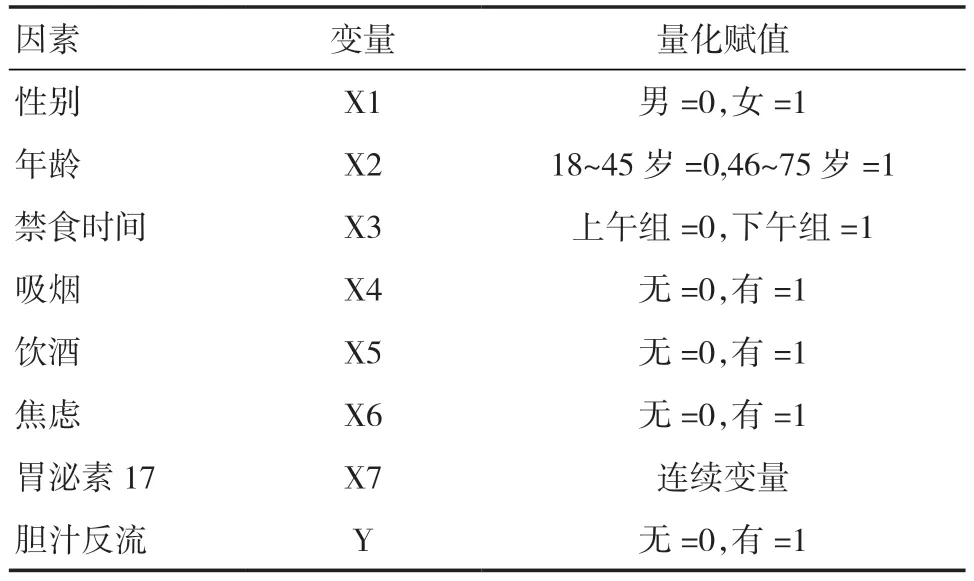
表2 量化赋值
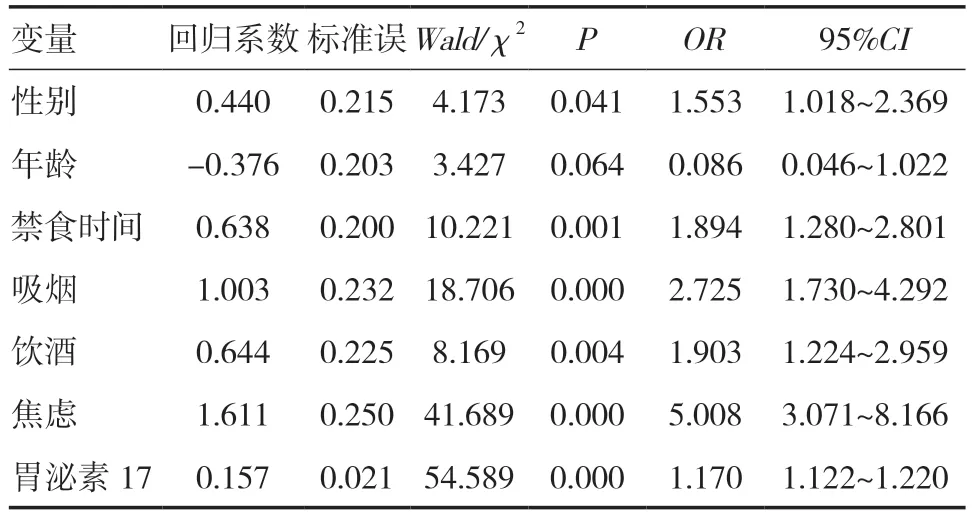
表3 胆汁反流发生的多因素Logistic 回归分析
2.3 胆汁反流对胃黏膜病变的影响在排除HP 对胃黏膜的影响后,进一步分析HP 阴性患者中胆汁反流与胃黏膜病变的相关性。正常组胆汁反流检出率明显低于慢性胃炎组(χ2=3.987,P=0.046)、癌前病变组和胃癌组,慢性胃炎组和癌前病变组胆汁反流检出率明显低于胃癌组(χ2=15.698,P=0.001;χ2=5.072,P=0.040),慢性胃炎组胆汁反流检出率明显低于癌前病变组(χ2=5.072,P=0.024),见表4。使用Spearman 相关分析确定胃黏膜病变程度与胆汁反流分级是否存在相关性,结果显示,胆汁反流分级与胃黏膜病变严重程度呈正相关(r=0.195,P=0.000)。
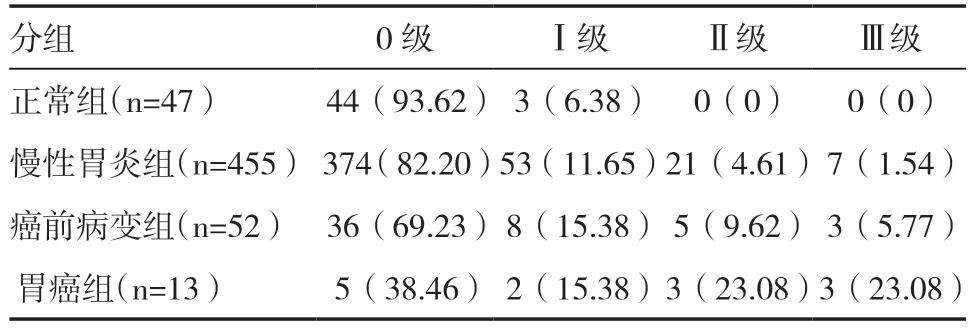
表4 不同胃黏膜病变组胆汁反流检出率及胆汁反流分级比较[n(%)]
3 讨论
胆汁由肝细胞和胆管细胞产生,正常情况下贮存于胆囊中或经胆管排至十二指肠降部,发挥其乳化脂肪的作用,参与脂肪和脂溶性维生素的消化吸收,同时还可以将某些代谢产物从肝脏排出。在某些情况下,排入十二指肠内的胆汁可同其他内容物逆行反流入胃,即胆汁反流。短时间内反流并不会对胃黏膜造成损伤,可经过胃蠕动排空很快清除,但长时间、大量的胆汁反流可破坏胃黏膜屏障,引发胃黏膜病变。大量研究认为,胆汁反流与胃黏膜炎症、肠化、异型增生甚至癌变有关[3~6],此外,有研究表明胃黏膜损伤程度随着胃内胆汁酸浓度的增加而加重[7]。由此可见,胆汁反流的防治意义重大。
本研究采用Logistic 回归模型进行分析,结果显示女性、禁食时间过长、吸烟、饮酒、焦虑、胃泌素水平升高可能是胆汁反流的相关危险因素。本研究中女性发生胆汁反流的风险为男性的1.553 倍,而焦虑患者发生胆汁反流的风险为非焦虑患者的5.008 倍,本研究焦虑患者中女性占比远高于男性,与相关研究女性焦虑症发病率高于男性相符[8],这可能与男性、女性在社会上的角色与责任不同有关,此外也可能与男性、女性在看待、处理生活事件的角度、重要性等方面不同有关[9]。因此,作者认为女性胆汁反流检出率高于男性的原因之一在于女性更容易合并精神因素。精神因素如焦虑等引发胆汁反流的机制尚不清楚,有研究认为脑-肠轴受精神紧张、情绪不稳定或情绪消极影响,出现脑肠肽的合成与释放异常,神经系统稳定性受到影响,使胃肠功能紊乱,如胃排空延迟及胃肠运动失调,导致幽门正常的运动功能失衡,从而发生胆汁反流[10,11]。本研究中下午行胃镜检查的患者胆汁反流检出率明显高于上午组,即随着禁食时间的延长,胆汁反流发生率逐渐升高,其原因为随着禁食时间的延长发生生理性反流明显增多,患者禁食时间越长,胃肠饥饿性不规律收缩增加,从而导致下午检查的患者胃镜下发现胆汁反流的机会增加[12]。过度吸烟、酗酒诱发胃肠功能紊乱,导致幽门正常动力功能失调,胆汁反流的风险增加。本研究中吸烟、饮酒患者发生胆汁反流的风险分别是非吸烟、饮酒者的2.725、1.903 倍。幽门括约肌发挥正常功能前提是胃泌素、促胰液素、胆囊收缩素水平在体内达到平衡,如果胃泌素水平过高,促胰液素、胆囊收缩素的分泌会相对减少,进而降低幽门括约肌的张力,使胆汁反流入胃的风险增加。也有学者认为,胃泌素同时可以起到舒张胃底的作用,进而促使反流至人体胃部的胆汁等多种液体发生潴留而难以及时排空[13]。本研究中胆汁反流组胃泌素水平明显高于无胆汁反流组,提示胃泌素水平相对过高可能是胆汁反流的危险因素。
本研究进一步探讨HP 阴性患者胆汁反流与胃黏膜病变的关系。结果显示,正常组、慢性胃炎组、癌前病变组、胃癌组胆汁反流检出率依次增加,胆汁反流是胃黏膜病变的危险因素,且胆汁反流分级与胃黏膜病变严重程度呈正相关。首先,反流入胃的胆汁等内容物会造成胃黏膜炎症反应以及萎缩性改变,其主要机制与损害胃黏膜屏障有关。相关研究认为,胆汁与胰液混合时胆汁中的卵磷脂在磷脂酶 A 作用下转化为溶血卵磷脂,后者可溶解胃黏膜上皮细胞膜的磷脂层,从而破坏黏膜屏障,使黏膜的通透性增加,胃液中氢离子由于屏障机制的损伤而弥散入胃黏膜,引起胃黏膜损伤[14]。同时,胆汁酸在pH 较低环境下更容易损伤胃黏膜屏障。有研究表明胃黏膜上皮细胞在pH<3.0 的胆汁酸刺激下可降低miRNA let-7a 的表达,进而影响上皮细胞间连接蛋白ZO-1、钙粘蛋白E 等的表达,从而破坏细胞间紧密连接及附着连接,增加胃黏膜通透性,破坏黏膜屏障功能,进而发生炎症反应[15]。此外,反复胆汁反流可引起胃黏膜萎缩性改变,其主要原因为胆汁反流可减少黏膜保护因子PGE2,损伤胃黏膜防御机能,以及引起胃肠激素分泌失调,表现为黏膜肌层增厚并成束深入固有膜,固有膜变薄,腺体萎缩[16]。在长期、高浓度的胆汁酸刺激下,胃黏膜除发生炎症反应和萎缩性改变外,还可能进一步出现肠化生、不典型增生,甚至癌变,但其机制目前尚不清楚。肠特异性转录因子CDX2 在胃黏膜的异位表达,在胆汁酸诱导胃黏膜肠化生、异型增生乃至癌变的过程中起着至关重要的作用。Barros 等[17]研究认为CDX2 可能通过促进肠化生特异性标志物(如KLF4、VIL1、MUC2 等)的转录调节肠化生的转分化。另一项研究认为,高浓度胆汁酸促使G 蛋白偶联受体超家族成员TGR5 和CDX2 的异常表达参与了胃肠化生、异型增生乃至胃癌的发生发展[18]。本研究排除了HP 这一胃癌独立危险因素的影响,证实胆汁反流与胃黏膜病变发生发展的相关性。
综上所述,女性、禁食时间过长、吸烟、饮酒、焦虑、胃泌素水平升高是胆汁反流的相关危险因素,在排除HP 对胃黏膜的影响后,胆汁反流可能是胃黏膜病变的危险因素,且胆汁反流分级与胃黏膜损伤程度有关。
