变叶榕提取物不同组分总黄酮含量及抗氧化抗炎活性研究*
2023-03-02吴文明邹婷婷熊贻友胡建新
吴文明,习 丹,邹婷婷,熊贻友,应 萍,胡建新
(1 江西省人民医院(南昌医学院第一附属医院)药学部,江西 南昌 330006;2 华中科技大学生命科学与技术学院,湖北 武汉 430074;3 南昌大学抚州医学院药学院,江西 抚州 344000)
变叶榕(FicusvariolosaLindl. ex Benth.)为桑科(Moraceae)榕属(Ficus)植物,别名斑榕、牛奶仔、奶汁柴、椿云仔、常绿天仙果、山榕、芷葛等,灌木或小乔木,主要分布于浙江、江西、福建、广西、广东和湖南等地。变叶榕的根、茎和叶均可入药。其叶经捣碎外敷可治跌打损伤,茎有清热利尿之功效,根为主要的药用部位[1],味苦、辛,性温,煎汤内服或浸酒擦拭,具有祛风、除湿、活血、止痛、补肝肾、强筋骨、催乳等功效,主治关节风湿疼痛,跌打损伤、胃痛、疖肿、乳汁不下等[2]。同时,变叶榕根作为药食同源的药材,多集中于福建、浙江、江西等省的畲族居民聚集地的民间使用,可以祛风湿、活血止痛、催乳等功效,具有良好的临床疗效[3-4]。目前,变叶榕的现代研究甚少,基于其功能主治及药食同源的特点,本研究对产自我国的变叶榕根不同组分进行总黄酮含量测定及体外抗氧化抗炎活性评价,以期初步阐明其抗氧化抗炎的物质基础及作用机制。
1 材料、试剂与仪器
1.1 药材及细胞株
药材于2020年12月采自广西壮族自治区平南县官成镇,经江西省人民医院药学部副主任中药师应萍鉴定为桑科榕属植物变叶榕(FicusvariolosaLindl. ex Benth.)的根,样品保存于我科实验室。小鼠巨噬细胞RAW264.7获赠于江西省人民医院临床医学研究所。
1.2 药品及试剂
芦丁(R189033-5g),Aladdin;LPS(L2880-100mg),Sigma;亚硝酸钠(S818033-500g),麦克林;氢氧化钠(2110281),西陇科学;硝酸铝(A800886-500g),麦克林;2,2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(d6132-1g),麦克林;2,2-联苯基-1-苦基肼基(D141336-250mg),Aladdin;过二硫酸钾(2107162),西陇科学;铁氰化钾(P111564-100g),Aladdin;L(+)-抗坏血栓(2110142),西陇科学;1640培养基(含双抗,SH30809),GIBCO;胎牛血清(11011-8611),四季青。其他化学试剂均为分析纯。
1.3 仪 器
NP80 touch型超微量分光光度计,德国Implen公司;Multiskan Sky型酶标仪,美国Thermo Fisher Scientific公司;RE-2000B型旋转蒸发仪、SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;HH·SII-Z-S型电热恒温水浴锅,上海新苗医疗器械制造有限公司;CO2培养箱,美国Thermo Fisher Scientific公司;PrimoVert型倒置显微镜,德国Zeiss公司;FBC1002型超纯水机,青岛富勒姆科技有限公司;Mettler AE240电子天平(万分之一),美国梅特勒-托利多仪器公司;DZF-6050AB真空干燥箱,邦西仪器科技有限公司。
2 方 法
2.1 变叶榕根各组分的制备
称取干燥变叶榕根粉末100 g,用60%乙醇以料液比1∶10加热回流提取3次,每次1 h,合并3次滤液,浓缩干燥得干膏8.48 g。将干膏溶于80 mL蒸馏水中,取8 mL留样备用(FV-Z),剩余部分依次用石油醚、乙酸乙酯、水饱和正丁醇萃取,得到相应的提取部位:石油醚(FV-1)、乙酸乙酯(FV-2)、正丁醇(FV-3)和水(FV-4),干燥后称重,分别为0.95 g、1.28 g、2.45 g及3.80 g。用60%乙醇分别溶解配置成一定浓度的母液,置于4 ℃保存备用。
2.2 各组分总黄酮含量测定
2.2.1 芦丁标准曲线绘制
参考朱伟等[5]报道的方法,精密配置0.2 μg·mL-1的芦丁标准溶液。分别取0、0.25、0.5、1、1.5、2 mL的标准溶液于10 mL容量瓶中,加60%乙醇补至2 mL。分别加入5%亚硝酸钠溶液0.3 mL,摇匀静置6 min,再分别加入质量分数为10% Al(NO3)3溶液0.3 mL,摇匀静置6 min,之后再分别加入4% NaOH溶液4 mL,并加入60%乙醇溶液定容至10 mL,摇匀静置15 min,空白组为60%乙醇溶液,在波长500 nm处测定吸光度值,以芦丁质量浓度(C,μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得回归方程:y=0.001 7x-0.003 2(R2=0.999 7),如图1所示。

图1 芦丁标准曲线
2.2.2 样品总黄酮含量测定
将各组分样品配置成一定的浓度,按“2.2.1”项下的芦丁标准曲线绘制方法,测定样品的吸光度值,按以下公式(1)计算各组分黄酮含量相当于芦丁的含量:
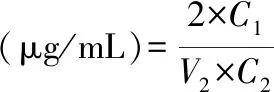
(1)
式中:C1——按标准曲线所求得的黄酮的浓度,μg/mL
C2——样品的质量浓度,μg/mL
V2——所取样品的体积,mL
2.3 抗氧化实验
2.3.1 DPPH自由基清除活性测定
参照Yu等[6]报道的方法,略有改动。精密吸取浓度为6.25、12.5、25、50、100 μg/mL的样品溶液100 μL,分别加入100 μL 100 μg/mL的DPPH溶液,混匀后避光反应30 min,于酶标仪在517 nm波长处测定吸光度值As。配置溶剂空白组An(等体积甲醇代替DPPH溶液)和样品空白组A0(等体积甲醇代替样品溶液),以VC为阳性对照,以上实验重复3次。按以下公式(2)计算各组分对DPPH清除率,并计算IC50值。

(2)
2.3.2 ABTS自由基清除活性测定
参照王荣等[7]报道的方法,简述如下:精密配置7.0 mmol/L的ABTS水溶液。称取5 mg K2S2O8,加入7.5 mL超纯水溶解,将二种溶液按体积比1∶1等量混合,得ABTS母液,置于4 ℃冰箱保存10~12 h备用。使用时,用无水乙醇稀释至吸光度在(0.7±0.02) Abs范围内。将各组分母液用无水乙醇稀释至6.25、12.5、25、50、100 μg/mL,分别吸取100 μL,加入ABTS水溶液100 μL,避光反应30 min,在734 nm波长处测定吸光度值As。同时,设定溶剂空白组An(等体积乙醇代替ABTS溶液)和样品空白组A0(等体积乙醇代替样品溶液),以VC为阳性对照,重复实验3次。按“2.3.1”中公式(2)计算ABTS清除率,计算IC50值。
2.3.3 Fe3+还原能力测定
参照Mazor D等与朱伟等[8-9]报道的方法,分别取0.8 mL浓度为6.25、12.5、25、50、100 μg/mL的样品溶液,加入2 mL磷酸盐缓冲液(pH=6.6)和2 mL 1%铁氢化钾,50 ℃水浴20 min,加10%三氯乙酸2 mL,混匀离心,取2 mL上清液,依次加2 mL去离子水、0.4 mL 0.1%三氯化铁,静置5 min,在700 nm波长处测吸光度值,以VC为阳性对照,重复实验3次。相同浓度下,测得的吸光度值越大表示还原能力越强,吸光度为0.5时的样品浓度即为样品的IC50值。
2.4 抗炎实验
小鼠巨噬细胞RAW264.7培养于含10%胎牛血清的RPMI-1640培养基中。取对数期细胞,以每孔2×104个细胞接种于96孔板中,培养24 h,移去培养基,设正常对照组An、LPS对照组Ac和样品处理组As。正常对照组加入200 μL培养基;LPS组加入终浓度为1 μg/mL LPS的200 μL培养基;样品组加入终浓度为1 μg/mL LPS和终浓度分别为6.25、12.5、25、50、100 μg/mL的变叶榕不同组分样品溶液200 μL,培养24 h后收集上清。参照文献[10]方法,取100 μL细胞上清,加入50 μL Griess A试剂,37 ℃避光反应10 min,加入50 μLGriessB试剂,37 ℃避光反应10 min,540 nm处测定吸光度值A。NO释放抑制率按以下公式(3)计算:

(3)
2.5 统计分析
采用excel和GraphPad Prism 9.0.0统计分析软件对各组数据间的显著性差异进行分析及IC50的计算。
3 结 果
3.1 各组分总黄酮含量测定结果
从表1数据可以看出,变叶榕根总提取物中黄酮含量为(162.26±2.74)mg/g,与其它4个组分的黄酮含量之间均存在明显的差异;经过不同极性溶剂萃取后,乙酸乙酯组分FV-2的总黄酮含量最高,为(285.75±5.99)mg/g,明显高于总提取物及其他3个组分,差异具有统计学意义(p<0.001)。FV-1和FV-4的黄酮含量较低,分别为(36.53±1.94)和(84.71±6.73)mg/g,明显低于FV-Z和FV-2(P<0.001)。
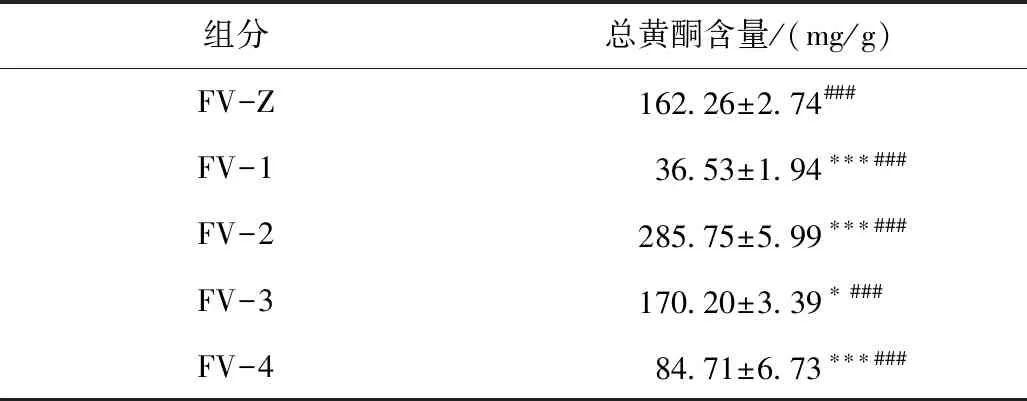
表1 变叶榕根不同极性部位总黄酮含量
3.2 抗氧化实验结果
3.2.1 DPPH自由基清除活性测定结果
由图2可以看出,变叶榕根乙醇提取物FV-Z及组分FV-2、FV-3均具有明显的DPPH自由基清除活性,且随浓度的增大,活性增强,在浓度为100 μg/mL时,DPPH自由基的清除率均大于90%,其IC50值分别为25.62、15.53、19.75 μg/mL。VC作为阳性对照,其IC50值为8.47 μg/mL。组分FV-1和FV-4在浓度为25~100 μg/mL之间较弱的清除DPPH自由基的活性,但在低浓度6.25~12.5 μg/mL时,未见有活性,其IC50值分别为大于100和15.53 μg/mL。由此可见,变叶榕根清除DPPH自由基的活性部位集中在黄酮含量较高的提取物、乙酸乙酯和正丁醇组分,且乙酸乙酯组分的活性最强。
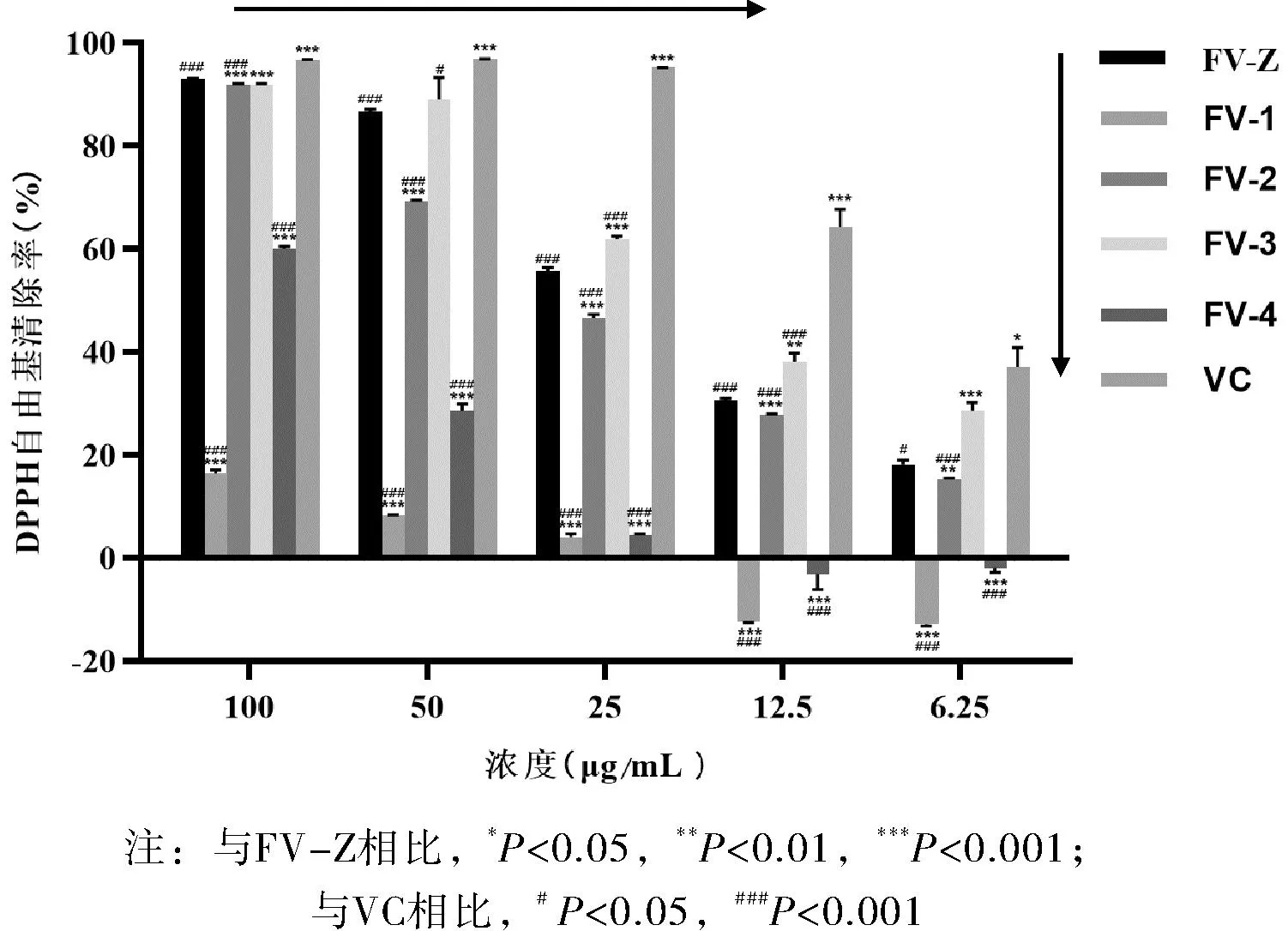
图2 变叶榕各组分不同浓度对DPPH自由基的清除活性
3.2.2 ABTS自由基清除活性测定结果
从图3可以看出,变叶榕总样及其4个组分均具有不同程度的清除ABTS自由基的活性,但不同组分之间存在较大的差异。其中,FV-Z、FV-2和FV-3具有较强的ABTS自由基清除能力,在浓度为25~100 μg·mL-1范围内,清除率均超过88%。在低浓度6.25~12.5 μg/mL时,各组分的清除能力显著低于阳性对照VC(p<0.001)。石油醚组分FV-1对ABTS自由基的清除能力最弱,在浓度为100 μg/mL时,清除率仅为43.82%。各组分ABTS自由基清除活性IC50值分别为6.99、大于100、6.69、7.31和25.68 μg/mL。VC作为阳性对照,其IC50为2.31 μg/mL。由此可见,变叶榕总提取物、乙酸乙酯和正丁醇组分具有良好的ABTS自由基的清除能力,且乙酸乙酯组分活性最强。
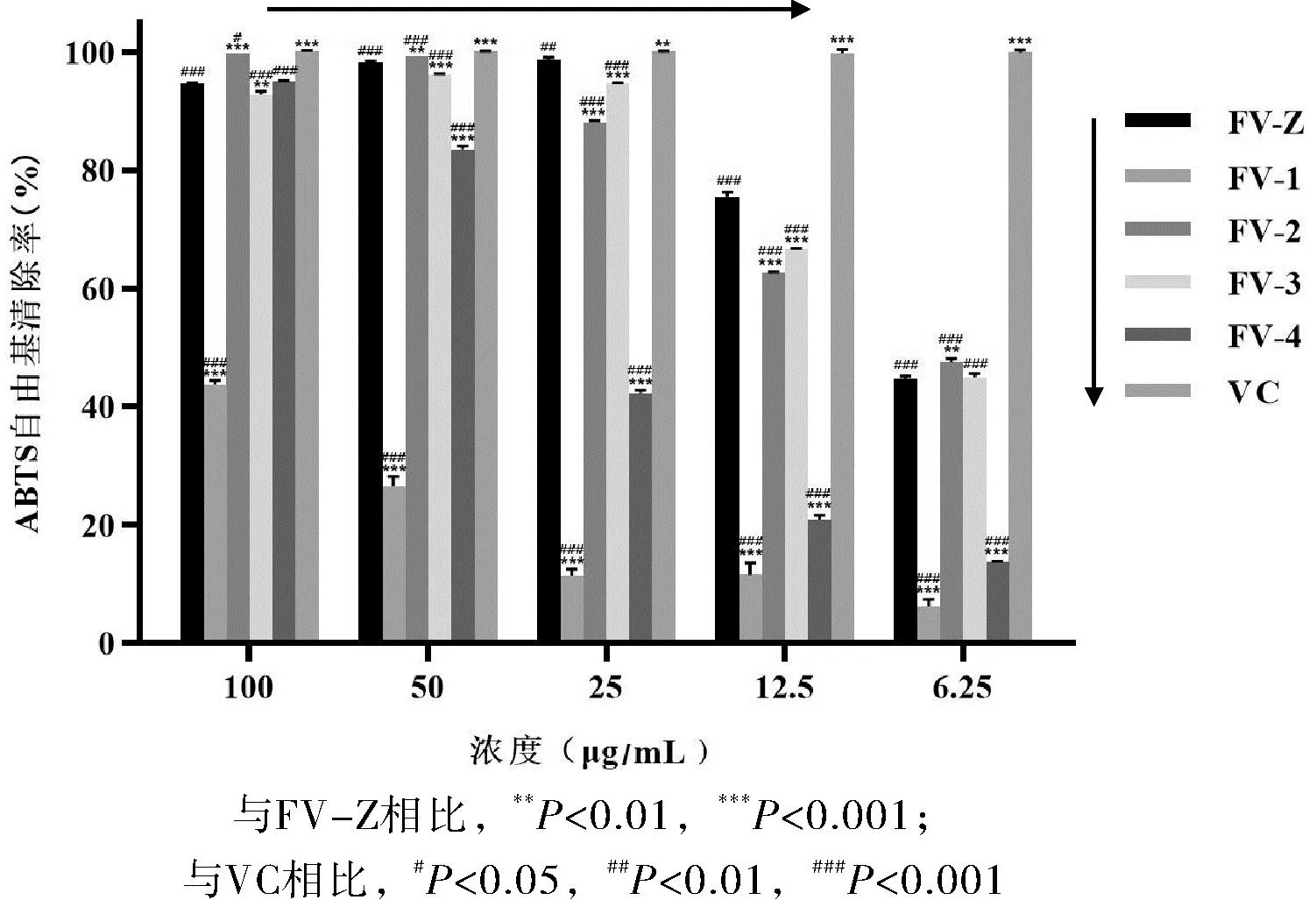
图3 变叶榕各组分不同浓度对ABTS自由基的清除活性
3.2.3 还原能力测定结果
从图4可以看出,乙酸乙酯组分FV-2的还原能力最强,在浓度为50 μg/mL和100 μg/mL时,吸光度值分别为0.522和0.786,其还原能力明显强于FV-Z(P<0.001)。正丁醇组分FV-3仅在浓度为100 μg/mL时,其吸光度值大于0.5,为0.522,其还原能力亦显著强于FV-Z(P<0.001)。FV-2和FV-4的IC50值分别为56.52、88.63 μg/mL,其中,FV-2的IC50值接近阳性对照VC的IC50值(48.26 μg·mL-1),可能是变叶榕根主要的还原活性部位。组分FV-Z、FV-1和FV-4的Fe3+还原活性较弱,其IC50值均大于100 μg/mL。

图4 变叶榕各组分不同浓度的还原能力
3.2.4 NO抑制活性测定结果
本研究选择的变叶榕不同组分的浓度为6.25~100 μg/mL,在此浓度范围内,各组分均对RAW264.7细胞活力无明显影响,说明各组分在选定的浓度范围内无细胞毒作用。由图5可以看出,在6.25~100 μg/mL浓度范围内,变叶榕各组分对LPS诱导RAW264.7细胞释放NO均有一定的抑制作用,且随着浓度的升高,抑制作用增强。其中,石油醚组分FV-1和乙酸乙酯组分FV-2具有明显的抑制LPS诱导RAW 264.7细胞释放NO的活性,在100 μg/mL时,抑制率分别为59.33%和62.40%,且与石油醚组分FV-Z相比,差异具有统计学意义(p<0.001)。其他组分的抑制作用较弱,在100 μg/mL时,抑制率均低于50%。FV-1和FV-2的IC50值分别为66.89、63.07 μg/mL,其他组分IC50值均大于100 μg/mL。由此可见,变叶榕具有抑制LPS诱导RAW264.7细胞释放NO的活性部位主要为石油醚和乙酸乙酯组分。

图5 变叶榕各组分不同浓度对LPS诱导RAW 264.7细胞NO释放的抑制率
4 结 论
榕属植物根多含有黄酮类化合物,也是抗氧化抗炎的重要成分[11-14]。黄酮类化合物多具有游离酚羟基,一般易溶于极性较大的有机溶剂和碱性溶液,不溶于非极性强的有机溶剂[15]。本次研究表明,经过萃取,变叶榕根的总黄酮主要富集于乙酸乙酯部位,而石油醚部位总黄酮含量最少。从抗氧化实验结果可以看出,各组分清除DPPH、ABTS+自由基及还原能力基本与总黄酮的含量呈正相关。本研究结果显示黄酮含量较高的总膏FB-Z、乙酸乙酯部位FB-2、正丁醇部位FB-3具有较好的抗氧化活性,其中乙酸乙酯部位黄酮含量最高,其清除DPPH、ABTS自由基及还原能力均最强。黄酮含量较低的石油醚组分和水组分抗氧化活性相应的也较弱。在抗炎活性研究中,我们发现变叶榕石油醚和乙酸乙酯组分能够抑制LPS诱导小鼠巨噬细胞RAW264.7产生炎性因子NO,NO在急、慢性炎症、自身免疫疾病等的发生、发展中起着关键的调节作用,抑制NO的过度生成在炎症及自身免疫性疾病的预防和治疗中具有非常重要的意义[16]。因此,变叶榕对炎症及免疫性疾病的治疗用作可能与抑制NO的生成有关。
本次研究初步阐明了变叶榕根的抗氧化抗炎的物质基础及可能的作用机制。目前,关于变叶榕的临床应用及现代化研究的报道较少,仅有少量的初步的药理活性研究,如其提取物对萝卜蚜的触杀活性及对斑马鱼极性毒性的研究。变叶榕具有药用及保健价值,为药食同源的中药材,目前针对其功能主治及保健作用的现代研究极其缺乏。中药具有多成分、多靶点、多疗效的特点[17],因此,变叶榕在活性成分、药理活性、保健价值等方面都还有待深入研究。同时,为保证安全的临床应用,在质量控制方面,变叶榕也缺乏专属性的定量评价标准,这些都是亟待解决的问题。
