免疫检查点抑制剂单用或联合常规化疗治疗非小细胞肺癌致非免疫相关不良事件的Meta分析
2023-03-02钟宇科吕晓丹杨楚钦钟建华
钟宇科,钟 晓,吕晓丹,杨楚钦,钟建华
(深圳市龙岗中心医院,广东 深圳 518116)
根据最新的一项癌症数据报告显示,肺癌仍是当下人类致死率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)约占所有肺癌的80%~85%,主要组织学亚型包括鳞状细胞癌以及腺癌[1]。目前,临床上针对NSCLC的治疗以手术切除以及铂类药物为主的化疗、放疗以及靶向治疗。随着近年来免疫疗法的飞速发展,免疫检查点抑制剂(ICIs)在NSCLC的免疫治疗中得到较大突破,可能通过调控T细胞参与的免疫反应清除患者体内的肿瘤细胞,在一定程度上延长患者生存周期,改善预后[2]。然而,ICIs的应用可能导致严重不良事件(AEs)-免疫相关不良事件(irAEs),主要涉及皮肤、消化系统、内分泌系统、神经系统以及心血管系统等[3]。其中非irAEs亦占据一定的比例,如恶心呕吐、腹泻、脱发以及神经系统病变等,可能对患者的预后产生负面影响,应予以重视[4]。鉴于此,本文通过对ICIs单用或联合常规化疗治疗NSCLC患者所致非irAEs发生情况实施系统评价,旨在为临床治疗提供数据支持。
1 资料与方法
1.1文献纳入及排除标准:(1)均为国内外公开发表的Ⅱ期或Ⅲ期随机对照试验(RCT);(2)语种为中文/英文;(3)研究对象均经病理检查确诊为NSCLC;(4)研究对象均为成年人;(5)研究组患者开展ICIs单用或联合常规化疗治疗,对照组开展常规化疗药物或安慰剂联合常规化疗药物;(6)结局指标:①治疗相关AEs发生情况,且包含了irAEs以及非irAEs;②血液系统AEs发生情况,囊括所有程度的贫血、中性粒细胞减少症以及血小板减少症;③临床相关症状发生情况,涵盖所有程度的恶心呕吐、腹泻、周围神经病变以及脱发发生率。其中②③均统计为非irAEs。文献纳入时间为2016年~2020年。
1.2文献检索方式:以下述4项作为关键词进行文献检索:①NSCLC;②程序性死亡受体1(PD-1);③程序性死亡分子配体-1(PD-L1);④免疫疗法;⑤ICIs。通过布尔逻辑算符(and,or,not)进行各个检索词的连接,并通过计算机检索相关语言数据库。其中汉语数据库主要涵盖万方数据库,CNKI中国学术期刊网,维普中文科技期刊全文数据库,中国生物医学文献数据库。外文数据库囊括PubMed、Medline、Web of Science、Google Scholar。同时采用人工检索完成补充。
1.3文献筛选以及数据提取:由两名研究人员以双盲法完成所有纳入文献相关资料的提取,最后借助RevMan 5.2软件实现对数据的分析,当出现分歧时通过讨论解决。提取资料涵盖第一作者、文献出版年份、临床试验分期、研究样本量、发表年份、结局指标等。
1.4文献质量评价:纳入研究的质量按照Cochrane评价手册完成评价,主要内容涵盖以下7个方面:①随机顺序的产生;②参与者和研究者盲法;③随机方案分配隐藏;④结果测评者盲法;⑤其他偏倚来源;⑥选择性报告;⑦结局数据完整性。参照改良Jadad评分法对所有纳入文献质量予以评价,1~3分记作低质量,4~7分记作高质量。
1.5统计学处理:数据分析主要是借助RevMan 5.3软件完成,通过危险比(RR)及其95%可信区间(95%CI)描述二分类变量的结果指标。同时以I2检验完成异质性分析,当I2<50%,则表示无异质性,实施固定效应模型,反之,则实施随机效应模型。检验水平为α=0.05。
2 结果
2.1纳入文献基本特征分析:初步检索共获取文献1 461篇,排除重复文献、综述、病例报告以及动物实验后,最终纳入的文献共有12项[5-16],其中临床试验分期为Ⅱ期1项,Ⅲ期11项。共纳入病例8 430例,研究组4 661例,对照组3 769例,发表年份2016年~2020年,所有研究均为RCT,且描述了随机序列产生方法及分配隐藏,所有研究数据报告均无缺失。见表1。

表1 纳入文献基本特征分析
2.2两组治疗相关AEs发生率的Meta分析结果:研究组患者AEs总发生率显著低于对照组(RR=0.85,95%CI=0.82~0.93);研究组患者重度AEs发生率显著低于对照组(RR=0.62,95%CI=0.48~0.73);两组终止治疗发生率及死亡发生率对比,差异无统计学意义(P=0.253、0.775)。见表2。

表2 两组治疗相关AEs发生率的Meta分析结果
2.3两组血液系统AEs发生率的Meta分析结果:研究组贫血总发生率显著低于对照组(RR=0.42,95%CI=0.30~0.58);研究组中性粒细胞减少症总发生率显著低于对照组(RR=0.30,95%CI=0.19~0.45);研究组血小板减少症总发生率显著低于对照组(RR=0.84,95%CI=0.73~0.94),差异均具有统计学意义(P<0.05)。见表3。

表3 两组血液系统AEs发生率的Meta分析结果
2.4两组临床相关症状发生率的Meta分析结果:研究组恶心呕吐总发生总发生率显著低于对照组(RR=0.61,95%CI=0.43~0.80);研究组脱发总发生率显著低于对照组(RR=0.98,95%CI=0.79~1.21);研究组周围神经病变总发生率显著低于对照组(RR=0.51,95%CI=0.30~0.76),差异均有统计学意义(P<0.05)。见表4。
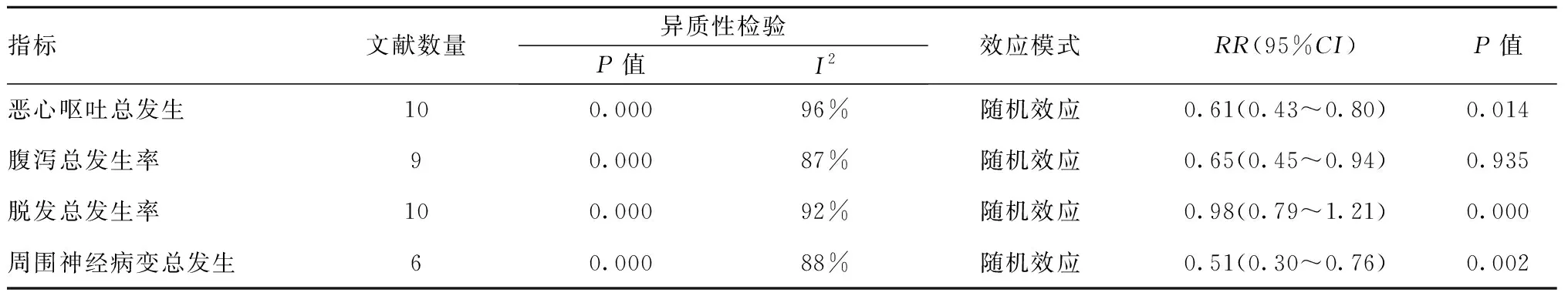
表4 两组临床相关症状发生率的Meta分析结果
2.5敏感性分析:采用Stata15.0软件自带的“Metainf”命令,以总体AEs发生率作为指标完成敏感性分析。结果显示,单用ICIs亚组中,Mok等[9]以及Rizvi等[13]研究对异质性影响明显,除去上述两项研究之后,各研究间的异质性改变显著(P=0.44,I2=0),试验组总体AEs发生率和对照组对比仍存在显著差异[RR=0.78,95%CI为0.75~0.8,P=0.000]。而应用ICIs联合化疗亚组内,Hellmann等[12]的研究对异质性影响明显,除去上述研究之后,各研究间的异质性改变显著(P=0.36,I2=10%),试验组总体AEs发生率和对照组对比不存在显著差异[RR=1.01,95%CI为0.99~1.03,P=0.30]。
2.6发表偏倚分析:将总体AEs发生率作为指标进行倒漏斗图的绘制,结果发现,单用ICIs亚组及应用ICIs联合化疗亚组与对照组比较的倒漏斗图两侧基本对称。经Egger检验发现,PICIs=0.808,PICIs+化疗=0.342,将其余指标进行发表偏倚分析获得结果均相似,提示了本研究发表偏倚概率较小。
3 讨论
ICIs在多种肿瘤治疗中的疗效均得到不少研究报道所证实[17-19],其可能是通过对PD-1/PD-L1以及细胞毒性T淋巴细胞相关蛋白4(CTLA-4)信号通路进行阻断,继而实现对肿瘤细胞的免疫耐受状态予以解除,进一步发挥抗肿瘤活性。随着近年来PD-1以及PD-L1等一系列ICIs开始被批准用于肿瘤的治疗,在极大程度上改善了患者的生存周期[20-22]。特别是纳武单抗以及帕博丽珠单抗因在NSCLC患者的治疗中展现出较为理想的效果,已被美国FDA批准用以治疗一线化疗后效果欠佳的晚期NSCLC患者的治疗中[23-24]。虽然,ICIs的疗效较为明显,但仍存在不容忽视的和治疗相关的AEs风险。且有研究报道显示,NSCLC患者在接受ICIs治疗时,不仅存在一定的irAEs发生风险,亦发现血液系统AEs以及临床相关症状等非irAEs的发生,从而在不同程度上对患者预后产生负面影响[25-26]。
本文结果提示ICIs单用或联合常规化疗治疗NSCLC患者的安全性较高,有利于降低AEs发生风险,考虑原因可能和ICIs毒性相对较低有关。此外,ICIs可促进机体免疫系统的重新激活,继而启动肿瘤杀伤,而T细胞的过度激活会引起各种不良反应的发生,患者存在一定的血液系统不良反应发生风险[27]。而本研究结果发现,研究组贫血、中性粒细胞减少症及血小板减少症总发生率均低于对照组。这在既往相关研究中均得以佐证,提示了ICIs对NSCLC患者的血液系统毒性较低。究其原因,可能是本研究所纳入的对照组均为接受常规化疗药物或安慰剂联合常规化疗药物治疗的NSCLC患者,其治疗方案和研究组存在明显差异,且所用药物可能存在较为明显的血液毒性。另外,研究组患者恶心呕吐、脱发及周围神经病变总发生率显著低于对照组。这表明了ICIs致非irAEs的风险较低,充分说明了ICIs应用于NSCLC中的安全性。然而,另有研究报道发现[28],ICIs联合化疗药物的恶心呕吐、腹泻、脱发发生率明显高于ICIs单药治疗。而本研究并未分析ICIs单用与联合常规化疗治疗NSCLC患者所致非irAEs发生率的差异。这为今后的研究提供了新的方向,可能通过开展大样本、多中心的研究,为ICIs的临床应用提供更为充足的证据。
综上所述,ICIs单药或联合化疗应用于NSCLC患者中的非irAEs发生率低于常规化疗药物或安慰剂联合化疗药物治疗,值得临床推广应用。然而,本研究尚且存在一定的局限性: ①本研究为了获取AEs发生率RR值,对单臂试验进行了排除,从而可能导致研究样本量不足。②在检索文献时仅限于中英文数据库,从而可能导致其他语言的高度相关文献未被纳入。③研究并未分析纳入对象种族、地区、年龄等因素对非irAEs发生风险的影响情况,从而可能导致研究结果发生偏颇。因此,本文结论仍需进一步大样本、多中心的RCT证实。
