轻度创伤性脑损伤患者日间过度嗜睡的相关危险因素
2023-03-02魏海棠
赵 强,彭 涛,魏海棠,肖 敏
(1.湖北省武汉市汉口医院康复科,湖北 武汉 430015;2.湖北省武汉市红十字会医院甲乳外科,湖北 武汉 430012)
随着城市建设和交通运输的飞速发展,创伤性脑损伤(TBI)发生率急剧上升,目前已成为不容忽视的全球公共卫生问题[1]。TBI根据严重程度可分为轻度、中度和重度,75%~85%TBI病例报道为轻度创伤性脑损伤(mTBI)[2]。mTBI可导致身体、认知、情感和社交领域的持续后遗症,其中,大约三分之一的患者表现为日间过度嗜睡(EDS),严重影响了患者的生活质量、事故风险以及认知和社会功能[3]。因此,阐明其发病机制在临床上具有重要意义。脑外伤后EDS的病理生理机制尚不清楚,但在本质上可能是异质性和多因素的[4]。此外,TBI常见的后遗症,如疼痛、焦虑和抑郁等会影响夜间睡眠,而夜间睡眠中断会对白天的觉醒状态产生负面影响[5]。因此,寻找创伤后EDS发病相关的危险因素,明确其发病机制是目前亟待解决的问题。迄今为止,大多数研究侧重于脑外伤后EDS的发病率、诊断和治疗,关于TBI后EDS发病风险因素报道较少。因此,本文分析了武汉市汉口医院收治的mTBI合并EDS患者,并与无EDS患者对比,寻找mTBI后EDS的潜在危险因素,以期为制定有针对性的预防和管理策略以及早期干预提供参考。
1 资料与方法
1.1一般资料:根据纳入标准和排除标准,本前瞻性队列研究纳入2018年1月~2020年12月武汉市汉口医院收治的mTBI患者89例,根据Epworth嗜睡量表(ESS)评分[6]是否≥10分分为EDS组62例,非EDS组27例。纳入标准:①符合mTBI临床诊断标准[7]:意识丧失<30 min,创伤后遗忘≤24 h,初始格拉斯哥昏迷量表评分为13~15分;②脑MRI未观察到特定病变;③受伤时年龄≥18岁;④1个月≤诊断mTBI<6个月。排除标准:①受伤时年龄>65岁;②既往有头部外伤、神经或精神疾病史;③既往或正在服用镇静剂;④酒精滥用;⑤书面及口语交流异常者。所有患者和健康人群均签署知情同意书。本次研究经过本院医学伦理委员会同意并获得批准(批准文号:WHSHKYY-002)。
1.2研究方法
1.2.1一般资料:记录mTBI患者的受伤时年龄、性别、学历、婚姻状况、职业、受伤原因、受伤后工作能力变化等一般资料。
1.2.2量表测定:采用ESS量表、匹兹堡睡眠指数量表(PSQI)[8]、视觉模拟量表(VAS)[9]、17项汉密尔顿抑郁量表(HAMD-17)[10]及汉密尔顿焦虑量表(HAMA)[11]对患者进行评定。ESS总分为24分,≥10分为患有EDS[6]。PSQI量表由19个自评和5个他评条目构成,包括睡眠质量、入睡时间、睡眠时间、睡眠效率、催眠药物和日间功能七个方面内容,每个方面按0~3等级计分,累积得分为PSQI总分,得分越高,表示睡眠质量越差。VAS总分为10分,≤3分为轻度疼痛,4分≤VAS评分≤7分为中度疼痛,VAS评分≥8分为重度疼痛。HAMA包括14个项目,采用0~4分的5级评分法,总分≤7分为正常,8~14分为焦虑倾向,≥15分为轻度焦虑,≥21分为中度焦虑,≥29分为重度焦虑。HAMD-17,亦采用0~4分的5级评分法,总分≤7分为正常,8~17分为抑郁倾向,18~23分为肯定有抑郁症,≥24分为严重抑郁症。以上量表均由2名培训后的临床医师进行评定,最终分数为两位医师的平均分。
1.2.3睡眠-觉醒评估:手表式活动记录仪(Actiwatch AW2,Respironics,Inc.1001)统一佩戴于手腕上,为期至少1 w,按照30 s/帧的长度,采集睡眠数据。佩戴Actiwatch的同时,同步辅以睡眠日记,记录夜晚上床睡眠和早晨觉醒的时间以及白天午睡的频率和持续时间。每周午睡次数≥3次,定义为频繁午睡[12]。睡眠监测结束时填写PSQI。Actiwatch记录结果采用专用分析软件,敏感度设定为中度,进行转换和分析,包括夜间卧床时间、睡眠和觉醒持续时间,计算睡眠效率百分比(夜间睡眠时间/卧床时间×100%)。
1.3统计学分析:采用SPSS22.0统计软件进行统计学分析。采用t检验、Pearsonχ2检验或Fisher检验和Wilcoxon 秩和检验分析mTBI后EDS与各个变量的关系,应用二元 Logistic 回归分析其危险因素。P<0.05为差异有统计学意义。
2 结果
2.1EDS组和非EDS组一般资料比较:EDS组年龄18~53岁,平均(35±9)岁,非EDS组年龄23~55岁,平均(38±10)岁。两组患者在性别、教育程度、婚姻和就业状况等方面差异无统计学意义(P>0.050),有可比性。但是,与非EDS组相比,EDS组中37例报告了中度至重度疼痛,并伴有明显的焦虑和(或)抑郁症状,差异具有统计学意义(P<0.05)。见表1。

表1 EDS组与非EDS患者的一般资料比较[n(%)]
2.2EDS组和非EDS组睡眠-觉醒模式比较:EDS组57例完成了睡眠监测,4例没有持续佩戴Actiwatch,1例佩戴时间少于1 w;而非EDS组24例完成了睡眠监测,2例佩戴Actiwatch时间少于1 w,1例没有完成睡眠日记。总体来看,两组患者之间的夜间睡眠-觉醒模式差异无统计学意义(P>0.05)。日间午睡方面,两组虽然在平均午睡时间和每周午睡次数差异无统计学意义(P>0.05),但EDS组白天频繁午睡的频率(61.4%)高于非EDS组(37.5%),差异有统计学意义(P<0.05)。此外,mTBI组每天睡眠时间超过8 h的患者比例和PSQI总分均高于非EDS组,差异有统计学意义(P<0.05)。见表2。

表2 EDS组和非EDS组睡眠-觉醒模式比较
2.3mTBI后EDS的危险因素:多因素分析显示,焦虑(HAMA评分≥15分)是mTBI后EDS患者唯一的独立危险因素,见表3。
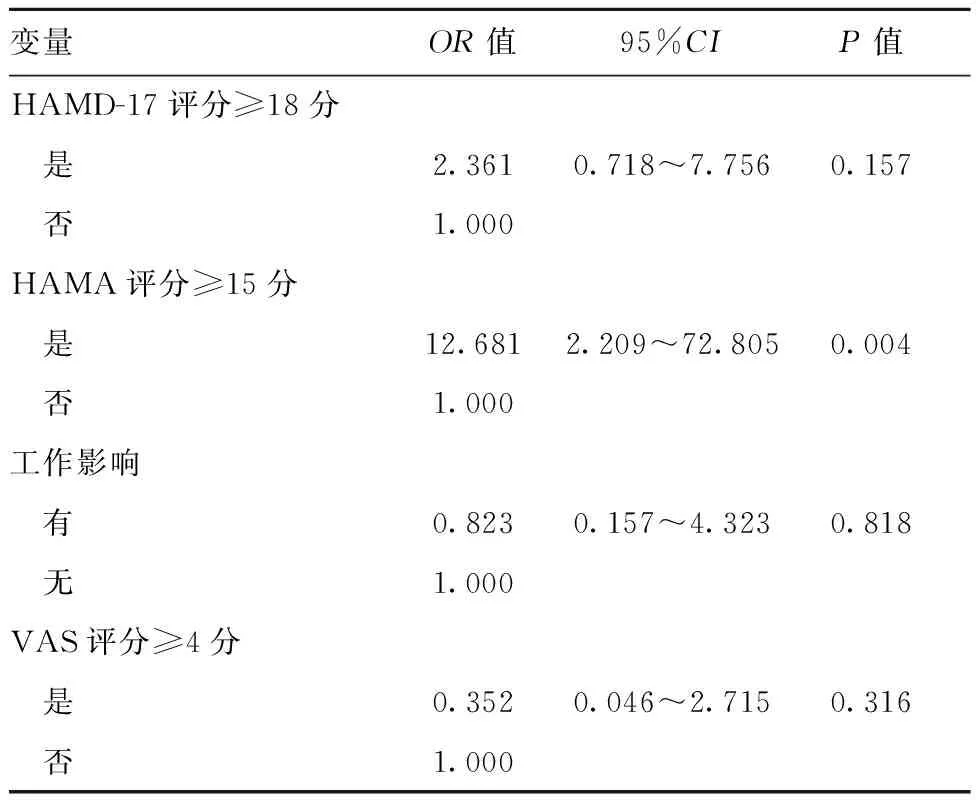
表3 mTBI后日间过度嗜睡危险因素的二元Logistic回归分析
3 讨论
创伤后嗜睡是一种过度嗜睡的疾病,发生在中枢神经系统创伤事件后18个月内,表现为睡眠时间过长、白天过度嗜睡或两者兼而有之[13]。ESS是目前国际公认的一种较为简易的嗜睡评估量表,其信度和效度较好,可以作为白天主观嗜睡严重程度的评估工具[14]。本研究对mTBI患者进行了睡眠状况调查,当采用ESS评分≥10分作为界定值时,89例患者中有62例(69.7%)被发现有主观EDS,远远高于其他中大型研究[15]。推测其原因为本研究的研究对象为mTBI患者,受伤时间普遍较短。据一项纵向研究[16-17]显示,在对TBI患者分别进行6个月和32个月的随访中,EDS的患病率从28%下降到12%。此外,食欲素是一种下丘脑神经肽,具有维持觉醒状态和调节睡眠-觉醒周期等功能[18]。研究表明,急性期TBI患者的脑脊液中食欲素水平较低或无法检测到,而6个月后可上升至正常范围[17]。这表明EDS可能会随着时间的推移而有所改善。本研究中,平均随访时间为49 d,可能为EDS的高患病率提供了一种解释。
尽管EDS是创伤后最常见的睡眠-觉醒障碍之一[1],但是影响其发病的危险因素和共病条件尚不清楚。本研究二元Logistic回归结果表明,在mTBI早期阶段,焦虑状态是EDS发病唯一相关的危险因素。在EDS患者中,出现焦虑和抑郁状态分别为60%和63%。有研究表明,焦虑和抑郁均会导致睡眠质量下降,白天更容易入睡[19]。抑郁症患者慢波睡眠产生减少和快速眼动睡眠机制紊乱,睡眠结构发生了改变[20],而广泛性焦虑症患者的夜间睡眠开始时间往往延迟[21]。此外,在焦虑程度较高的人群中,夜间觉醒更为频繁[22]。夜间睡眠的任何变化都可能影响白天的觉醒。因此,焦虑和抑郁可能通过夜间睡眠改变的次级效应而导致TBI患者的EDS。然而,Hayley等[23]则报道了不同的研究结果,即焦虑或抑郁与EDS之间没有关联。这些相互矛盾的结果表明,需要进一步研究精神症状与EDS之间的机制关系以及焦虑与抑郁之间的差异。
虽然最终预测模型中不包括疼痛,但睡眠、疼痛和心理健康是相互关联、相互影响的[24]。疼痛在TBI患者中非常常见,尤其是慢性头痛[25]。Chaput等[26]研究发现在脑外伤后的前6 w,有主观睡眠问题的个体比没有睡眠问题的个体患头痛的可能性高2.9倍(95%CI1.37~6.05)。Khoury 等[27]研究进一步表明,与没有疼痛的mTBI患者相比,伴疼痛的mTBI患者表现出明显的焦虑、抑郁和额外的睡眠变化,如在非快速眼动和快速眼动睡眠期间,额叶和前额叶β功率频率显著增加,这表明伴有疼痛的mTBI患者即使在睡眠时也可能处于一种相对的“觉醒”状态,这种状态可能会干扰睡眠的恢复功能,从而需要增加睡眠时长来补偿。因此,长期的慢性疼痛可能是脑外伤后睡眠需求增加的危险因素。在临床实践中,应对所有的新发脑外伤后睡眠障碍患者进行疼痛评估,而不仅仅是对失眠患者。
本研究存在一定的局限性。目前评估EDS的方法分为两类,ESS主要用于测量EDS的主观成分,客观评估多采用多次睡眠潜伏期测试(MSLT)。但MSLT耗时且昂贵,限制了其作为常规评估工具的使用。本研究虽然采用了方便、轻巧的手表式活动记录仪Actiwatch,但该设备无法对睡眠进行分期,也无法同时监测其他生理指标,只适用于对睡眠节律及睡眠时间的评估。此外,本研究没有关于参与者药物使用的数据。由于某些药物会影响睡眠和睡眠倾向,药物数据的缺失会造成无法排除其影响的情况。
脑外伤后EDS是一种异质和复杂的疾病,其病理生理学机制尚不清楚。本研究结果显示,mTBI患者EDS的患病率为40.7%。虽然与EDS相关的初始单变量因素是焦虑、抑郁、工作能力的变化和疼痛,但多变量分析中唯一的独立危险因素是焦虑。因此,对于脑外伤后EDS患者,临床医生应该对患者的情绪状态进行系统的评估和管理,从而为今后的治疗和干预提供信息。
