hs-CRP、Lp-PLA2、Hcy及SAA在老年急性缺血性脑卒中患者中的临床研究
2023-03-02李丽萍杨锐强
李丽萍,杨锐强
(佛山市复星禅诚医院检验科,广东 佛山 528000)
急性缺血性脑卒中(ACIS)是一种临床心血管疾病,占所有脑卒中的70%~80%,其发病机制复杂,目前认为与动脉粥样硬化(AS)、高脂饮食、吸烟和遗传易感性密切相关[1],慢性炎性反应和氧化应激是AS发展的重要因素[2]。脂蛋白磷脂酶A2(Lp-PLA2)是一种源自炎性细胞的酶,被称为与炎性反应和AS斑块不稳定有关的血管炎性反应标志物,参与促进与心血管疾病密切相关的AS[3]。同型半胱氨酸(Hcy)是蛋氨酸代谢循环中产生的氨基酸,通过诱导过氧化物酶的产生和增加氧自由基活性,导致血管内皮损伤及AS增强[4]。超敏C-反应蛋白(hs-CRP)是外周血中众多炎性反应标志物中应用最广泛的急性蛋白。hs-CRP升高也被发现是包括脑卒中在内的心血管疾病发展的最重要的独立风险因素之一[5]。血清淀粉样蛋白A(SAA)作为一种急性时相反应蛋白,是炎性反应的敏感血清指标,对炎性反应有很好的预测功能,被认为是脑卒中的独立危险因素[6]。本研究分析了老年ACIS血清hs-CRP、Lp-PLA2、Hcy及SAA水平的变化,探讨四项联合检测的诊断价值。
1 资料与方法
1.1一般资料:选取2021年1月~2021年12月佛山市复星禅诚医院收治的老年ACIS患者。①入选标准:符合2018年ASA/AHA中ACIS诊断标准且头颅MRI或CT提示明显脑梗死灶[7];年龄>65岁。②排除标准:既往脑卒中史;存在恶性肿瘤、血液系统疾病、免疫系统疾病;合并严重肝、肾等重要脏器疾病者;合并活动性感染;另选择同期体检健康者45例作为对照组。两组性别、年龄、体重指数(BMI)、合并高血压、合并糖尿病,差异无统计学意义(P>0.05)。见表1,具有可比性。本次研究经过本院医学伦理委员会同意。

表1 两组一般资料比较
1.2方法
1.2.1血清hs-CRP、Lp-PLA2、Hcy及SAA水平的测定:观察组及对照组人群于清晨空腹采集静脉血3 ml,3 000 r/min,离心10 min,取上层血清至于-70℃保存待测。使用免疫比浊法检测Lp-PLA2,试剂盒由南京诺尔曼生物技术有限公司提供;hs-CRP检测方法为乳胶增强比浊法,Hcy检测方法为酶循环法(试剂盒均购自北京九强生物科技有限公司);SAA检测方法为胶乳免疫比浊法,试剂盒由上海奥普生物医药有限公司提供。
1.2.2神经功能损伤严重程度:美国国立卫生研究院卒中量表(NIHSS)被用来评估观察组脑卒中神经功能障碍的严重程度。观察组根据NIHSS评分分为轻度组(<4分,n=50)、中度组(4~15分,n=35)和重度组(>15分,n=35)。
1.3统计学方法:采用 SPSS 22.0 及Excel对数据进行统计学分析,以P<0.05 为差异有统计学意义。
2 结果
2.1两组血清hs-CRP、Lp-PLA2、Hcy及SAA水平比较:观察组血清hs-CRP、Lp-PLA2、Hcy及SAA水平均高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组血清hs-CRP、Lp-PLA2、Hcy及SAA水平比较
2.2不同程度神经功能损伤患者血清hs-CRP、Lp-PLA2、Hcy及SAA水平比较:在老年急性缺血性脑卒中患者中,不同程度神经功能损伤患者间血清hs-CRP、Lp-PLA2、Hcy及SAA水平差异具有统计学意义(P<0.01),随着神经功能损伤程度的加重,血清hs-CRP、Lp-PLA2、Hcy及SAA水平逐步上升。见表3。

表3 不同程度神经功能损伤ACIS患者血清hs-CRP、Lp-PLA2、Hcy及SAA水平比较
2.3hs-CRP、Lp-PLA2、Hcy及SAA对老年ACIS的诊断性能:四项联合检测对老年ACIS的诊断性能明显高于单项检测。见表4。
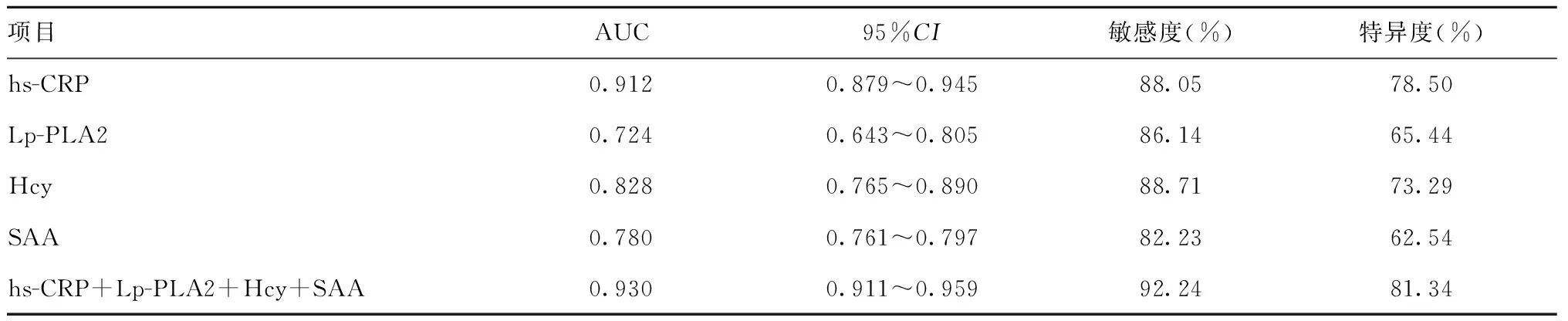
表4 hs-CRP、Lp-PLA2、Hcy及SAA对老年ACIS的诊断性能
3 讨论
ACIS是老年人最常见的脑血管疾病之一,随着高血压和糖尿病等慢性疾病的增加,ACIS在老年人群中的发病率也越来越年轻化。AS作为ACIS的病理基础,而hs-CRP、Lp-PLA2、Hcy及SAA又在AS发生、发展中扮演重要的角色[8],所以探讨老年ACIS患者血清的hs-CRP、Lp-PLA2、Hcy及SAA水平,对预防和评估ACIS有重要的临床价值。
CRP作为最早发现的急性时相蛋白,是重要的炎性反应标志物,由于传统CRP多使用免疫比浊法进行检测,其敏感性较低,目前多使用高敏感度的hs-CRP作为预测血管事发生的标志物[9-10]。当机体产生炎性反应时,hs-CRP水平急剧上升,补体系统被激活,而纤溶系统受到抑制,促进血栓的形成,导致脑卒中的发生发展[11]。
Lp-PLA2是血管特异性炎性因子,由单核巨噬系统分泌,它能水解低密度脂蛋白中的氧化磷脂,形成如氧化游离脂肪酸和溶血卵磷脂的脂质促炎物质,导致动脉粥样硬化斑块的形成和泡沫细胞在循环中的出现和沉积[12-13]。Lp-PLA2 抑制剂已被证明可有效缓解AS和抑制炎性反应,因此,Lp-PLA2可以作为心脑血管事件的预测因子[14]。本研究与沈惠敏等[15]的研究一致。同时,随着ACIS患者神经功能损伤的加重,血清中Lp-PLA2水平也逐步升高。Ashrafi-Asgarabad等[16]研究显示,血清中高水平Lp-PLA2将增加2倍脑卒中发生风险,同时导致预后不良。
Hcy是蛋氨酸代谢的中间产物,介导氧自由基和炎性因子的产生,对内皮细胞造成损伤,被认为是心脑血管疾病的独立危险因素[17]。 它可以促进血管平滑肌细胞增殖,增加泡沫细胞的产生,并促进血小板聚集和随之而来的 AS 斑块形成[18]。 此外,氧化的 Hcy 通过增加氧化自由基的产生来加速酯的氧化代谢。 加重的内皮细胞损伤会影响患者的预后。
SAA是一种由肝细胞合成分泌的急性时相反应蛋白,在炎性反应状态下主要产生SAA1和SAA2[19],炎性反应期间血浆浓度可增加1 000倍。SAA结构与载脂蛋白A-I相似,可与高密度脂蛋白结合并抑制卵磷脂胆固醇酰基转移酶的活性,降低HDL清除胆固醇的效率,引起脂质的沉积[14]。
本研究结果显示,虽然单独检测具有较好的诊断价值,但多项联合检测能互补验证,进一步提高检测的敏感度和特异度,可从血管内皮细胞损伤、血管壁炎性反应等方面分析ACIS患者的病理生理情况,为临床诊断治疗提供依据。
综上所述,ACIS患者血清hs-CRP、Lp-PLA2、Hcy及SAA水平均显著升高,且与患者神经功能损伤的严重程度具有相关性,可作为AIS病情评估的辅助指标。
