电子加速器辐照灭菌对肺热普清散质量的影响*
2023-03-02采金金谢和兵尼玛次仁白玛旦增
采金金,谢和兵△,尼玛次仁,白玛旦增
(1.安徽中医药大学药学院,安徽 合肥 230012;2.长三角药物高等研究院,江苏 南通 226133;3.江苏神猴医药研究有限公司,江苏 南通 226000;4.西藏神猴药业有限责任公司,西藏 日喀则 857000)
肺热普清散(藏药名洛才更赛)始载于16世纪的《验方百编》,目前收载于《中华人民共和国卫生部药品标准·藏药:第一册》[1]中,为西藏神猴药业有限责任公司独家生产的藏药复方制剂。该药方主要含天竺黄、红花、力嘎都、甘草、木香、铁棒锤幼苗等药材,有清肺泄热、消炎功效,可用于小儿肺炎、流行性感冒、风热、疠热的治疗。该方采用传统藏药生产工艺,药材生药粉碎后直接包装为成品,按中国药典内服散剂微生物控制的质量要求进行灭菌处理。本研究中比较了不同强度电子束辐照前后肺热普清散性状、显微粉末特征、薄层色谱(TLC)鉴别、含量的变化,为该药灭菌方法选择提供参考依据[2-3]。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1100型高效液相色谱仪(美国Agilent公司)、XSR205DU/AC型十万分之一天平(瑞士Mettler Toledo公司);JA10003N型千分之一天平、UC-250DE型超声清洗器、DHG-9030A型电热恒温鼓风干燥箱(上海精其仪器有限公司);WMS-1037型生物显微镜(上海无陌光学仪器有限公司);DX-10/20型电子加速器(中广核戈瑞<深圳>科技有限公司)。
1.2 试药
肺热普清散[西藏神猴药业有限责任公司,批号分别为20200901(样品1),20200902(样品2)];羟基红花黄色素A对照品(批号为111637-202111,含量≥96.8%)、木香烃内酯对照品(批号为111524-201911,含量≥99.9%)、去氢木香内酯对照品(批号为111525-201912,含量≥99.5%),均购自中国食品药品检定研究院;甲醇为色谱纯,磷酸为优级纯,其余试剂均为分析纯,水为娃哈哈纯净水。
2 方法与结果
2.1 样品性状
取2批样品各6份,采用电子加速器辐照灭菌,辐照剂量分别为0,4,6,8,10,12 kGy。通过日光下目视、口尝、鼻嗅直观判断。结果,与0 kGy比较,不同剂量辐照灭菌后样品外观、色泽、气味均未发生明显变化,说明该辐照灭菌对样品性状无明显影响。样品性状见图1。

图1 样品性状A.Sample 1 B.Sample 2Fig.1 Appearance of samples
2.2 显微鉴别
参照2020年版《中国药典(四部)》通则2001显微鉴别法,取上述经辐照的2批样品粉末过5号筛,挑取少许,滴加甘油醋酸试液,置生物显微镜下观察。结果,0 kGy辐照剂量下,2批样品花粉粒众多,类圆形、卵圆形或橄榄形,有3个萌发孔,外壁有齿状突起;有红棕色或黄棕色分泌细胞(红花)纤维梭形,单个散在的草酸钙簇晶(力嘎都);不同剂量辐照灭菌后,红花和力嘎都特征均仍可见,且与0 kGy比较无明显变化。显微图见图2。
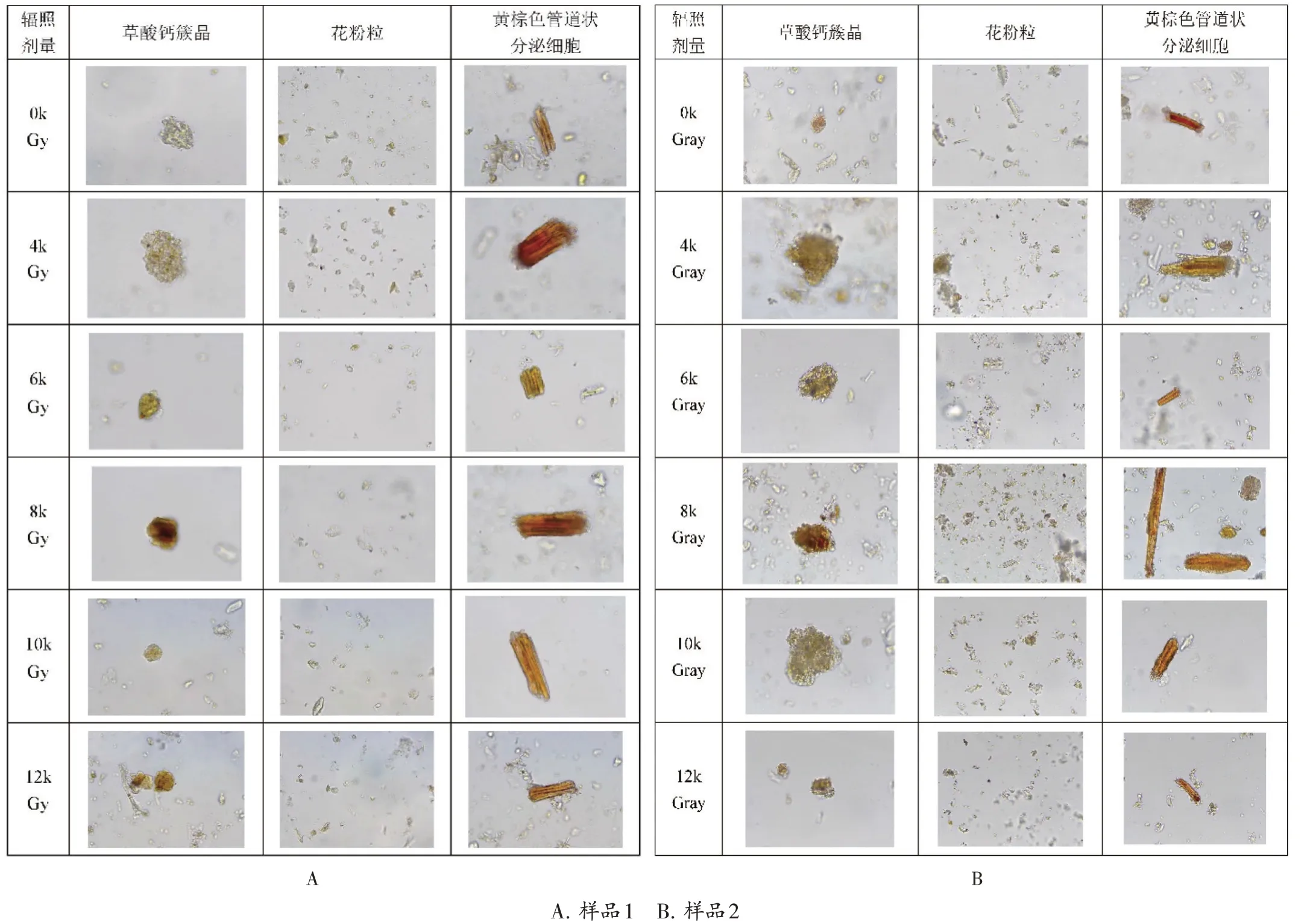
图2 样品显微图A.Sample 1 B.Sample 2Fig.2 Micrograph of samples
2.3 TLC鉴别
取上述经辐照的2批样品5 g,加甲醇25 mL,超声(功率250 W,频率40 kHz;下同)处理30 min,滤过,取续滤液,作为供试品溶液。取去氢木香内酯对照品、木香烃内酯对照品,分别加甲醇制成每1 mL含0.5 mg的溶液,作为单一对照品溶液。按肺热普清散处方及工艺制备缺木香的阴性样品,按供试品溶液制备方法制得阴性对照品溶液。参照2020年版《中国药典(四部)》通则0502薄层色谱法,吸取上述溶液各5μL,同一批号溶液点于同一硅胶G薄层板,以环己烷-甲酸乙酯-甲酸(32∶5∶1,V/V/V)的上层溶液为展开剂,展开,取出,晾干,喷以1%香草醛硫酸乙醇溶液,加热至斑点显色清晰,置日光灯下检视。结果供试品溶液色谱中,在与对照品溶液色谱相应位置上均显相同颜色斑点,阴性对照无干扰。TLC图见图3。
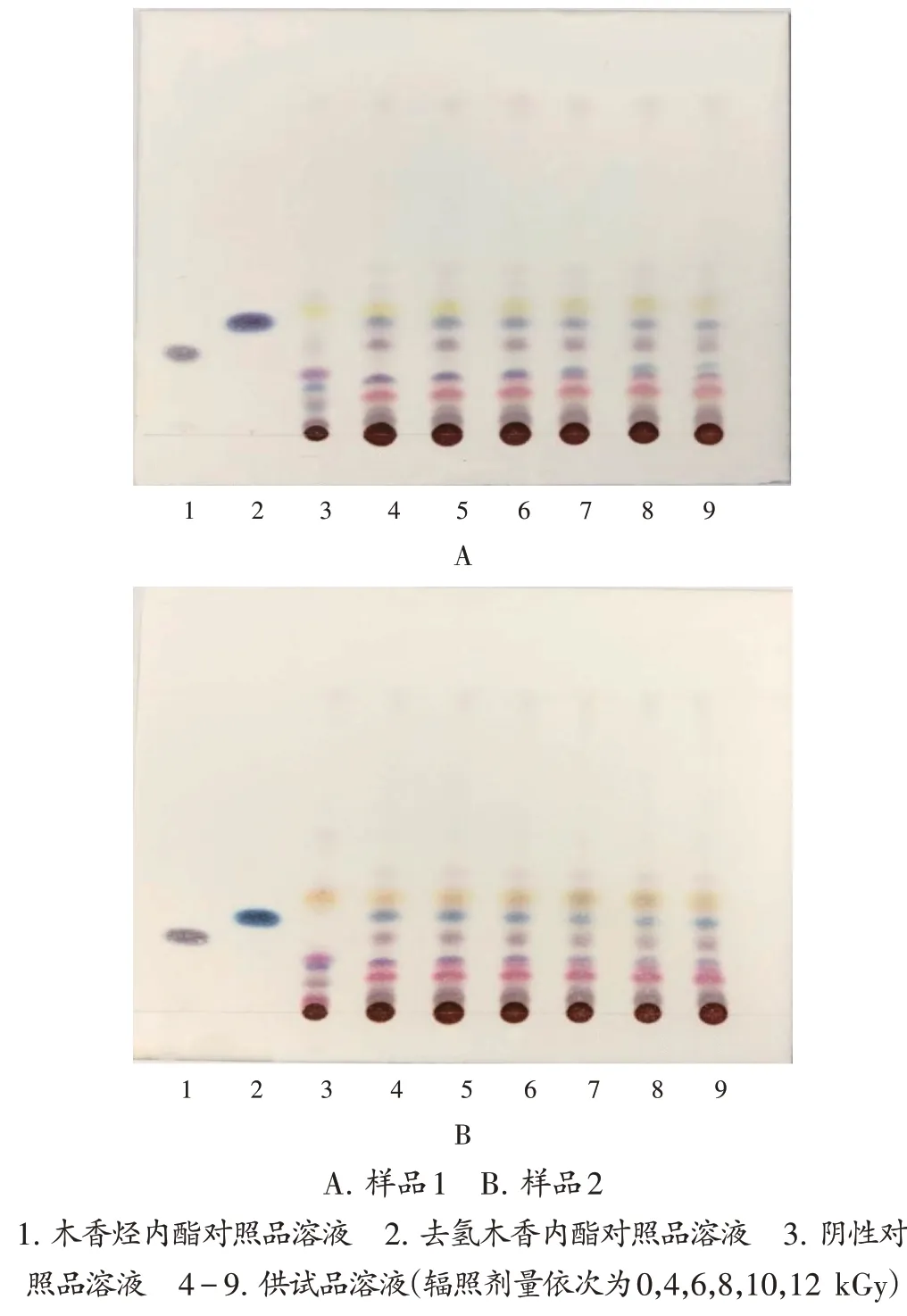
图3 肺热普清散薄层色谱图A.Sample 1 B.Sample 2 1.Costunolidereferencesolution 2.Dehydrocostuslactonereferencesolution 3.Negative reference solution 4-9.Test solution(the irradiation dose is 0,4,6,8,10 and 12 kGy,respectively)Fig.3 TLC chromatograms of Feirepuqing Powder
2.4 含量测定
2.4.1 色谱条件及系统适用性试验
色谱柱:UltimateXB-C18柱(250 mm×4.6 mm,5μm);流动相:甲醇-0.1%磷酸溶液(30∶70,V/V);流速:1 mL/min;检测波长:403 nm;柱温:30℃;进样量:10μL。理论板数按羟基红花黄色素A峰计应不低于3 000,基线分离良好。
2.4.2 溶液制备
取羟基红花黄色素A对照品适量,精密称定,加50%甲醇制成1 mL含52μg的溶液,即得对照品溶液。取样品粉末(过3号筛)约1.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,称定质量,超声处理60 min,取出,放冷,再次称定质量,用50%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
方法学考察:按相关规定进行精密度、稳定性、重复性试验及加样回收试验。结果前3个试验结果的RSD均小于1.0%,表明仪器精密度良好,供试品溶液在室温放置16 h内基本稳定,方法重复性良好;平均加样回收率为100.30%,RSD为0.44%(n=6)。
含量测定:取2批样品各6份,予相应辐照灭菌后每份样品(过3号筛)取约1.5 g,按2.4.2项下方法制备供试品溶液,按2.4.1项下色谱条件进样测定,记录不同剂量辐照灭菌后2批样品中羟基红花黄色素A的含量。详见表1。
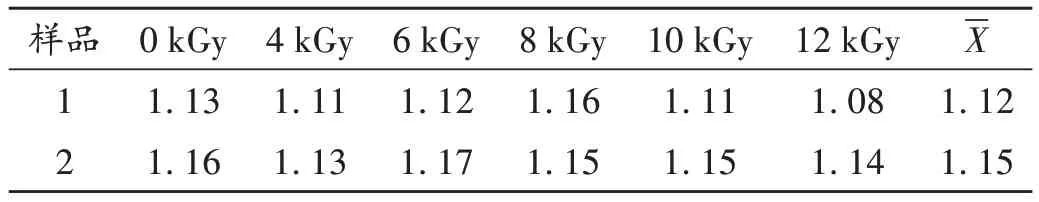
表1 样品中羟基红花黄色素A含量测定结果(mg/g,n=2)Tab.1 Results of content determination of hydroxysafflor yellow A in the samples(mg/g,n=2)
2.5 微生物检查
按2015年版《中国药典(四部)》通则中无菌产品微生物限度检查相关规定[包括通则1105(微生物计数法)、通则1106(控制菌检查法)及通则1107(非无菌药品微生物限度标准)],检查样品细菌菌落总数、霉菌酵母菌菌落总数、大肠菌群菌落总数。与0 kGy比较,经不同剂量辐照后,2批样品细菌菌落总数、霉菌酵母菌菌落总数均显著减少(P<0.05)。辐照剂量为4 kGy时,霉菌及酵母菌均已无法检出;为8 kGy时,霉菌、酵母菌及细菌菌落均未检出。大肠菌群一直未检出。结果见表2。
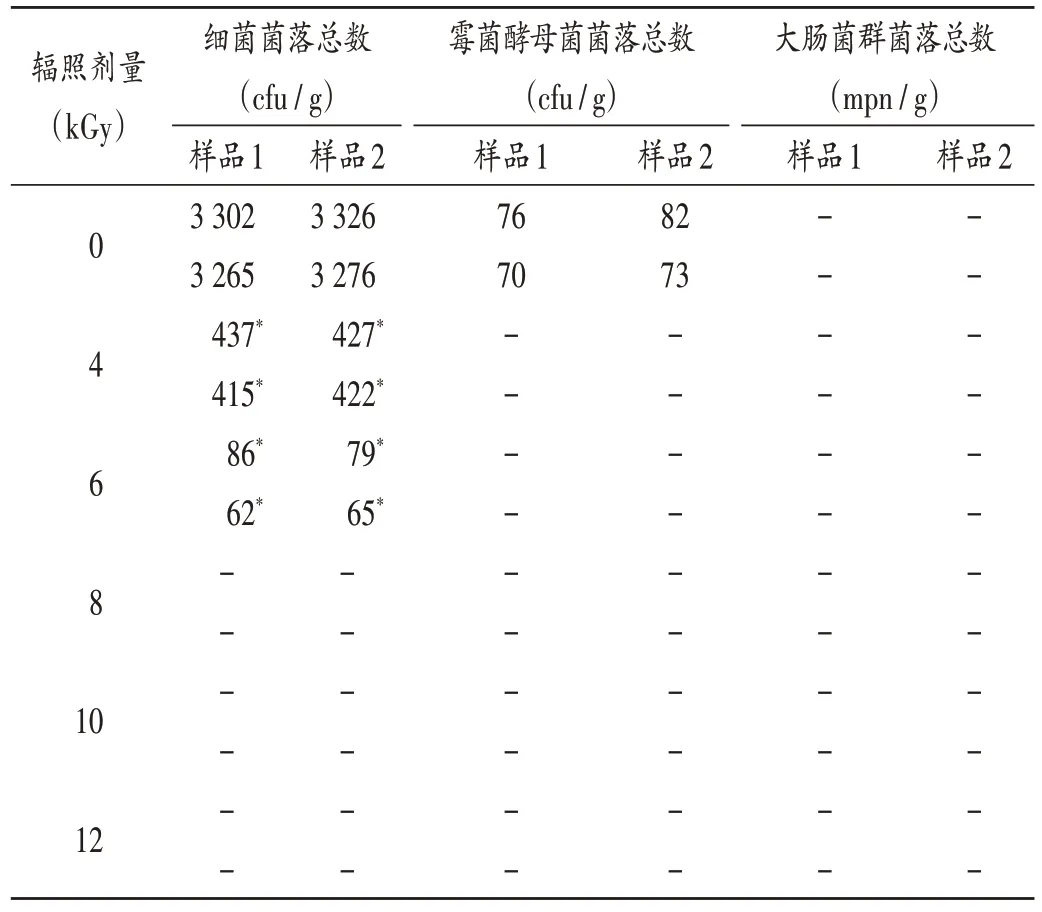
表2 样品微生物限度检查结果(n=2)Tab.2 Microbial limit test results of samples(n=2)
3 讨论
藏药遵循传统藏医药理论,多以原生药粉直接入药制成丸剂、散剂,整个过程中无高温蒸煮等工序,致使生产中无法精准控制微生物,导致藏成药微生物限度很难达到《中国药典》标准,严重限制了传统藏药产品的临床应用[4-7]。
目前中药常用的灭菌方法有湿热灭菌法、干热灭菌法、微波灭菌法等[8-18],但均因会导致生药药粉色泽变深、挥发性成分逸散而不适用于肺热普清散。电子加速器辐照灭菌利用电子加速器产生的高能电子束照射物质达到灭菌目的,相较传统的湿热、干热、紫外灭菌等,最大优势为属冷灭菌,穿透性更高、更环保,更适用于含生药材粉及挥发性成分较多的藏成药的灭菌。此外,电子加速器辐照还具有辐照束流定向、能量利用充分、效率高和不产生放射性废物等优点[19-25],是国家大力鼓励发展的新兴产业。随着电子加速器制造技术的不断进步,电子加速器辐照在中药、食品灭菌领域得以广泛使用,但对传统含有藏药材生药粉的藏成药的辐照灭菌研究仍较少。
2015年11月,原国家食品药品监督管理总局《中药辐照灭菌技术指导原则》要求,采用辐照灭菌必须遵循“必要、科学、合理、安全、有效、稳定”原则。本研究中在综合分析基础上确定拟采用的最大辐照剂量,以确保中药的安全、有效、质量稳定[26-32]。
综上所述,本研究中建立的各检测方法,可为藏药肺热普清散的辐照灭菌提供参考,也为部分藏成药灭菌方案的选择提供新思路。
