TLR4/MyD88/NF-κB 信号通路对甲基苯丙胺依赖CPP 大鼠海马的影响
2023-03-01朱婷娜曹媛媛刘鹏亮王一航吴亚梅李利华赵永娜洪仕君
张 园 ,朱婷娜 ,曹媛媛 ,刘鹏亮 ,王一航 ,吴亚梅 ,李利华 ,赵永娜 ,洪仕君
(1)昆明医科大学药学院暨云南省天然药物药理重点实验室;2)法医学院;3)国际教育学院,云南 昆明 650500)
甲基苯丙胺(methamphetamine,MA),属于苯丙胺类兴奋剂,可进入血脑屏障导致大脑的结构和功能的改变[1],其滥用诱发大脑多个脑区发生不同程度的神经损伤,从而诱导中枢神经系统神经毒性的产生[2]。研究发现[3]MA 依赖引起的神经毒性损伤海马脑区损伤有重要联系。MA 诱导海马神经毒性的产生与单胺类神经递质释放增加[4−5]、ROS 和NOS 的产生、大脑免疫细胞的激活、凋亡与自噬[6]和神经炎症[7]等有关。Toll 样受体(Toll like receptors,TLR),能够调控免疫及炎症反应[8],主要在小胶质细胞中表达[9]。TLR4细胞内信号通路分为髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖性和β 干扰素TIR 结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)依赖性通路。在MyD88 依赖途径中当外界因素触发后,细胞表面的刺激信号通过TLR4-MyD88-TRAF6-IκBPIκB-NF-κB 分子传递到细胞核,从而调节相关炎症因子的转录[10]。颅脑外伤可以诱导神经元凋亡和神经炎症,从而导致严重的神经元损害和行为障碍[11],其中TLR4/MyD88/NF-κB 信号通路的激活是造成中枢神经系统损伤的关键原因。在体外实验中脂多糖损伤的 BV2 小胶质细胞和神经炎症损伤的原代皮层神经元中采用TLR4 抑制剂 TAK-242 所产生的抗神经炎症作用主要是与TLR4 介导的 MyD88/NF-κB 信号通路的调节有关[12]。Li B 等[13]的体外实验表明阻断 TLR4 介导的信号转导,TLR4/MyD88/NF-κB 和 MAPK 通路的激活便会受到影响,从而抑制 BV-2 小胶质细胞中脂多糖刺激所产生神经炎症。TLR4/MyD88/NF-κB 作为一条经典的炎性通路,在MA 诱导的海马神经炎症中具有较大的研究价值。本研究旨在探究研究TLR4/MyD88/NF-κB 信号通路对甲基苯丙胺CPP 大鼠海马的影响,同时采用特异性抑制剂TAK-242 抑制TLR4,在改善MA 依赖海马神经炎症中的作用,为药物干预甲基苯丙胺依赖提供新的科学证据。
1 材料与方法
1.1 材料
实验动物:健康雄性SD 大鼠40 只,选择体重在180~200 g,购于昆明医科大学实验动物学中心[动物使用许可证编号:SCXK(滇)K2015-002]。
药品试剂:实验所用甲基苯丙胺,由云南省公安厅禁毒技术公安部重点实验室合法提供,纯度在98%以上。BestarTMqPCR RT Kit、荧光定量试剂盒(DBI Bioscience);引物合成(擎科生物科技有限公司);TLR4 受体抑制剂(TAK-242,A3850,Apexbio 公司MyD88 抗体(ab2064,Abcam 公司);TRAF6 抗体(66494,Proteintech 公司);IκB-α抗体(9242,CST 公司);p-IκB-α 抗体(2859,CST 公司);NF-κB p65 抗体(8142s,CST 公司);p-NF-κB p65 抗体(sc-136548,Santa Cruz Biotechnology 公司);TLR4 抗体(sc-293072,Santa Cruz Biotechnology 公司);β-actin 抗体(ab6276,购自美国Abcam 公司)。
主要仪器:大鼠 CPP 实验箱(XR-XT401,上海欣软信息有限公司);酶标仪(Touch 2,美国BioTek 公司);普通PCR 仪、荧光定量 PCR 仪(T100TM Thermal Cycler、C1000 Touch TM Thermal Cycler,美国Bio-Rad 公司);垂直电泳仪、半干转膜仪(552BR、221BR,美国Bio-Rad 公司)。
1.2 实验方法
1.2.1 实验动物分组及给药健康雄性SD 大鼠40 只,随机分配为4 组,包括生理盐水组:腹腔注射(生理盐水(10 mg/kg,qd,14 d);MA 实验组:给药 MA(10 mg/kg,ip,qd,14 d),大鼠形成MA 依赖,CPP 模型建模成功;TAK-242 组:给药 TAK-242(3 mg/kg,ip,qd,14 d);MA+TAK-242 组:给药 TAK-242(3 mg/kg,ip,qd,14 d)后1 h 给予 MA(10 mg/kg,ip,qd,14 d)。
1.2.2 条件性位置偏爱模型(CPP)连续3 d 将随机分组的大鼠放入实验检测的黑白箱中以适应检测环境,第4 天检测每只大鼠的天然偏好时间;连续14 d 对大鼠以10 mg/kg 的MA 进行腹腔注射给药,使得大鼠产生依赖,再进行CPP 检测。
1.2.3 WesternBlot 实验用 10%的水合氯醛,按0.3 m L/100 g 麻醉后迅速水合氯醛麻醉大鼠,用0.9%的氯化钠注射液对大鼠心脏灌注,将脑血管中的血液冲洗干净断头,取出全脑,分离大鼠海马组织解剖大鼠,取大鼠海马组织,匀浆,测定蛋白浓度。配制10%和12%的分离胶;上样、电泳,转膜、孵育一抗(β-actinantibody Anti-TLR4、Anti-Myd88、Anti-TRAF6、Anti-IκB-α、Anti-pIκB-α、Anti-NF-κBp65、Anti-P-NFκBp65 均按照1∶1000 配制),放入4 ℃过夜,1xTBST 漂洗3 次,温室孵育二抗(2 h),再次漂洗,采用ECL 显影。Image Pro Plus 图像分析软件分析目的条带与对应内参(β-actin)条带二者平均光密度比值,最后进行统计学分析。
1.2.4 荧光定量PCR 实验取海马组织80 mg,放入 EP 管中,匀浆,用酶标仪测定RNA 浓度;按照说明书逆转录合成cDNA;荧光实时定量PCR 仪,经94 ℃ 5 min 预变性、94 ℃变性、58 ℃退火、72 ℃延伸,此循环进行40 次,采用2-ΔΔCt法计算目的基因的相对表达量,荧光定量PCR 引物序列见表1。

表1 荧光定量PCR 引物序列Tab.1 Fluorescence quantitative PCR primer sequence
1.3 统计学处理
采用 SPSS 19.0 进行数据分析,数值代表均数±标准差()表示,用于统计分析的Prism软件5.0 作图(GraphPad software),组内给药前后比较采用配对t检验;组间多组比较采用多因素方差分析(Multi-factor analysis of variance),多重比较方法采用 Tukey-HSD,P<0.05 为差异有统计学意义。
2 结果
2.1 甲基苯丙胺依赖CPP 大鼠海马中TLR4、MyD88、TRAF6、IκB-α、p-IκB-α、NFκBp65、p-NF-κBp65 蛋白表达
TLR4 蛋白变化:图1A 结果显示与生理盐水组相比,MA 组TLR4 蛋白表达升高(P<0.01);与MA 组相比,MA+TAK-242 组TLR4 的蛋白表达下降(P<0.01)。
MyD88 蛋白变化:图1B 结果显示与生理盐水组相比,MA 组MyD88 蛋白表达升高(P<0.01);与MA 组相比,MA+TAK-242 组MyD88 蛋白表达下降(P<0.01)。
TRAF6 蛋白变化:图1C 结果显示与生理盐水组相比,MA 组TRAF6 的蛋白表达升高(P<0.01);与MA 组相比,MA+TAK-242 组TRAF6的蛋白表达下降(P<0.01)。

图1 大鼠海马中TLR4/MyD88/NF-κB 信号转导通路蛋白表达水平变化。Fig.1 The protein expression of TLR4/MyD88/NF-κB signal transduction pathway in the hippocampus of rats
p-IκB-α 蛋白变化:图1D 结果显示与生理盐水组相比,MA 组p-IκB-α 蛋白表达升高p-IκB-α 蛋白表达升高(P<0.05),与MA 组相比,MA+TAK-242 组p-IκB-α 蛋白表达下降(P<0.01)。
IκB-α 蛋白变化:图1E 结果显示与生理盐水组相比,MA 组IκB-α 蛋白表达降低(P<0.01);与MA 组相比,MA+TAK-242 组IκB-α蛋白表达升高(P<0.01)。
p-NF-κBp65 蛋白变化:图1F 结果显示与生理盐水组相比,MA 组p-NF-κBp65 蛋白表达升高(P<0.05);与MA 组相比,MA+TAK-242 组的p-NF-κBp65 蛋白表达下降(P<0.05)。
NF-κBp65 蛋白变化:图1G 结果显示与生理盐水组相比,MA 组NF-κBp65 蛋白表达升高(P<0.01);与MA 组相比,MA+TAK-242 组的NF-κBp65 蛋白表达下降(P<0.05)。
上述结果提示MA 可通过TLR4/MyD88/NFκB 信号通路诱导MA 依赖CPP 大鼠海马发生神经炎症。
2.2 甲基苯丙胺依赖CPP 大鼠海马中TLR4、MyD88、TRAF6、IκB-α、NF-κBp65mRNA表达
TLR4 mRNA 表达变化见表2 和图2A,结果显示与生理盐水组相比,MA 组TLR4mRNA 表达上升(P<0.01);与MA 组相比,MA+TAK-242组TLR4mRNA 表达下降(P<0.01)。
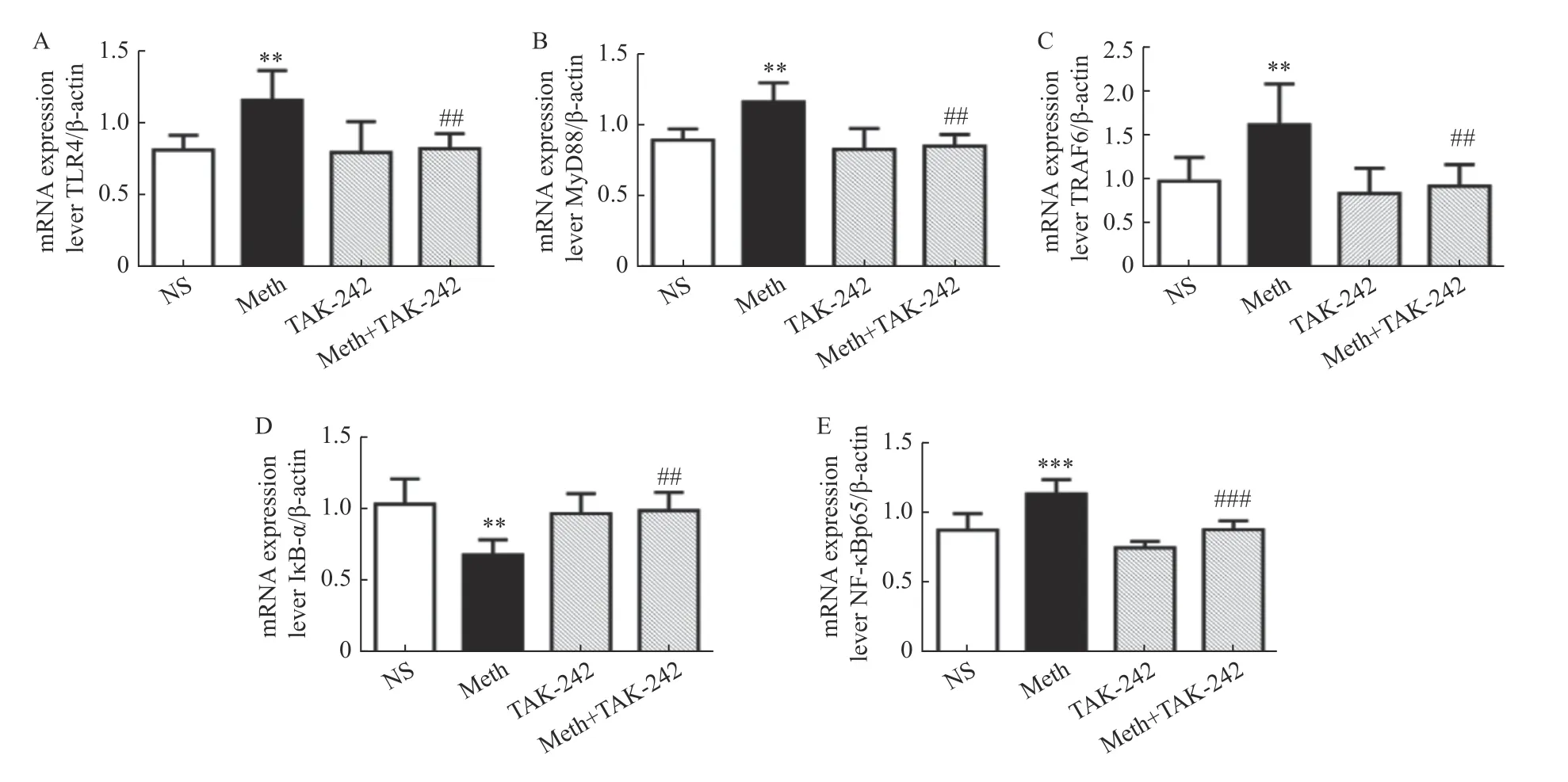
图2 大鼠海马中TLR4/MyD88/NF-κB 信号转导通路的mRNA 表达水平统计结果Fig.2 The mRNA expression of TLR4/MyD88/NF-κB signal transduction pathway in the hippocampus
表2 大鼠海马中TLR4/MyD88/NF-κB 信号转导通路的mRNA 表达(n=6,)Tab.2 The mRNA expression of TLR4/MyD88/NF-κB signal transduction pathway in the hippocampus of rats(n=6,)

表2 大鼠海马中TLR4/MyD88/NF-κB 信号转导通路的mRNA 表达(n=6,)Tab.2 The mRNA expression of TLR4/MyD88/NF-κB signal transduction pathway in the hippocampus of rats(n=6,)
与对照组进行比较,**P < 0.01,***P < 0.001;与MA组进行比较,##P < 0.05 ,###P < 0.001。
MyD88 mRNA 表达变化:表2 和图2B 结果显示与生理盐水组相比,MA 组MyD88mRNA 表达上升(P<0.01);与M 组相比,MA+TAK-242组MyD88mRNA 表达下降(P<0.01)。
TRAF6 mRNA 表达变化:表2 和图2C 结果显示与生理盐水组相比,MA 组TRAF6mRNA 表达上升(P<0.01),与MA 组相比,MA+TAK-242组TRAF6mRNA 表达下降(P<0.01)。
IκB-α mRNA 表达变化:表2 和图2D 结果显示与生理盐水组相比,MA 组IκB-α mRNA表达下降(P<0.01),与MA 组相比,MA+TAK-242 组IκB-α mRNA 表达上升(P<0.01)。
NF-κBp65 mRNA 表达变化:表2 和图2E结果显示与生理盐水组相比,MA 组NF-κBp65 mRNA 表达上升(P<0.001),与MA 组相比,MA+TAK-242 组NF-κBp65 mRNA 表达下降(P<0.001)。
3 讨论
已有研究表明,MA 依赖诱导海马神经炎症,造成了神经系统的损害。炎性因子过渡累积就会对机体产生严重的危害,其中与损害最为严重的海马脑区为例。本研究发现MA 依赖的CPP 大鼠激活了海马脑区TLR4/MYD88/NF-κB 信号通路,诱导了海马神经炎症的发生。
TLR4 作为天然免疫识别受体,通过Myd88通路发挥作用[14,15]。本研究表明:与对照组相比,MA 组TLR4、MyD88、TRAF6 蛋白和mRNA 表达均增加。Xie 等[16]的研究发现,在MA 中毒大鼠模型中,MA 可使大鼠纹状体中 TLR4,MyD88,TRAF6 蛋白表达增加;Du 等的研究在 MA 中毒小鼠模型中,MA 也可使中脑和纹状体中TLR4蛋白表达增加[8,17],上述结果均与与本研究结果一致,但是本研究对于海马脑区的检测不仅包含上述因子蛋白水平的变化,还在mRNA 水平进一步验证了MA 依赖可通过激活TLR4/MyD88 信号通路,诱导海马神经炎症发生。Qing-Peng Hu 等[18]的研究表明,组蛋白乙酰化调节抑制剂(histone deacetylase inhibitor,HDACI)可抑制TLR4/MYD88信号通路中TLR4 的表达,从而抑制小胶质细胞激活和神经元凋亡,这就表明阻断TLR4 对神经炎症诱导的脑损伤具有潜在的神经保护作用。本研究采用TLR4 受体抑制剂TAK-242 预处理,特异性地抑制了海马脑区TLR4 的表达,减少了MyD88、TRAF6 的蛋白及mRNA 的表达。
研究发现多种分子机制可以介导炎症过程,其中最显著的机制是通过核因子NF-κB 信号通路[19],磷酸化的NF-κB 抑制因子(inhibitor of NFκB,IκB),使IKB 降解,进而激活NF-κB,其中p65 是NF-κB 的主要活性亚单位[20]。本研究采用Western blot 检测MA 依赖CPP 大鼠海马中p-IκB-α、NF-κBp65、p-NF-κBp65 蛋白表达均增加,IκB-α 的蛋白表达下降。Liu X 等发现[21],苦碟子注射液(KDZ)可通过下调TLR4依赖性 NF-κB 信号通路,降低TRAF6、NFκBp65 和p-IκBα/IκBα 的蛋白表达,保护大脑免受缺血性损伤。Long H 等也发现[22],在大鼠Tourette 综合征(TS)模型中,TS 大鼠纹状体中IκB-α 蛋白表达降低,p-IκB-α 蛋白表达升高,结果均与本研究一致。不同的是本研究采用特异性TLR4 拮抗剂TAK-242 预处理后,p-IκBα、NF-κBp65、p-NF-κBp65 蛋白表达降低,IκB-α 蛋白表达增加。此外,本研究发现IκBαmRNA 表达降低、NF-κBp65 mRNA 表达增加,结果与蛋白水平一致。采用TLR4 受体抑制剂(TAK-242)预处理,特异性地抑制了海马脑区TLR4 的表达,减少了的NF-κB 通路关键蛋白及mRNA 的表达,从而减轻MA 依赖大鼠海马脑区的神经炎症。
综上所述,TLR4/MyD88/NF-κB 信号通路参与了MA 依赖大鼠CPP 效应的形成,该信号通路的激活可以诱导MA 依赖大鼠海马神经炎症的发生。采用特异性的TLR4 抑制剂可以改变TLR4/MyD88/NF-κB 信号通路相关的因子的表达,减轻MA 依赖的海马神经炎症。