带状疱疹后神经痛动物模型及其机制研究新进展 *
2023-03-01吴松斌杨少敏黄佳彬孙武平熊东林肖礼祖
吴松斌 杨少敏 黄佳彬 孙武平 熊东林 肖礼祖
(华中科技大学协和深圳医院疼痛科,深圳市疼痛学实验室,深圳, 518052)
水痘-带状疱疹病毒 (varicella zoster virus, VZV)是一种人类嗜神经疱疹病毒[1]。VZV 的原发性感染通常会导致水痘,水痘痊愈后病毒可在神经节中建立潜伏感染(见图1)[2]。健康人群中潜伏感染的VZV 并不具备致病性,而在老年人或免疫系统低下人群中,潜伏的VZV 可能会重新激活,并导致带状疱疹(herpes zoster, HZ),表现为急性局部疱疹样皮肤损伤[3]。研究表明,5%~30%的HZ 病人在皮肤损伤恢复后可能会遭受持续超过3 个月的剧烈疼痛,这种由VZV 诱发的神经病理性疼痛称为带状疱疹后神经痛 (postherpetic neuralgia, PHN)[4]。
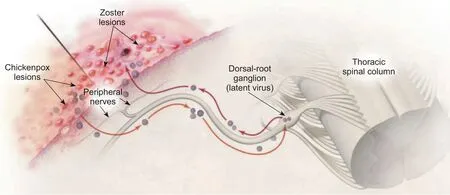
图1 感觉神经神经节VZV 潜伏期的建立以及HZ 的发病示意图 [4]
据报道,接种VZV 疫苗可以在一定程度上预防HZ 和PHN 发生,但不能用于HZ 和PHN 治疗,同时疫苗也缺乏长期的上市后监测。HZ 发病后,缺乏有效的治疗方法用于预防或延缓PHN 发生。抗病毒药物与糖皮质激素(如泼尼松)的联合使用在临床上具有降低PHN 风险的潜力,但在疱疹皮损发生后的有效用药时间较短[5]。发病早期及时、有效用药意味着需要在HZ 或病毒重新激活的早期状态下进行快速诊断,但在临床上很难实现。即使HZ 病人得到了快速的诊断和治疗,其对预防和减轻相关疼痛的效果仍然有限[6]。PHN 病人长期伴有的顽固性疼痛将导致其身体残疾、睡眠不良和心理社会功能障碍等。这不仅严重干扰他们的正常生活,同时也极大增加了家庭和社会经济负担[7,8]。由于全球老龄化人口不断增长,在未来十年中,HZ 和PHN的发病率将呈明显增长趋势,PHN 的有效防治将成为亟待解决的健康问题[9]。
目前,对于PHN 的治疗方法虽多种多样,但从根本上均无法彻底治愈PHN,仍有相当一部分病人得不到有效地控制,究其根本原因在于PHN 的病理机制尚未明确[10]。动物疾病模型是医学科学研究不可或缺的重要工具,可被广泛应用于实验病理学、实验生理学和治疗药物筛选等研究。鉴于PHN在临床治疗上的种种难题以及未知的致病机理,如能寻找到与临床症状相似的PHN 动物模型用于PHN 的病理机制研究将有助于PHN 的有效治疗。
事实上,一些PHN 啮齿类动物模型已被报道。1999 年,Fleetwood-Walker 等[10]首次证实了足底接种VZV 感染物能够诱发大鼠产生异常疼痛行为。然而,该模型不能有效模拟PHN 病人的所有临床特征。此外,由于VZV 病毒感染具有严格的人类特异性,使得VZV 在动物模型中无法建立有效的复制性感染,这成为了阻碍病毒增殖与疱疹相关疼痛之间关系的研究[11]。为了解决这一难题,研究人员已经尝试用替代的建模方法来研究VZV 感染,包括接种人类胎儿组织的严重联合免疫缺陷(severe combined immune deficiency, SCID)小鼠模型的VZV病毒感染[12];用猴水痘病毒(simian vari cella virus,SVV,一种导致猴水痘疱疹的VZV 同源病毒)接种恒河猴[13];接种单纯疱疹病毒1 型(herpes simplex virus, HSV-1,一种类似于VZV 的嗜神经病毒)。其中,已有相关报道HSV-1 感染可在啮齿动物模型中诱发PHN 样疱疹性疼痛,并且由于能够模拟自然病毒感染和易于成模,使得HSV-1 受感染的啮齿动物模型更为常用[14,15]。
本文主要综述目前国内外PHN 动物模型的研究进展,重点介绍VZV 与HSV-1 诱导的PHN 动物模型的建立方法和疼痛行为学表现。该模型的应用对于PHN 病理机制探索和相关药理学研究具有重要的价值。
一、VZV 和HSV-1 的病毒学特征
VZV 和HSV-1 属于人类嗜神经性α 疱疹病毒,通常在人类生命早期感染[16]。初次感染后,VZV和HSV-1 都在人类外周神经节中建立潜伏期。VZV是水痘的病原体,其再激活会导致带状疱疹,而潜伏的HSV-1 可能反复激活,临床上表现为典型的唇疱疹[17]。
VZV颗粒为多边形至球形,直径约150~200 nm,由三个蛋白质层组成:含有病毒双链DNA (dsDNA)基因组的核衣壳、围绕核衣壳的被覆层和病毒糖蛋白朝外的包膜(见图2)[18]。HSV-1 和VZV 基因组结构中均有一个独特的长UL和一个由重复区域(RL和RS)组成的独特的短US 区域。尽管VZV 的UL区域的方向与HSV-1 的方向相反,且基因组大小比HSV-1 病毒基因组较小得多,但它们的基因组结构高度相似[19]。
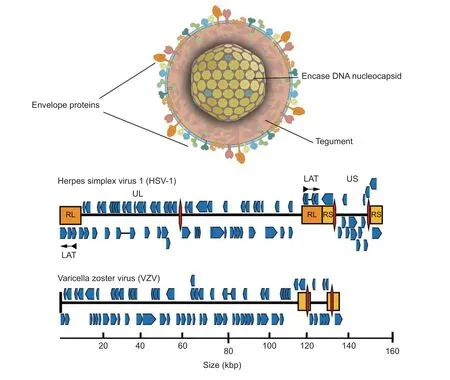
图2 VZV 和HSV-1 基因组 [18]
二、PHN 动物模型的研究现状
1. VZV 诱导的PHN 动物模型研究现状
由于VZV 感染具有严格的种属特异性,在动物身上还不能激活潜伏的带状疱疹病毒,因而难以模拟与临床症状相似的典型的带状疱疹后神经疼痛症状[20]。长期以来,众多研究者致力于寻找一种与PHN 临床症状相近的动物模型。最初,Fleetwood-Walker 等[21]将VZV 感染非洲绿猴肾细胞(CV-1细胞),待细胞出现80%病变时,将50 μl 含有4×106个病变细胞的PBS 磷酸盐溶液注射到大鼠后肢足垫皮下,并利用vonFrey 尼龙丝和热板装置评估大鼠的疼痛行为学。结果显示在病毒注射后33 天内可引发大鼠显著的神经病理性疼痛,表现为异常的机械痛敏和热痛敏行为。在后续研究中,Dalziel 等[22]以4~8×106个VZV 感染的CV-1 细胞(VZV 组)或未感染的CV-1 细胞(对照组)注射到大鼠左后爪足垫中,并将vonFrey 尼龙丝测试时间延长至VZV 注射后100 天,结果显示大鼠足垫接种病毒3 天后可出现持续的异常性疼痛,随后发展为慢性机械性异常性疼痛,疼痛至少持续60天,并在VZV 注射后100 天内逐渐缓解(见图3)。

图3 VZV 诱发大鼠异常性疼痛的持续时间[22]
Hasnie 等[23]以Dumas 和Ellen 两种不同的VZV病毒株感染原代人胚肺成纤维细胞,以50 µl 平均密度为6~8×106个细胞/75 cm2培养瓶的原代人胚肺成纤维细胞(病毒诱导80%的细胞发生病变)接种到大鼠左后肢足垫中,研究不同VZV 病毒株和不同病毒接种量与大鼠机械超敏反应之间的关系,结果表明大鼠的机械超敏反应与接种的VZV病毒株类型无关,所有病毒株的感染均与剂量依赖性机械性超敏反应有关,但与热或冷痛超敏反应无关。此外,为评估VZV 感染动物能否产生焦虑样行为以及该焦虑样行为是否与机械超敏反应相关。Hasnie 等[23]在上述Dumas-VZV 病毒株诱发的PHN大鼠模型中,通过在开放区域(100 cm×100 cm)和中央区域(40 cm×40 cm)的旷场实验表明,VZV 感染的大鼠表现出类似焦虑的活动模式(即减少进入开放区域的中央区域),并且与机械性超敏反应呈正相关。这也显示了由VZV 诱导的神经病理性疼痛大鼠模型可反映出与临床相似的疼痛相关的合并症,如焦虑、抑郁(见图4)。
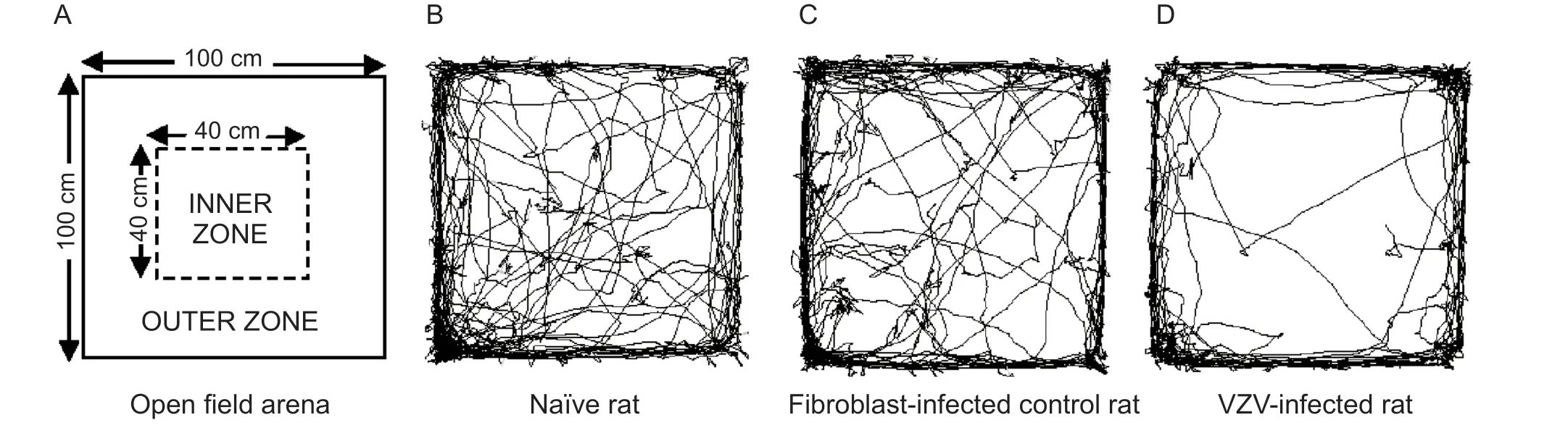
图4 VZV 诱发大鼠产生类似焦虑的活动模式 [23]
2. HSV-1 诱导的PHN 动物模型研究现状
将VZV 接种到大鼠中可诱发机械性异常性疼痛和热痛觉过敏,却不会引起带状疱疹。与VZV同属α 疱疹病毒亚科的HSV-1,能够克服种属特异性,对小鼠具有较强的感染性并能在小鼠各种组织脏器中复制[24]。临床上,初次感染HSV-1 后,HSV-1 也能潜伏于感觉神经节中,在感觉神经节中潜伏的HSV-1 重新激活将导致单纯疱疹,这在一定程度上提示了单纯疱疹可以作为一种有效模拟带状疱疹引发PHN 的可能性[14]。
Takasaki 等[25]在模型制作3 天前利用脱毛膏将6 周龄雌性BALB/c 小鼠右侧腹部以下区域的毛发除去,并以接种量为1×106菌斑形成单位(plaque-forming units, pfu) 的HSV-1 病毒液接种到小鼠右后肢(胫骨或股骨)皮肤下,通过vonFrey尼龙丝评估小鼠疼痛行为,并通过聚合酶链反应(polymerase chain reaction, PCR)检测病毒基因组复制情况。结果显示,在HSV-1 接种第5 天后小鼠接种侧出现带状疱疹样皮肤病变同时伴随着异常性疼痛和痛觉过敏,该现象可持续到第8 天(见图5)[26]。同时,HSV-1 接种后第2 天至第8 天内可在小鼠背根神经节(dorsal root ganglion, DRG)中检测到HSV-1 DNA,病毒DNA 含量在第5 天达到峰值。
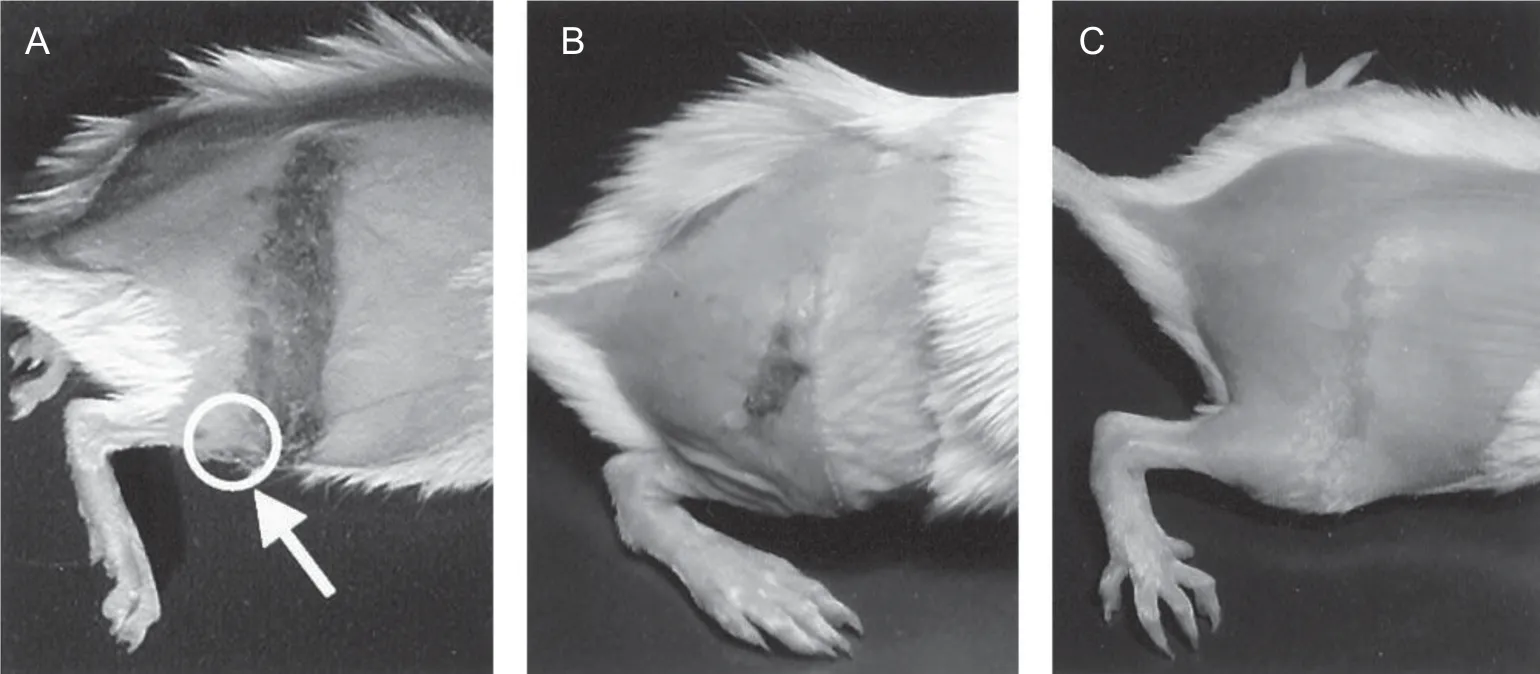
图5 HSV-1 感染小鼠产生带状疱疹样皮肤损伤 [26]
Sasaki 等[27]将10 μl 感染复数为1×106pfu 的HSV-1-7401H 病毒液接种于雌性C57BL/6J 小鼠右后爪股骨的皮肤上,并利用vonFrey 尼龙丝评估小鼠疼痛行为学表现,结果显示接种HSV-1 小鼠的接种部位和同侧足底区域产生疱疹样囊泡,皮损从病毒接种后第4 天开始形成,第7 天最为严重,可持续到第21 天,并且在疱疹出现阶段可观察到小鼠出现舔、抓病变皮肤等行为。疼痛行为学测定结果显示,在HSV-1 接种3 天后,可诱发小鼠产生异常性疼痛;在接种HSV-1 第7 天后,所有小鼠均产生异常性疼痛,且从病毒接种后第7 天至第21 天异常性疼痛程度略有增加。随着实验时间的延长,即使由HSV-1 诱导的皮损愈合(HSV-1 接种后第21~42 天),所有小鼠也显示出异常性疼痛。
Silva 等[28]在模型制作3 天前,利用剃毛器和脱毛膏将雄性57BL/6 小鼠(20~25 g)腹部右侧和右脚脱毛,3 天后,用砂纸在小鼠右后爪胫骨皮肤上刮出面积为5 mm×5 mm 伤痕后涂抹20 μl 感染复数为2×105pfu 的HSV-1 病毒液,并通过vonFrey细丝评估小鼠的疼痛行为学表现。结果显示,接种HSV-1 可诱发60% (n= 6/10)的小鼠产生带状疱疹样皮肤损伤,皮损从病毒感染3 后天可见,到第7天逐渐愈合。此外,在HSV-1 感染后5~21 天内观察到小鼠产生机械性疼痛超敏反应(见图6)。
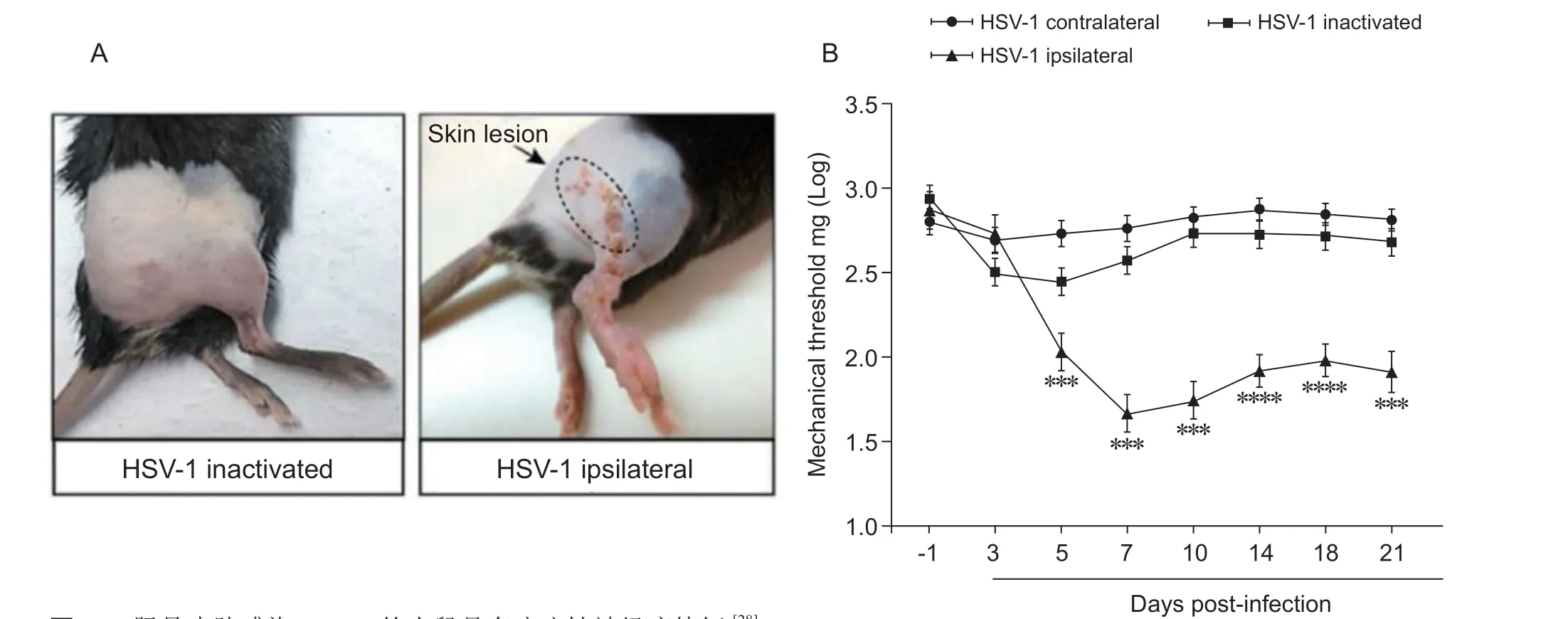
图6 胫骨皮肤感染HSV-1 的小鼠具有疱疹性神经痛特征 [28]
三、现有动物模型揭示PHN 发病机制
VZV 从潜伏期到激活状态是PHN 的诱因,但从VZV 激活到PHN 的发病过程目前尚未明确。通过对已有啮齿动物模型的研究,使得PHN 可能的发病机制被逐渐解析。
1.病毒的激活感染
与其他神经病理性疼痛不同,PHN 是由于潜伏在神经节中的VZV 激活感染所致。一些研究结果显示,VZV 感染神经元后,病毒基因在神经元中的转录可能是慢性疼痛的诱因,即通过炎症机制的诱导或是影响蛋白质的表达(如VZV 转录物作为改变宿主细胞基因表达模式的转录调节剂)[25,28]。VZV 编码基因63 (ORF63) 被认为对维持病毒潜伏期至关重要,因为在潜伏期ORF63 具有高丰度表达[29]。在VZV 感染的大鼠DRG 中检测到IE62 和IE63 病毒蛋白,其中IE62 蛋白与A 和 C 传入感觉神经元的标记物共表达[30]。在HSV-1 诱导的PHN小鼠模型中,病毒能够在DRG 和初级感觉神经元中增殖,病毒基因组可在20%至30%的DRG 神经元中检测到[31,32]。HSV-1 基因的表达在病毒接种后第4 至7 天显著增加,随后迅速下降,在此期间,伴随着带状疱疹样皮损在接种皮肤中爆发[25,28]。
2.剧烈的免疫炎症反应
最初,免疫炎症反应被认为是带状疱疹相关性疼痛的一个关键因素,因为带状疱疹与神经节的炎症以及伴随的运动和感觉根退化有关。在HSV-1诱导的PHN 小鼠模型中,巨噬细胞和中性粒细胞组成的白细胞浸润病毒感染的DRG,浸润的白细胞负责驱动TNF-α 和S100A9 等炎性介质的产生,并导致疱疹性神经痛的发展[28,33]。通过分子(靶向S100A9)或药理学(抗炎药物)等手段抑制免疫炎症反应,能够有效缓解病毒引起的机械性疼痛[33,34]。
3.外周神经纤维丢失
临床证据表明,PHN 可能是由神经节中神经元甚至脊髓神经元的兴奋性改变引起的,特别是由病毒引起神经系统受损区域神经元的过度兴奋[35]。VZV注射于大鼠足垫诱导的PHN 显示出外周神经支配的减少和神经元群体的改变[36]。在HSV-1 诱导的疼痛模型疱疹样皮损和DRG 中,C 纤维神经元显著减少,但A 纤维神经元保持不变,这也表明了PHN 动态异常性疼痛主要与感觉C 纤维神经元损伤有关[32]。
4.胶质细胞异常活化
Silva 等[33]首次报道了感觉神经节中的神经免疫-胶质细胞相互作用是维持急性疱疹性神经痛的发生的关键因素。Kong 等[37]和Zhang 等[38]的结果显示,VZV 诱导的PHN 大鼠模型中脊髓背角星形胶质细胞被显著激活,鞘内给予L-α-氨基己二酸(星形胶质细胞特异性抑制剂)可显著减轻机械性异常疼痛。
5.离子通道功能异常
离子通道的异常表达也是PHN 神经元过度兴奋的原因。在PHN 大鼠的DRG 中,α2δ1 钙通道、Nav1.3 和Nav1.8 离子通道的表达增加,这被认为与VZV 诱导的神经性疼痛有关[30]。在HSV-1 诱导的疼痛模型中,TNF/TNFR1 信号通路通过下调卫星胶质细胞中内向整流的K+通道Kir4.1 并损害K+稳态来介导疱疹性神经痛发生[28]。
6.疼痛相关基因表达模式改变
Guedon 等[36]利用基因微阵列芯片研究VZV诱导的PHN 大鼠模型,基因微阵列数据显示DRG基因表达模式发生显著变化,其中包括伤害感受相关基因NTRK2、TRPV1 和Calca (CGRP) 的表达上调。
四、小结与展望
在过去的二十年中,已经建立了模拟PHN 的啮齿动物模型,并通过观察其特定行为来评估动物的伤害感受。然而,目前没有一个单一的模型能够诠释PHN 的全部临床特征,也没有一个单一的疼痛行为学测定能够在动物中完成全面评估。因此,需要根据自身的实验需求以设计实验并谨慎、合理地选择合适的模型。对于上述两种啮齿类动物模型,显著的区别在于病毒能否在神经系统增殖。HSV-1诱导的疼痛模型不仅可用于研究PHN 的发病机制,筛选相关抗病毒和镇痛药物,还可作为其他具有嗜神经特性病毒(如脊髓灰质炎病毒、狂犬病病毒等)的研究范式。尽管VZV 诱导的大鼠模型缺乏一些临床表现,如疱疹样皮损和病毒复制,但由VZV潜在感染引起的异常性疼痛和痛觉过敏持续存在,这也为研究PHN 的发生和发展机制以及寻找新的镇痛靶点提供了潜力。
疱疹病毒感染模型的制作需要严格的实验环境(特殊的病毒培养室和动物接种室),而通过单次腹腔注射树脂毒素(reciniferatoxin, RTX,200 或250 μg/kg),已被报道可以用于模拟PHN 病人的独特感觉变化[39]。例如,一些PHN 病人表现出机械痛觉过敏增加,但热痛觉减退(对热不敏感),这种独特的感觉体征在RTX 模型中也可被观察到,因此该模型也可为了解PHN 独特临床特征背后的机制和筛选靶向药物提供了有用的研究工具[40]。
回顾PHN 模型的发展,主要困难之一是VZV的严格人类特异性。类似的嗜神经病毒(如HSV-1)已经尝试建立PHN 研究的模型。然而,不同的病毒可能通过不同的生物途径影响疱疹相关性疼痛的发生。由于VZV 是导致PHN 的唯一病原体,如何在啮齿类动物模型中使用VZV 毒株来克服这种特异性感染是值得研究者思考的方向。也有报道指出细胞受体胰岛素降解酶(insulin degrading enzyme, IDE)已被鉴定为是VZV 感染的潜在关键受体,其可通过识别VZV 糖蛋白IE61 协助病毒感染,基于此,在啮齿类动物中的受体人源化也有可能克服VZV的物种特异性感染[41]。
事实上,这两种模型的疼痛是基于急性VZV或HSV-1感染,偏离了人类PHN进展的正常途径(病毒从潜伏到激活感染)。迄今为止,尚未有VZV再激活的动物模型的报道。然而,研究者已尝试通过免疫抑制等方法在猴水痘病毒(SVV)感染模型中诱导病毒再激活,这为进一步优化VZV 或HSV-1 诱导的PHN 模型提供了方向[13]。如果能够开发出一种有效的病毒再激活模型并显示PHN 样疱疹性疼痛,将填补PHN 与病毒潜伏-再激活之间未知关系的空白,并有望成为更为可靠的PHN 动物模型。
利益冲突声明:作者声明本文无利益冲突。
