骨痛灵方通过抑制整合素αvβ3 通路缓解肺癌骨转移癌性疼痛*
2023-03-01孟唤男郭晓冬周小翠王立玉徐振晔
孟唤男 郭晓冬△ 周小翠△ 陈 舲 王立玉 吕 英 徐振晔
(1 上海中医药大学附属岳阳中西医结合医院肿瘤科,上海 200437;2 上海市黄浦区打浦桥街道社区卫生服务中心,上海 200020;3 上海中医药大学附属龙华医院肿瘤科,上海 200032)
肺癌是最常见和最致命的恶性肿瘤之一,其中非小细胞肺癌所占比例近85%,并且经常扩散到骨骼(30%~40%),远处骨转移已成为肺癌终末期病人死亡的主要原因[1]。肺癌骨转移病人长期遭受着骨癌痛折磨,生活质量和生存期显著降低[2]。目前针对肺癌骨转移治疗方案,最新《肺癌骨转移诊疗专家共识》推荐[3]首选骨改良药物第三代双磷酸药物唑来膦酸为基础用药,通过抑制破骨细胞的活性,诱导其凋亡,有效抑制破骨细胞的骨吸收等机制治疗骨转移、控制疼痛[4]。但长期使用唑来膦酸易产生发热等流感样症状、疲劳、腹泻、便秘等不良反应,使癌痛治疗被迫终止,影响镇痛效果。骨转移癌痛是目前肿瘤治疗领域的一个难点问题,因此寻求更加有效的镇痛药物具有重要意义。
恶性肿瘤发生骨转移疼痛主要机制为“肿瘤细胞-破骨细胞-肿瘤微环境”变化诱发癌痛:肿瘤细胞在骨骼着床,引起破骨细胞大量增殖,骨吸收活性增强,导致骨质破坏,同时引起骨髓微环境呈酸性,H+激活初级感觉神经元上的酸敏感性离子通道,从而引起痛觉过敏[5,6]。近年来的研究显示,在破骨细胞表面呈现高表达αvβ3 整合素,可以介导由肌动蛋白构成的微丝结构通过聚合作用形成伪足小体,紧密附着于骨表面,并在附着区形成封闭腔,破骨细胞在该腔内释放氢离子和各种酶类进行骨质溶解[7]。破骨细胞的黏附和伪足小体形成是破骨细胞进行骨溶解的前提和关键。在此过程中,αvβ3 整合素的连接和信号转导作用以及足突小体的形成起着关键性的作用。而且研究表明,使用αvβ3 整合素抑制剂可以抑制破骨细胞的活跃[7]。
骨痛灵方以中医补肾坚骨为理论指导,以补肾养精,破瘀通络为治疗原则,是我科根据上海市名中医肿瘤专家徐振晔教授治疗肺癌骨转移疼痛的经验制订的协定方。在我们前期的临床对照研究中发现,骨痛灵联合唑来膦酸治疗恶性肿瘤骨转移疼痛的疗效确切[8,9]。此外,课题组还发现骨痛灵方可通过抑制RANKL/RANK/OPG 通路对破骨细胞生成的干预作用,从而发挥镇痛疗效[10]。破骨细胞骨吸收直接反映了骨溶解的状态,骨溶解所带来的炎性反应和神经损伤,是造成骨转移疼痛的关键。目前骨痛灵方对破骨细胞骨吸收机制尚不清楚。本研究为进一步分析骨痛灵治疗肺癌骨转移疼痛的具体机制,拟在前期研究基础上,采用Lewis 肺癌细胞建立C57BL/6 小鼠肺癌骨转移癌痛模型,用骨痛灵方进行治疗,以破骨细胞的骨吸收关键分子αvβ3整合素作为切入点,为其更广泛的临床应用提供理论依据。
方 法
1.动物及细胞株
C57BL/6 雄性小鼠,周龄4~6 周,50 只,重量 (20±2) g,Specific pathogen-free (SPF) 级,购自上海灵畅生物科技有限公司,实验动物生产许可证号:SCXK(沪)2018-0003 。饲养于上海中医药大学附属岳阳中西医结合医院动物房,实验动物使用许可证号:SYXK(沪)2018-0040。饲养条件:SPF 级屏障环境中,每日10 h 人工照明,室内温度为25℃,湿度为70%。本研究经上海中医药大学附属岳阳中西医结合医院实验动物伦理委员会的批准(YYLAC-2019-002)。
荧光素酶标记小鼠肺癌Lewis 细胞系 (2LL-LUC),批号为GF401,购自上海歌凡生物科技有限公司。细胞培养方法:2LL-LUC 细胞用含10% 胎牛血清的DMEM 培养基培养,并于37℃,5% CO2培养箱中培养传代。
2. 药物制备
骨痛灵方由淫羊藿(8030721097) 15 g,骨碎补(8010861097) 15 g,煅自然铜(8090321157) 9 g,炙蜈蚣(8080981017) 2 g,制川乌(8010671037)9 g,制草乌(8010681037) 9 g 组成,由上海中医药大学附属岳阳中西医结合医院中药房提供,按照国中医药发〔2009〕3 号《医疗机构中药煎药室管理规范》要求煎煮中药,保证中药煎药质量。称取3 剂中药处方量加入10 倍冷水浸泡30 min,武火煮开后5 min,改文火煎45 min,冷却,纱布过滤;将药渣再次加入5 倍水量,重复第1 次煎煮方法;取2 次滤液混匀后置于旋转蒸发仪浓缩至148 ml,配成含生药1.2 g/ml 的中药液,4℃备用。注射用唑来膦酸钠(规格4 mg,H20041953)溶于0.9% NaCl 溶液中,配置浓度为0.01 g/L,现配现用。
3. 主要试剂及仪器
αvβ3 抗体(MAB1976,1:1000,美国Sigma-Al drich 公司);PyK2 抗体(sc-1514,1:600,美国Santa Cruz Biotechnology 公司);Scr 抗体(ab230914,1:100),Cbl 抗体(ab32446,1:200,美国Abcam 公司);TRIzol RNA 分离试剂(批号T9424,美国Sigma-Aldrich 公司);反转录试剂盒(R232-01,南京诺唯赞生物科技有限公司);RT-PCR 试剂盒(11203ES03,上海翊圣生物科技有限公司);Actin-Tracker Green-488 试剂盒(C2201S),DAPI 染色液(C1006),上海碧云天生物技术有限公司;增强型DAB 显色试剂盒(DA1016),Harris 苏木素染色液(G1150),北京索莱宝科技有限公司;D-荧光素钾盐(40902ES03,上海翊圣生物科技有限公司)。
CellXpert C170i 细胞培养箱,德国Eppendorf公司;TCS SP8 共聚焦显微镜,德国Leica 公司;QuantStudio 3 实时荧光定量 PCR 仪,美国Thermo Fisher 公司;vonFrey 纤维丝测痛仪,美国Stoelting公司;IVISLuminaL T Series III 小动物活体成像仪,美国PerkinElmer 公司;Pannoramic 250 全景切片扫描仪,CaseViewer 2.4 扫描浏览软件,匈牙利3DHIESTECH 公司。
4. 分组及造模
50 只小鼠采用随机数字表法随机分为假手术组(Sham组)、模型组(Model组)、骨痛灵组(GTL组)、唑来膦酸组(ZA 组)、骨痛灵+唑来膦酸组(GTL +ZA 组),每组10 只。除Sham 组给予接种PBS 溶液外,其余各组均予鼠源肺腺癌细胞2LL-LUC 悬液造模。参照肺癌骨转移模型建立方法造模[11]:鼠源肺腺癌细胞2LL-LUC 进行大量扩增培养,收集细胞悬液,37℃,1000 rpm 离心5 min(离心半径为12.8 cm),重悬,PBS 多次清洗,最后稀释至细胞密度为2×108个/ml;小鼠吸入异氟烷麻醉后,用1 ml 注射器针头经小鼠左后肢胫骨平台刺入胫骨骨髓腔,然后换用吸有肿瘤细胞的25 μl 微量进样器(注入前,微量进样器内依次吸入1 μl 明胶海绵水溶液,1 μl 空气和10 μl 肿瘤细胞悬液),注射完稍留针后缓慢拔出。Sham 组给予等量的PBS 溶液代替造模。1 周后小鼠腹腔注射D 荧光素钾盐溶液(150 mg/kg),15 min 后行小动物荧光活体成像,可观察到肺癌骨转移模型鼠内有荧光显像(见图1),即可判断为造模成功。

图1 小鼠荧光活体成像图(A) Sham 组;(B) Model 组Fig. 1 Fluorescence in vivo imaging of mice(A) The Sham operation group; (B) The Model group.
5. 给药方法
造模后第2 日各组开始给药干预,根据实验动物用药剂量换算[12],小鼠用药剂量为成人用药剂量的12.33 倍,即为临床等效剂量。GTL 组给予骨痛灵12 g/(kg·d)灌胃,每日1 次,共21 天;ZA 组给予唑来膦酸50 μg/(kg·d) 腹腔注射,每3 日1 次,共7 次;GTL + ZA 组给予骨痛灵灌胃和唑来膦酸腹腔注射,剂量和次数同上;Model 组和Sham 组给予同体积的生理盐水灌胃或腹腔注射。
6. 观察指标与方法
给药结束后第2 天,使用颈椎脱臼法将小鼠处死,立即分组迅速取出左后肢胫骨骨组织标本,每组随机选取6 只骨组织标本放入-80℃冰箱中保存备用;其余4 只骨组织标本,清洗后放入4%多聚甲醛溶液固定。
(1)vonFrey 纤维丝测痛仪评价小鼠足底机械痛阈值
将小鼠置于具有铁丝网格的特殊架上,取5 cm×8 cm×11 cm 的无底透明玻璃盒将小鼠罩住,在室温安静的环境下适应30 min 后,采用不同规格的vonFrey 细丝 (0.16 g, 0.4 g, 0.6 g, 1 g, 1.4 g, 2 g)按照从轻到重的顺序用相同力度垂直方向刺激小鼠左后肢脚掌中部皮肤,每根需刺激5 次,刺激停留时间为1~2 s,同一细丝2 次不同刺激间隔5 s,不同纤维丝刺激间隔5 min,观察小鼠缩足反应。小鼠机械痛阈值计分规则:若5 次刺激有3 次以上(含3 次)小鼠有缩足动作,该规格的vonFrey 细丝为疼痛阈值,若刺激至最大规格2 g 仍无缩足反应,则2 g 记为小鼠机械痛阈值。分别于造模前1 天,造模后第7 天、14 天、21 天进行检测。
(2)激光共聚焦观察破骨细胞伪足小体F-actin环形态
取石蜡固定的各组小鼠左后肢胫骨骨组织连续切片,常规二甲苯脱蜡,微波抗原修复后用10%山羊血清室温封闭孵育2 h;弃去血清,PBS 清洗3 次后加入Actin-Tracker Green-488 (5 μg/ml) 染色1 h;洗涤2 次后,加入DAPI (5 mg/ml)进行细胞核染色,室温避光孵育10 min;洗涤后用50%甘油封片,打开共聚焦显微镜,设置波长参数,观察荧光图像及时拍照并将图像存储后进行分析。
(3)实时荧光定量PCR 实验
运用NCBI 网站及在Primer Bank 软件获取目的基因引物,由上海生物工程有限公司合成。本研究中用于检测目的基因mRNA 的实时荧光定量PCR引物序列见表1 所示。采用Trizol 法提取各组小鼠左后肢胫骨骨组织总RNA,并及时反转录成稳定的cDNA;设置qPCR 反应条件:预变性—95℃ 5 min;变性—95℃ 10 s;退火延伸—60℃ 30 s;扩增—40个循环;将GAPDH 设置为对照内参基因,数据分析使用2-ΔΔCt法,统计分析目的基因相对表达水平。

表1 qPCR 引物序列Table 1 qPCR primer sequences
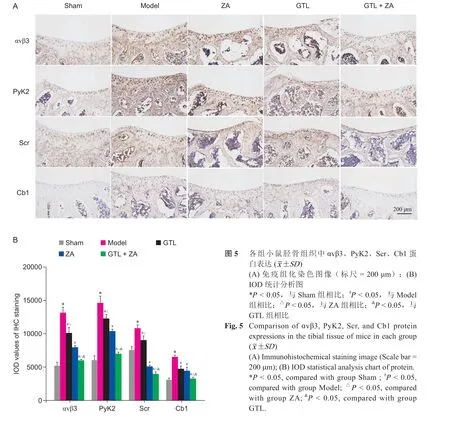
(4)免疫组化法检测骨组织中αvβ3、PyK2、Scr、Cbl 蛋白表达
将各组小鼠左后肢胫骨骨组织石蜡切片脱蜡至水后置于微波炉内进行抗原修复,待切片在室温下冷却后,PBS 清洗3 次(每次5 min)后,加入阻断内源性过氧化物酶溶液常温避光孵育25 min,PBS 清洗3 次(每次5 min);向切片加入3% BSA PBS 溶液,室温封闭30 min;弃封闭液后,加入适当比例的一抗,4℃摇床孵育过夜。次日,回收一抗后,加入相应二抗,室温摇床孵育50 min;弃二抗后加入DAB 显色液,显微镜下控制显色时间,自来水终止显色;用Harris 苏木素复染细胞核3 min 左右,自来水洗,氨水返蓝,脱水封片,倒置显微镜下观察,Pannoramic 250 全景切片扫描仪图像采集,并用V1.8.0.112 版Image J 软件半定量分析蛋白(棕色点)累计光密度 (integrated optical density, IOD)。
7. 统计学分析
采用Graphpad Prism 7 软件分析数据,符合正态分布的计量资料采用均数±标准差(±SD)表示,两组间比较采用两独立样本t检验;多组间比较采用双因素方差分析,组间两两比较采用Dunnettt检验。P< 0.05 为差异有统计学意义。
结 果
1. 各组小鼠机械痛阈值比较
四组造模小鼠于第10天左右出现自发痛行为,表现为左后肢跛行、舔足、自发抬足时间延长,出现轻微触诱发痛。各组小鼠左后肢足底的机械痛阈值比较发现(见图2),Sham 组小鼠机械痛阈值走势平稳,波动不明显;其余4 组从第7 日开始均呈现下降趋势,Model 组波动尤为明显。经统计分析,与Sham 组比较,Model 组小鼠造模后机械痛阈值下降(P< 0.05)。造模后第14、21 天:与Model 组比较,各给药干预组机械痛阈值升高(P< 0.05);ZA 组与GTL 组机械痛阈值相当(P> 0.05)。造模后第21 天:GTL + ZA 组机械痛阈值较GTL 组、ZA组明显升高(P< 0.05)。
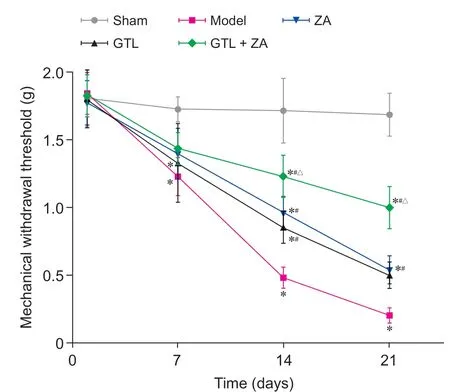
图2 各组小鼠机械痛阈值变化曲线图(±SD)*P < 0.05,与Sham 组相比;#P < 0.05,与Model组相比;△P < 0.05,与ZA 组相比Fig. 2 Changes in mechanical pain threshold of mice in each group (±SD)*P < 0.05, compared with group Sham; #P < 0.05,compared with group Model; △P < 0.05, compared with group ZA .
2. 各组小鼠胫骨组织中破骨细胞伪足小体F-actin 环比较
各组小鼠左后胫骨组织经罗丹明标记的绿色荧光鬼笔环肽染色F-actin 与蓝色荧光染料DAPI 染色液染细胞核共同孵育后,共聚焦荧光显微镜下观察发现(见图3),胞浆内可见大量绿色荧光肌动蛋白F-actin 与细胞纵轴平行排列,呈细丝状或网状表达。与Sham 组比较,Model 组中F-actin 环分布于细胞周边,微丝分布较有序,破骨细胞伪足F-actin 环完整,周围有大量应力纤维形成;与Model 组比较,各给药组可见胞内F-actin 环数量减少,环形态不完整,断裂、周围伴有少量应力纤维形成;与ZA 组比较,GTL 组F-actin 环破坏程度类似,GTL + ZA组F-actin 环破坏程度较明显。与GTL 组比较,GTL + ZA 组F-actin 环明显破坏。

图3 各组小鼠胫骨组织中破骨细胞伪足小体F-actin 环(标尺 = 100 μm)Nuclei 为破骨细胞细胞核;F-actin 为F-actin 骨架蛋白;Merge 为两者融合后图像;红色箭头所指为F-actin 环;黄色虚线为破骨细胞纵轴Fig. 3 F-actin ring of osteoclast pseudopodosomes in the tibial tissue of mice in each group (Scale bar = 100 μm)Nuclei refer to the nucleus of osteoclast; The F-actin is a F-actin skeletal protein; Merge refers to the merged image of the Nuclei and Factin rings; The red arrows refer to the F-actin ring; The yellow dash lines are the longitudinal axis of the osteoclast.
3.各组小鼠胫骨组织中αvβ3、PyK2、Scr、Cb1 mRNA 表达比较
各组小鼠左后胫骨组织RT-PCR 结果经统计发现(见图4),与Sham 组比较,Model 组αvβ3、

表达比较(±SD)*P<0.05,与Sham组相比;#P<0.05,与Model图4 各组小鼠胫骨组织中αvβ3、PyK2、Scr、Cb1 mRNA组相比;△P <0.05,与ZA组相比;&P<0.05,与GTL 组相比Fig. 4 Comparison of αvβ3, PyK2, Scr, and Cb1 mRNA expressions in the tibial tissue of mice in each group(±SD)*P < 0.05, comparedwithgroup Sham;#P< 0.05,compared withgroup Model;△P< 0.05, comparedwith group ZA;&P< 0.05,comparedwith groupGTL.
讨 论
PyK2、Scr、Cbl mRNA 表达上调(P< 0.05);与Model组比较,各给药组αvβ3、PyK2、Scr、Cbl mRNA 表达下调(P< 0.05);与ZA 组比较,GTL 组αvβ3、PyK2、 Scr mRNA 表达升高,GTL + ZA 组αvβ3、PyK2、Scr、Cbl mRNA 表达下降(P< 0.05);与GTL组比较, GTL + ZA 组αvβ3、 PyK2、Scr、Cbl mRNA表达下降明显(P< 0.05)。
4. 各组小鼠胫骨组织中αvβ3、PyK2、Scr、Cb1 蛋白表达比较
免疫组化分析各组小鼠左后胫骨组织中αvβ3信号通路相关蛋白,αvβ3、PyK2、Scr、Cb1 蛋白主要定位在破骨细胞膜上,胞质中呈阳性表达(见图5A)。进一步对蛋白染色面积进行半定量统计分析(见图5B),与Sham 组比较,Model 组αvβ3、PyK2、Scr、Cbl 蛋白染色强度明显升高(P< 0.05);与Model 组比较,各给药组αvβ3、PyK2、Scr、Cbl蛋白染色强度减弱(P< 0.05);与ZA 组比较,GTL组αvβ3、 PyK2、 Scr 蛋白染色强度增强,GTL + ZA组αvβ3、PyK2、Scr、Cbl 染色面积降低(P< 0.05);与GTL 组比较,GTL + ZA 组αvβ3、PyK2、Scr、染色面积明显降低(P< 0.05)。
中医药在治疗骨癌痛方面发挥着重要作用,具有安全性高、毒副作用小、无成瘾性等独特的优势。上海市名中医徐振晔教授根据临床多年抗肿瘤治疗经验,认为肺癌骨转移疼痛属于中医“骨痹”范畴,该病以肾虚为本,寒凝、瘀血、痰湿为标,脉络阻滞[13],则“不通则痛”和“不荣则痛”。以补肾养精,破瘀通络为治则,创立经验复方骨痛灵方。本研究结果显示,骨痛灵方、唑来膦酸及联合用药均能提高肺癌骨转移模型小鼠机械痛阈值,破坏伪足小体结构,且联合用药优于单药干预效果,骨痛灵方与唑来膦酸结果类似,提示各给药组均能破坏破骨细胞结构发挥镇痛作用,两药联合具有协同作用。与前期的临床研究结果一致[14],骨痛灵联合唑来膦酸治疗恶性肿瘤骨转移疼痛的镇痛效果显著。骨痛灵方主要成分有蜈蚣、骨碎补、川草乌、淫羊藿等组成。现代药理学研究证实,蜈蚣水提物可增加小鼠微血管的开放数目及增大其口径,具有显著的镇痛抗炎作用[15];川乌能抑制巴豆油所致的大鼠炎性肉芽肿增生,明显提高小鼠热板痛阈值[16]。因此,骨痛灵方抗骨癌痛作用可能与其方中的蜈蚣及川草乌有关。
骨吸收直接反映了骨溶解的状态,骨溶解所带来的炎性反应和神经损伤,是造成骨转移疼痛的关键。成熟的破骨细胞行使骨吸收功能时,必须形成一个特殊的肌动蛋白结构—伪足小体。伪足小体紧密附着于骨表面,并在附着区形成封闭腔,破骨细胞在该腔释放氢离子和各种酶类进行骨质溶解[17]。本研究结果发现,骨痛灵组、唑来膦酸组以及联合用药组可见胞内F-actin 环形态不完整,断裂,且联合用药组F-actin 环破坏程度较明显;骨痛灵组与唑来膦酸组F-actin 环形态相似。提示骨痛灵、唑来膦酸及联合用药均能抑制破骨细胞伪足小体结构形成,进而影响破骨细胞骨吸收功能,且联合用药效果更好。既往基础研究发现骨碎补总黄酮对成骨细胞分化和增殖均有促进作用,具有抑制破骨母细胞向多核破骨细胞转化的作用[18],本研究结果推测骨痛灵方抑制破骨细胞骨吸收功能可能与其方中的骨碎补相关。
破骨细胞伪足小体形成过程中αvβ3 整合素尤为重要,它可以介导由肌动蛋白构成的微丝结构通过聚合作用形成该结构。αvβ3 整合素在破骨细胞呈高表达,被认为是破骨细胞骨吸收过程中的核心分子,阻断αvβ3 可影响伪足小体的形成、破骨细胞的运动和骨吸收[19]。研究表明[20,21],整合素αvβ3的胞内信号可以通过诱导细胞内Ca2+的升高,而激活作为钙调节蛋白的Pyk2,Pyk2 的活化可以诱导c-Src 的募集和Cbl 的磷酸化,即在αvβ3 的作用下形成PyK2/Src/Cbl 分子复合物,启动骨架蛋白的改变,最终形成伪足小体。与上述研究结果一致,本研究肺癌骨转移小鼠造模成功后,胫骨组织中αvβ3、PyK2、Src 及Cbl mRNA 表达及蛋白染色强度升高,伪足小体形态完整且数量多。各给药组干预后,αvβ3、PyK2、Src 及Cbl mRNA 表达及蛋白染色强度均降低,且联合用药后降低明显,提示骨痛灵、唑来膦酸及联合用药均能抑制αvβ3/PyK2/Src/Cb1 通路。
综上所述,骨痛灵方及其联合唑来膦酸可提高骨转移癌痛机械痛阈值,破坏骨组织中F-actin 环结构,且两药联用具有增效作用,其机制可能通过调控骨组织中αvβ3/PyK2/Src/Cbl 通路抑制破骨细胞伪足小体形成起到骨保护作用,从而治疗肺癌骨转移疼痛(见图6)。

图6 骨痛灵方通过抑制αvβ3 通路介导破骨细胞伪足小体形成治疗肺癌骨转移疼痛的示意图肺癌骨转移疼痛的发生有3 个过程:①肺癌肿瘤细胞在骨骼肌着床后引起破骨细胞高表达整合素αvβ3;②整合素αvβ3 胞内信号诱导细胞内Ca2+的升高,激活钙调节蛋白PyK2,诱导c-Src 的募集和Cb1 的磷酸化,形成αvβ3/PyK2/Src/Cb1 分子复合物,启动骨架蛋白的改变,最终形成足突小体;③破骨细胞释放更多氢离子而产生痛觉过敏。骨痛灵方通过降低破骨细胞αvβ3 表达,抑制αvβ3/PyK2/Src/Cb1 通路,破坏伪足小体形成发挥镇痛作用。Fig. 6 Schematic diagram of Gutongling Decoction alleviates pain induced by bone metastasis of lung cancer through inhibiting αvβ3 signaling pathway-mediated formation of osteoclast pseudopodosomes There are three processes for the occurrence of pain in bone metastasis of lung cancer:①Lung cancer tumor cells cause osteoclasts to express high integrin αvβ3 after skeletal muscle implantation; ②The intracellular signal of integrin αvβ3 induces the increase of intracellular Ca2+, activates the calcium regulatory protein PyK2, induces the recruitment of c-Src and phosphorylation of Cb1, forms a molecular complex of αvβ3/PyK2/Src/Cb1, and initiates the changes of skeletal proteins, finally forming podocytes;③Osteoclasts release more hydrogen ions to produce hyperalgesia. Gutongling Decoction exerts analgesic effect by reducing the expression of αvβ3 in osteoclasts, inhibiting the αvβ3/PyK2/Src/Cb1 pathway,and destroying the formation of pseudopodosomes.
本研究尚存在一定局限性,未用αvβ3 抑制剂或建立稳敲αvβ3 肺癌骨转移动物模型,后续将进一步完善相关实验:明确骨痛灵方抗肺癌骨转移疼痛的具体机制,借助现代分子生物学手段成功建立αvβ3 靶标肺癌细胞模型,验证骨痛灵方对αvβ3 分子依赖功能,阐明αvβ3/PyK2/Src/Cbl 这条信号通路调控伪足小体形成影响骨吸收癌痛的具体作用机制。
利益冲突声明:作者声明本文无利益冲突。
