UiO-66复合材料用于典型有机污染物吸附和光催化氧化的研究进展
2023-03-01张金辉张焕朱新锋宋忠贤康海彦刘红盼邓炜侯广超李桂亭黄真真
张金辉,张焕,朱新锋,宋忠贤,康海彦,刘红盼,邓炜,侯广超,李桂亭,黄真真,4
(1 河南城建学院市政与环境工程学院,河南 平顶山 467036;2 重庆文理学院化学与环境工程学院,环境材料与修复技术重庆市重点实验室,重庆 402160;3 河南中材环保有限公司,河南 平顶山 467036;4 郑州大学生态与环境学院,河南 郑州 450001)
以染料、抗生素为主的典型废水有机污染物和以挥发性有机物(VOCs)为主的典型大气有机污染物导致的环境污染严重危害人体健康和生态环境,因此对其治理刻不容缓。目前针对不同环境条件和目的,研究者开发了多种污染物去除技术,包括吸附法、吸收法、生物降解法、膜分离法、催化氧化法等用于这些典型有机污染物的去除[1−3]。在众多技术中,吸附法和光催化法能够在温和的操作条件下将有害的污染物去除,被认为是经济、高效且绿色的处理技术,且具有实际应用价值,因而引起了研究者的广泛关注[1−2]。鉴于此,探究具有高效选择性的吸附和光催化材料对于环境有机污染物的治理至关重要。
金属有机骨架(metal−organic frameworks,MOFs)材料是由金属节点(常为过渡金属)和有机配体(羧酸类、咪唑类等)通过周期排列组成的有序网状多孔结构材料。由于组成MOFs的金属节点和有机配体种类繁多、结构多样,且均易功能化,因而通过改变合成条件可制备不同形貌结构和物化特性的MOFs材料,以适用于不同的研究领域,如气体储存[4]、气体分离[5]、传感[6]、药物缓释[6]及催化领域[7]等。同时,相较于常见的分子筛、活性炭等多孔材料,MOFs不仅具有较高的比表面积、大的孔容、可调的孔结构,而且具有半导体特性和易官能团化性能,因而可实现污染物的选择性吸附或净化[8−10]。但获得具有良好净化效果及结构稳定的MOFs材料仍是一项挑战。在众多MOFs材料中,UiO−66是目前已知配位数最高的MOFs 材料[11],且由软硬酸碱理论可知ZrIV和羧酸配体可形成结构稳定的MOF材料[12]。自UiO−66材料被挪威奥斯陆大学提出以来,不同特性的UiO−66 基材料被合成并广泛应用于染料[13]、抗生素[14]、内分泌干扰物[15]、重金属[16]、挥发 性 有 机 物(VOCs)[17]、H2[18]、CO2[19−20]等 的 吸 附和氧化还原领域等,且取得了系列研究成果。鉴于此,本文选用UiO−66基MOF材料探究其对典型环境污染物的吸附和催化的研究进展。
UiO−66[Zr6O4(OH)4(CO2)12]是由Zr6O4(OH)4(ZrCl4原位水解)阳离子节点和有机配体1,4−对苯二甲酸(BDC)周期排列形成的代表性微孔MOFs 材料[21]。UiO−66系列材料由四面体笼(约11Å,1Å=0.1nm)和八面体笼(约8Å)通过三角窗口(约6Å)周期排列组成,其比例为1∶2[22]。此外,由于ZrIV的本征亲氧性,由Zr6簇形成的次级结构单元在各种化学条件下均具有惰性和结构稳定性[11,23],同时该系列材料具有较大的比表面积、高孔隙率和类半导体特性,因而受到研究者的关注,并广泛应用于环境吸附和光催化领域[24−26]。此外,通过后合成或者一步合成[27−28],UiO−66−NO2、UiO−66−Br、UiO−66−Cl、UiO−66−COOH、UiO−66−NH2(图1)等带有各种基团的UiO−66 材料也被合成并用于环境领域污染物的吸附或者催化降解。鉴于此,本文从UiO−66基材料的孔径结构、比表面积、结构稳定性、疏水性和半导体特性等方面探究了其在环境领域的研究进展,不仅为结构稳定材料的设计提供理论指导,更为有机污染物的有效去除提供基础数据。
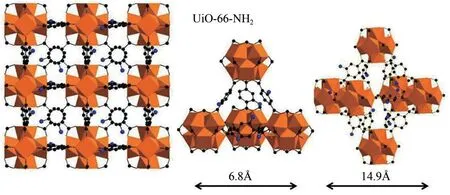
图1 UiO−66−NH2的结构图
1 UiO材料用于有机污染物的吸附
吸附技术因处理工艺简单、效率高及具有经济可行等优点而被广泛应用于环境中污染物的吸附去除。常用的吸附材料包括活性炭、生物炭、沸石及黏土等材料,相较于这些传统的多孔材料,MOFs材料因具有更加丰富且可调的孔径结构和超大的比表面积利于污染物的吸附富集。因此研发具有高吸附容量、吸附速率和脱附速率的MOFs材料对于污染物的去除起着至关重要的作用。
1.1 UiO材料用于液相有机污染物的吸附
由纺织、印染及皮革等过程染料或颜料的大量使用,导致排放到水体的污染物超过环境的自净能力,促使水体质量显著恶化。针对水体污染,吸附被认为是一种经济、高效的处理技术,其主要依靠与材料的静电作用、π−π 相互作用、氢键或物理吸附作用去除[29−32]。但水体中的有机污染物并不是单一存在,而是以多种形式共存,同时存在电荷相反的情况,因而同时去除电荷相反的染料具有极大挑战。Ahmadijokani 等[29]采用具有良好结构稳定的UiO−66 材料用于甲基红(MR)、甲基橙(MO)、亚甲基蓝(MB)和孔雀石绿(MG)等四种染料的选择性吸附去除(图2)。结果显示,在低pH 下UiO−66 对阴离子染料的吸附量高于阳离子的吸附量,其中MR、MO、MB和MG的最大吸附量分别为384mg/g、454mg/g、133mg/g 和370mg/g。同时在混合染料中,UiO−66 可选择性吸附阴离子。吸附机制结果表明UiO−66 对阴离子和阳离子染料的相互作用为静电相互作用、氢键、π−π相互作用、物理吸附和UiO−66的孔吸附。Embaby等[30]通过UiO−66对阴离子染料和阳离子染料的吸附差异探究其对阴离子和阳离子物种的选择吸附性能。研究指出,和大多数文献报道的一致,UiO−66 选择性吸附阴离子染料,这主要是UiO−66表面的zeta电位为正,利于阴离子染料的吸附,因而其对茜素红(ARS)的吸附量为400mg/g。Dinh等[31]采用UiO−66−NO2吸附去除MB 和MO,由于—NO2的存在,促使UiO−66−NO2具有较强的电负性,因而对MO(142.9mg/g)的吸附量远远高于MB(41.7mg/g),同时从吸附机制可知π−π 作用和氢键吸引共存,但氢键起主要作用。杨光绪等[32]采用UiO−66−Cl 吸附染色纸废水中的罗丹明B(RhB)和刚果红(CR),结果表明,相较于UiO−66、活性炭和蔗渣,UiO−66−Cl 具有较高的吸附量,且其吸附模型属于Freundlich 等温吸附模型,再生实验表明乙醇−HCl 溶液对RhB 和CR具有较好的脱附速率。
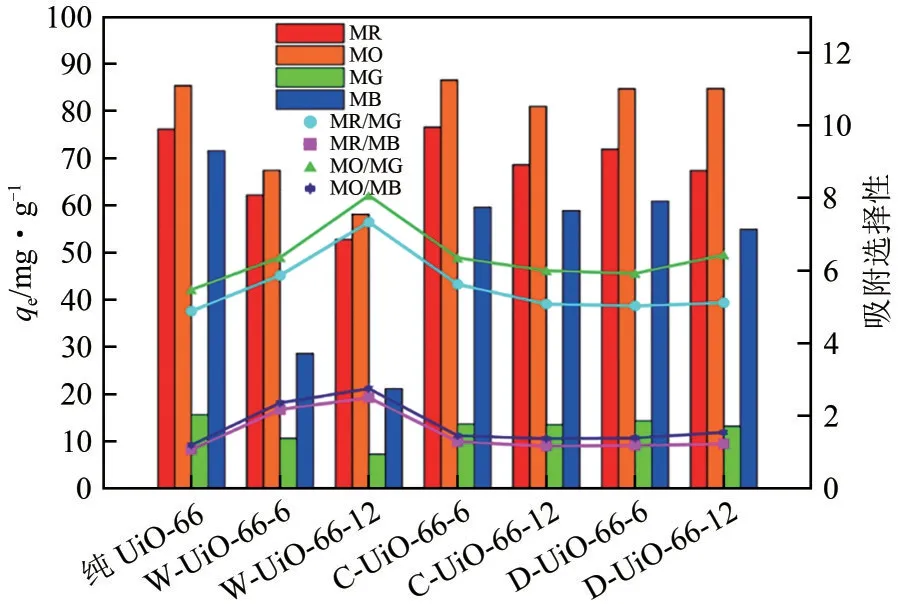
图2 纯UiO−66、W−UiO−66、C−UiO−66和D−UiO−66的理论吸附选择性结果对比
抗生素不仅广泛用于治疗或预防人类和动物疾病,而且在畜牧和水产养殖业务中促进动物生长。因而排入环境中的抗生素严重危害水体环境质量和水生生物。目前抗生素类的吸附去除主要依靠与材料组分的氢键作用、静电作用和π−π 相互作用去除。Fang 等[33]采用UiO−66−NH2用于抗生素诺氟沙星(NOR)的吸附,其最大吸附量为222.5mg/g。同时NaCl和CaCl2促进NOR的去除效率,但是腐殖酸对NOR的吸附量几乎没有影响。吸附结果表明,当NOR 的浓度为10mg/L 时,NOR 的去除效率为91.6%,表明UiO−66−NH2利于低浓度抗生素的去除。Zhuang等[34]采用UiO−66和UiO−66−NH2吸附去除双氯芬酸(DCF)。UiO−66−NH2相较于UiO−66具有较高的吸附容量,其最大吸附容量分别为357mg/g 和555mg/g。研究指出吸附为吸热吸附,因而在pH 为4.8~7.7 范围内时吸附量没有显著变化。此外,随着UiO−66−NH2活化温度的提高,其对DCF 的吸附量也显著提高。通过吸附机制可知,氢键和静电相互作用对DCF 的吸附起着重要作用。Liu 等[35]制备了四个功能组的Zr−MOFs(UiO−66−H、—NH2、—NO2、—Cl)用于低浓度阿莫西林(AMX)的吸附去除,其中UiO−66−NH2具有最高的吸附量(2.3mg/g±0.4mg/g)。Wang 等[36]将UiO−66−(COOH)2与GO 复 合 制 得UiO−66−(COOH)2/GO 复合材料用于盐酸四环素(TC)的吸附去除,相较于纯UiO−66(27.53mg/g),UiO−66−(COOH)2/GO 的吸附容量达164.91mg/g,这归因于GO 和—COOH 的引入增加了污染物的吸附位点。污染物吸附的可能机理是π−π 相互作用、化学配位和弱静电相互作用(图3)。由以上可知纯UiO−66 基材料对污染物具有良好的吸附性能,但实际水体净化时,纳米尺寸材料难于与水分离,无法实现重复回收利用,影响实际应用。因而制备高吸附容量且易于分离的吸附材料利于MOF 材料的实际应用。Li 等[37]将聚氨酯海绵和UiO−66−NH2原位复合用于2,4−二氯苯氧乙酸(2,4−D)的去除。相较于粉末状UiO−66−NH2,复合材料不仅能够保持2,4−D的吸附量,而且便于分离。吸附结果显示2,4−D 的吸附量达72.99mg/g,其吸附机制主要为π−π相互作用,同时具有氢键相互作用。

图3 四环素浓度对UiO−66、UiO−66/GO、UiO−66−(COOH)2和UiO−66−(COOH)2/GO吸附量的影响结果对比
1.2 UiO材料用于气相VOCs的吸附
介孔结构利于污染物的传质,微孔利于污染物的吸附富集,因而开发具有丰富微孔结构的材料对于VOCs 的吸附至关重要。同时,MOFs 暴露的金属节点与基团利于和污染物形成氢键作用力,提高污染物的吸附去除。Vo 等[38]于微波辐射下,在连续流管式反应器中快速合成了大量UiO−66 材料,并将其用于甲苯的吸附(图4)。研究者指出,甲苯的吸附量随着温度由25℃、50℃、75℃和100℃的逐步提高而降低,这可归为甲苯在UiO−66(Zr)上的吸附机制为物理吸附。此外,UiO−66(Zr)在25℃时对甲苯的吸附量为130mg/g,高于相同条件下的MOF−5 (32.9mg/g)、MIL−101(Fe) (98.3mg/g) 和Zeolite(30.7mg/g)的甲苯吸附量,且甲苯的最大脱附率接近95%。同时,该课题组[39]采用相同的方法制备了配体混合的UiO−66(Zr)材料,指出甲苯的吸附量随着—NH2含量的提高而增加,当配体中—NH2的含量由25%增加至100%时,甲苯的吸附量由139mg/g 增加至180mg/g,且各材料吸附的甲苯在室温下95%可进行回收。

图4 微波辐射条件下连续反应系统制备UiO−66示意图
Vellingiri 等[40]研究了6 种MOFs 材料[UiO−66、UiO−66(NH2)、ZIF−67、MOF−199、MOF−5和MIL−101(Fe)]对甲苯吸附的差异(图5)。结果表明6 种MOFs 对甲苯的饱和吸附量大小顺序为:UiO−66(NH2) (252mg/g) >ZIF−67 (224mg/g) >UiO−66 (166mg/g) >MOF−199 (159mg/g) >MIL−101 (98.3mg/g) >MOF−5 (32.9mg/g)。针对不同MOFs对甲苯吸附量的差异,该作者指出UiO−66 和MIL−101(Fe)由于具有较大的孔或笼结构,利于甲苯的吸附;MOF−199 未配位的金属节点Cu 和甲苯之间存在π 键作用力,也利于甲苯的富集;UiO−66−NH2和ZIF−67 这两种MOF 的—NH 键易与甲苯形成氢键,因而具有相对较高的甲苯吸附量。

图5 UiO−66、UiO−66(NH2)、ZIF−67、MOF−199、MIL−101、MOF−5和Zeolite吸附甲苯结果对比
Hasan 等[41]采 用UiO−66 和UiO−66−NH2两 种MOFs 用于气相和液相吡啶的吸附,研究指出,UiO−66对吡啶的吸附能力随着配体中—NH2比例的提高而增加,这归因为—NH2能够与吡啶中的N原子形成氢键,进而利于吡啶的吸附。
Zhou等[42]通过调节冰乙酸含量制备了系列不同形貌结构的UiO−66材料。研究指出,UiO−66的形貌结构随冰乙酸含量的增加而逐渐变得规则,同时比表面积、微孔孔容和晶粒尺寸呈逐渐增大的趋势。此外,研究者将合成的材料用于二氯甲烷的吸附,在25℃、44kPa 下的吸附趋势为UiO−66−5>UiO−66−2>UiO−66−1>UiO−66−0,其中形貌结构规则 的UiO−66−5 (510.3mg/g) 的 吸 附 量 相 较 于UiO−66−0(346.4mg/g)增加了47.3%,这主要归因于提高了UiO−66 的微孔比表面积和微孔孔容。Ou 等[17]通过调节冰乙酸的含量,制备了系列形貌结构可控且结构缺陷的UiO−66 用于苯和甲苯的吸附。当冰乙酸和对苯二甲酸的比为1 时(标记为:UiO−66−1.0HAc) 具有最高的苯吸 附量(367.13mg/g),其吸附量相较于没有缺陷位的UiO−66 提高了49%。进一步提高冰乙酸和对苯二甲酸的比例为2时,可发现UiO−66−2.0HAc可选择性吸附较高容量的甲苯,这归为甲苯相较于苯具有较大的直径和较高的极性,其甲苯吸附量(410.21mg/g)相较于没有缺陷位的UiO−66 提高了93%。
Zhang等[43]采用十六烷基三甲基溴化铵(CTAB)对UiO−66 进行改性。结果表明CTAB 能够促使UiO−66 产生配位缺陷,且产生的缺陷位能够成为甲苯的吸附位点。相较于纯UiO−66,经CTAB改性后的UiO−66 具有较高的甲苯吸附量,尤其是当CTAB 和Zr4+的摩尔比为0.5时,其具有最高的甲苯吸附量(275mg/g)。该作者也在不同吸附温度条件下进行了甲苯的吸附测试,结果表明,随着吸附温度的升高,甲苯的吸附量逐渐降低。此外,随着体系中相对湿度的增加,甲苯的吸附量也逐渐降低,这是因为有H2O存在时,H2O中的氢可与配体中的羧酸配位,进而抑制甲苯在吸附位点的吸附。同时该研究组[44]也采用P123(EO20PO70EO20)改性UiO−66用于甲苯的吸附。改性后的UiO−66具有微孔和介孔结构,其中介孔利于甲苯的传质,降低扩散阻力,而微孔利于甲苯的吸附。同时该作者也在不同湿度和不同温度下进行了甲苯吸附试验,结果表明,随着湿度和温度的增加,材料的甲苯吸附量均显著降低,尤其是纯UiO−66 材料。针对甲苯和水分子之间存在竞争吸附的问题,该研究组[45]采用聚乙烯吡咯烷酮(PVP)作为结构导向剂水热改性UiO−66 用于甲苯的吸附,结果表明缺陷的配体可充当甲苯吸附的位点,其中PVP/Zr4+为0.5 的缺陷UiO−66 材料具有最高的甲苯吸附量(259mg/g),其吸附量是纯UiO−66(151mg/g)的1.7 倍,尤其是在70%的高湿度条件下,缺陷位的UiO−66 仍具有84mg/g 的甲苯吸附量(图6)。Shi 等[46]采用CTAB 为模板剂合成了具有缺陷位的UiO−66−NH2用于甲苯的吸附−解吸。表征结果显示缺陷位UiO−66−NH2由于具有较高的比表面积、孔容和由于缺陷位引起的额外吸附位点而具有较高的甲苯吸附量,其中CTAB/Zr4+的摩尔比为0.5时具有最高的甲苯吸附量(228mg/g),且吸附前后材料的晶体结构几乎没有发生变化。重要的是,由于CTAB 的加入,阻碍了水分子和亲水基团的接触,进而水分子对甲苯的吸附影响较小。
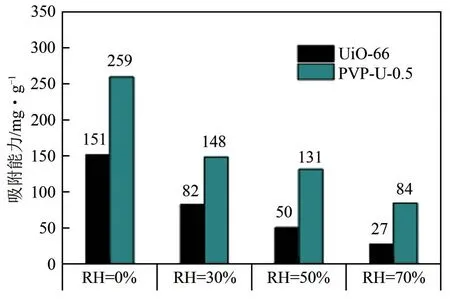
图6 不同湿度(RH)条件下UiO−66和PVP−U−0.5吸附甲苯结果对比
Zhang 等[47]采用MOF−5 为模板制备具有缺陷位的UiO−66用于甲苯的吸附。MOF−5/Zr4+摩尔比为1的M−U−0.01 具有最高的甲苯吸附量(257mg/g),为原始UiO−66的1.7倍,归其原因为甲苯和缺陷位UiO−66 之间具有较强的相互作用力。此外,尽管水分子和高温因素可导致UiO−66 结构坍塌,阻碍甲苯的吸附和降低材料和甲苯之间的π−π 相互作用,但改性后的UiO−66相较于原始UiO−66仍具有较好的甲苯吸附性质。
VOCs 作为有机污染物,当环境中存在水分子时,会在材料表面与VOCs 存在竞争吸附,进而降低VOCs的吸附容量。因而制备具有疏水性的MOFs材料利于VOCs的选择性吸附。Hu等[48]采用机械化学的策略将多巴胺和UiO−66 结合,制备了具有疏水性的UiO材料用于乙醛和氯苯的吸附(图7)。由于材料疏水性能的提高,N配位的UiO−66[标记为:M−UiO−66(Zr−N3.0)]相较于UiO−66和UiO−66−NH2显著提高了乙醛(9.42mmol/g)和氯苯(4.94mmol/g)的吸附量,同时其对水的吸附量相较于UiO−66和UiO−66−NH2分别降低20%和47%。此外,氯苯在M−UiO−66(Zr−N3.0)上的速率扩散常数分别是UiO−66和UiO−66−NH2的7.8倍和40倍。
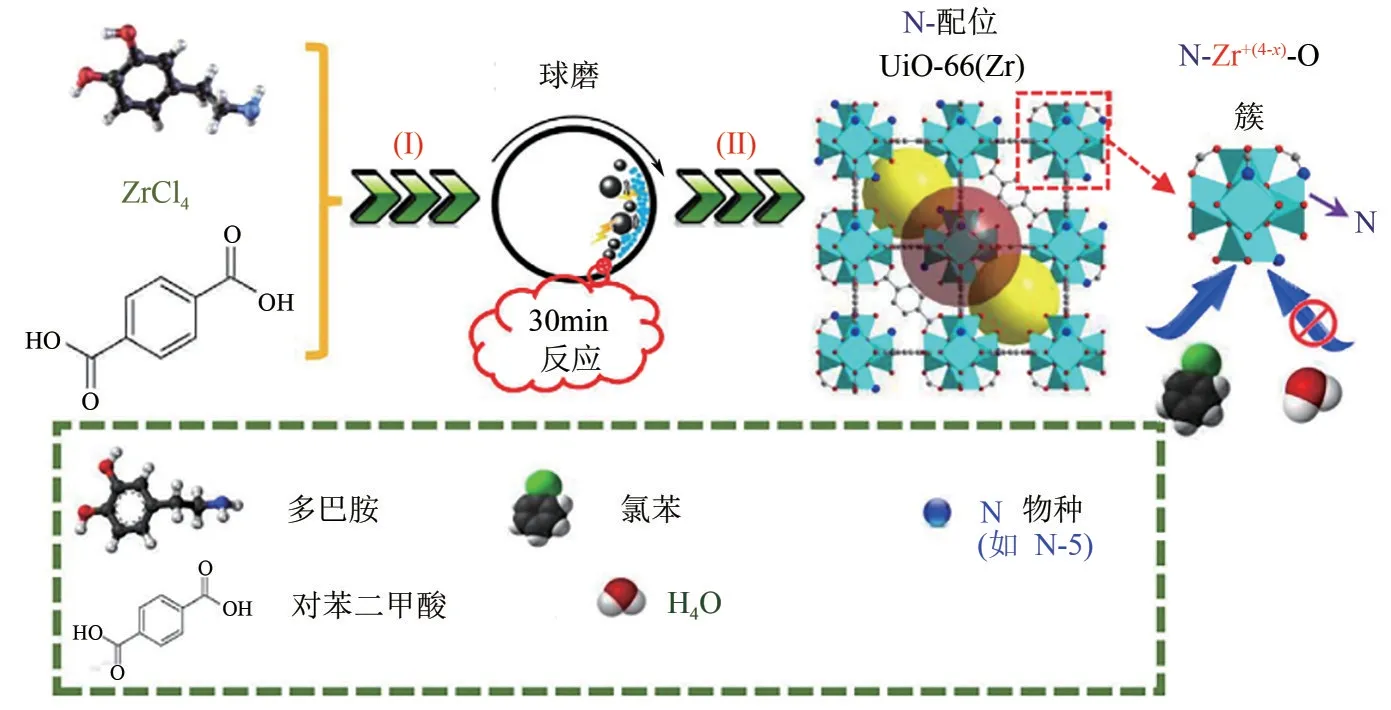
图7 机械化学法合成N−配位UiO−66(Zr)及其选择性吸附氯苯示意图
Sun 等[49]首次采用苯基硅烷对金属节点改性获得具有161o疏水角的UiO−66。疏水化的NH2−UiO−66(Zr)−shp 具有优异的耐碱性,在有机/水分离、自清洁和液态大理石等多种应用中具有广阔的前景(图8)。此外UiO−66−NH2−shp(48.4μL)的甲苯吸附量为UiO−66−NH2(3.9μL)的12倍。
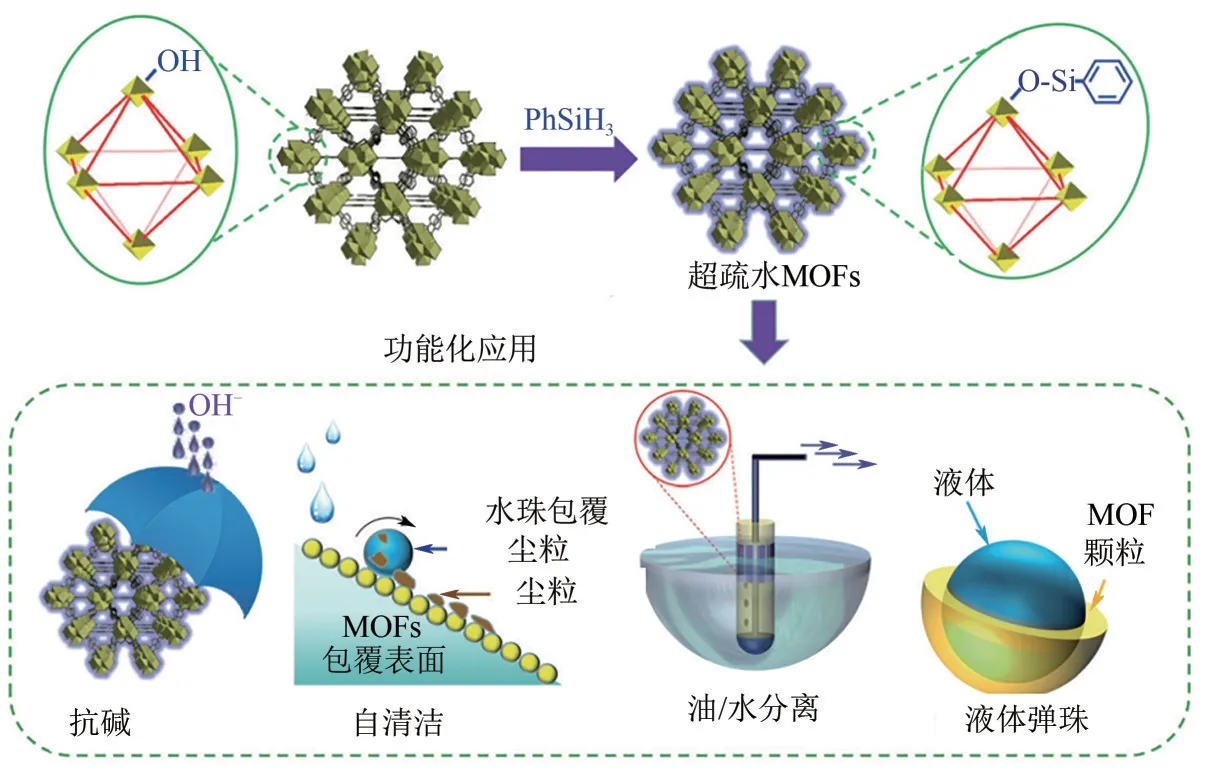
图8 超疏水NH2−UiO−66(Zr)−shp材料制备及其在抗碱、自清洁、油/水分离及液体弹珠方面的应用
基于以上研究可知,UiO−66基材料可在温和的条件下将有害的污染物高效吸附去除,同时可将性质差异显著的污染物选择性吸附,且具有良好的循环稳定性,但是现实环境中污染物的浓度并不像文献中这么高,同时环境中的污染物(液相有机污染物和气相VOCs)也不是静止不动,最重要的是用于吸附污染物的材料要便于从环境中分离,在实现污染物吸附去除的同时不增加新的污染源,因此探究并获得易分离回收的UiO−66基吸附材料,并实现对浓度低且动态体系下污染物的高效吸附去除至关重要。
2 UiO材料用于有机污染物的光催化降解
光催化的本质是入射光的能量大于禁带宽度时,催化材料产生的电子-空穴(e-−h+)对用于污染物的氧化还原反应。研究显示,光生电子不仅能够还原污染物,而且可与催化材料表面吸附的氧气反应生成强氧化性的超氧自由基(·O2-);此外,价带上的h+可与材料表面的H2O/OH-反应生成羟基自由基(·OH)。h+、·O2-和·OH均具有强氧化性,可将污染物无选择性的氧化为无害的CO2和H2O。鉴于此,开发一种高效、无毒、化学性质稳定且容易制备的催化材料对于污染物的光催化去除至关重要。
2.1 UiO材料用于液相污染物的降解
有机染料在自然环境中不易分解,且大多数对环境和人体均具有危害性,甚至诱发畸变,因此染料必须从水体中去除。相较于吸附技术,光催化技术可实现污染物在h+、·OH 和·O2-的作用下彻底催化降解,达到无害化处理的目的。Jin 等[50]采 用UiO−66−NH2、UiO−66−NO2和UiO−66−NH2/UiO−66−NO2光催化降解RhB,结果表明混合配的UiO−66−NH2/UiO−66−NO2具有最优的光催化活性(95.5%)和循环稳定性,自由基实验表明·O2-是主要活性物种。Mu 等[51]制备了一系列同结构[H、NH2、Br、(OH)2、(SH)2]的UiO−66 用于光催化降解RhB,结果表明良好的可见光吸收并不代表其具有较高的光催化活性,但较快的e-−h+分离速率和活性物种生成速率,利于污染物的快速降解。尽管纯UiO−66 基材料具有良好的污染物去除率,但仍存在载流子易复合及光响应范围有限等问题。鉴于此,研究者普遍采用半导体材料与纯UiO−66 基材料耦合,复合后的材料不仅具有纯MOF 大比表面积、多孔的特性,而且具有半导体材料优异光催化的特性。Bibi 等[52]采用共沉淀法制备了系列BiOBr/UiO−66−NH2复合材料用于可见光下去除染料RhB,由于电荷在异质结界面有效的转移和分离及BiOBr/UiO−66−NH2的协同效应促使复合材料具有较高的光催化活性,尤其是具有15%UiO−66−NH2的复合材料(质量分数),经过2h光照后,可去除83%的RhB。此外由捕获剂实验可知,h+和·O2-是降解RhB 的主要活性物种。Liang 等[53]采用原位溶剂热法制备了核壳结构的CdS@UiO−66−NH2用于MG 和MO 的降解(图9)。表征结果显示,介孔UiO−66−NH2壳不仅利于核(CdS)的光吸收,而且提供丰富的活性位点和组分间紧密的界面接触。活性结果表明较高的比表面积、分子水平组分间的界面接触及n−n 一维异质结显著提高了材料的光催化活性,其经25min和45min可分别将99.5%的MG和95.7%的MO 去除。Abdi 等[54]以UiO−66 为载体制备了TiO2/ZrO2复合材料用于RhB的降解,由于复合材料增加可见光的吸收及促进载流子的快速分离,因而复合材料具有良好的光催化活性,经4 个循环后,复合材料仍具有较高的稳定性和90%的RhB 去除率。

图9 CdS@UiO−66−NH2光催化降解有机污染物(MG、MO)示意图
由于工业、农业、市政等污水的排放,导致水体不同程度地受到Cd、Cr、Ni 和Pb 等重金属的污染[55−56]。因此,可知水体中的污染物并不是单一存在,而是多种形式的污染共存。光催化技术可利用材料本身产生的电子−空穴对分别用于重金属的还原和有机污染物的氧化,因而被认为是一种绿色可行的处理技术。Zeng 等[57]采用Ag2CO3@UiO−66−NH2/GO 膜于流动条件下用于液相有机污染的去除和重金属Cr 的还原。研究指出,该复合材料在50L/(m2·h)的条件下可将MB、RB 和MR 全部去除。此外,经过200min 长时间的实验,AgCO@UiO/GO膜在光照条件下对所有染料和Cr(Ⅵ)均保持了较高的去除率。Zhou 等[58]采用离子交换法制备系列UiO−66−NH2/Ag2CO3复合材料用于重金属Cr的还原和有机污染物的氧化(RhB、MO、CR 和MB)。作者指出UiO−66−NH2和Ag2CO3质量比为1∶1时复合材料(标记为UAC−100)具有最优的光催化活性,50min 可将Cr 全部还原,60min 后可降解96%的MB 和81%的CR,同时经过90min 可将90%的MO和85%的RhB降解。此外,经4个循环后,仍具有99%的Cr去除率。
环境污染和能源消耗是社会面临的两大难题,在实现污染物去除的同时实现能源的产生受到人们的关注。基于光生e−−h+的氧化还原特性,研究者实现了污染降解和产氢的同步实现。Zhao等[59]采用水热法制备了系列NH2−UiO−66/ZnIn2S4复合材料用于MG的降解和产氢,表征结果表明复合材料形成的Ⅱ异质结拓宽了光谱的响应范围,促进载流子的分离,进而提高光生电荷的寿命,活性结果表明具有10%NH2−UiO−66 的复合材料10%NU66/ZIS 具有98%的MG去除率和2199μmol/(h·g)的氢气产率。
生物体内未代谢的抗生素一般通过粪便、尿液等代谢形式进入环境,因而在水体环境中检测频率和浓度均较高。Yang 等[60]采用UiO−66−NH2为载体调整BiOBr 的形貌用于NOR 降解。复合材料的3D结构和紧密的界面接触利于光能的充分利用、增加活性位点的暴露和抑制载流子的复合。活性结果指出具有20%UiO−66−NH2的BiOBr/UiO−66−NH2复合材料具有最优的光催化活性,经180min 光照后,能够去除93.60%的NOR,通过活性物种捕获实验可知·O2-是主要的活性物种。Cao 等[61]采用一步溶剂热法制备了Co 掺杂的UiO−66,并用于TC 的吸附和光催化降解(图10)。其中Zr∶Co 比为1 的CoUiO−1 复合材料具有最高的TC 吸附量,其吸附量为224.1mg/g,较高的TC吸附量可归为复合材料和TC之间存在π−π相互作用和静电相互作用。吸附后的材料可将最初浓度94%的TC 光催化去除。此外,CoUiO−1 对TC 的吸附能力和光催化降解能力分别是纯UiO−66的7.6倍和6.9倍。Wu等[62]采用一步溶剂热法制备TiO2@UiO−66−NH2复合材料用于TC的去除。复合材料对TC具有较高的光催化活性归为复合材料对TC 具有较高的吸附量和光生载流子的快速分离。此外,经4次循环后,复合材料的光催化活性没有明显降低,表明其具有较好的稳定性和循环再利用性。Zhao 等[63]采用球磨法制得Bi5O7I/UiO−66−NH2用于环丙沙星(CIP)的去除。基于活性物种捕获试验、肖特基测试、电子自旋共振(ESR)和密度泛函理论(DFT)结果可知,Bi5O7I/UiO−66−NH2异质结遵循直接Z型异质结电子转移路径。此外,表征结果表明UiO−66−NH2的引入显著提高了材料的比表面积,进而提高了污染物的吸附能力和降解污染物的活性位点。活性结果表明具有50%UiO−66−NH2的复合材料具有优异的光催化活性,经过120min光照后可去除96.1%的CIP。
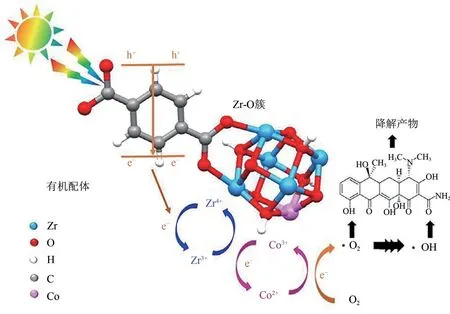
图10 Co掺杂的UiO−66光催化降解TC机理图
2.2 UiO材料用于VOCs的催化氧化
尽管MOFs材料具有较大的比表面积、高孔隙率和半导体特性,但由于载流子的快速结合导致材料具有较差的光催化活性。鉴于此,众多研究者将TiO2和MOFs 复合,期望复合材料既能够保持TiO2优异的光催化活性,又能够继承MOFs半导体和大比表面积的优势,进而在克服TiO2对VOCs 吸附能力低及易积炭失活问题的同时克服MOFs材料活性差的问题。Yao 等[64]合成了系列TiO2@UiO−66−NH2材料于可见光动态体系条件下光催化降解苯乙烯(图11)。基于软硬酸碱理论可知,超细TiO2纳米颗粒封装在UiO−66−NH2的内部,由于良好的界面接触,复合材料具有良好的光响应性和载流子分离速率。此外,UiO−66的3D结构利于污染物的传质扩散,在活性位点附近形成富VOCs 环境,进而较于纯的UiO−66−NH2和TiO2,TiO2@UiO−66−NH2复合材料具有优异的苯乙烯去除率和抗积炭失活性能,且具有5%TiO2的TiO2@UiO−66−NH2经600min光照后能够去除99%的苯乙烯。周易等[65]采用溶剂热法结合回流法将非晶态TiO2包覆UiO−66−NH2表面制备了系列UiO−66−NH2@TiO2核壳催化剂用于甲苯的催化氧化。结果表明,由于UiO−66−NH2较大的比表面积对污染物有效的吸附及复合材料组分间匹配的带隙结构利于载流子的利用率,进而复合材料具有较高的甲苯去除率,经3h 光照后,甲苯的去除率为76.7%,为纯UiO−66−NH2的1.48 倍。此外,复合材料经3次循环后,仍具有70%的甲苯去除率。
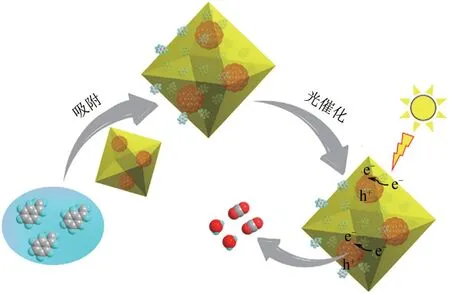
图11 TiO2@NH2−UiO−66光催化降苯乙烯机理图
Zhang 等[66]采用溶剂蒸发法制备了系列TiO2−UiO−66−NH2复合材料用于甲苯和乙醛的光催化氧化(图12)。由于UiO−66−NH2相较于传统的多孔材料(活性炭、TS−1和SBA−15)具有较高的比表面积、丰富的孔径分布及其本征半导体特性,因而在动态体系下具有良好的甲苯和乙醛去除率,经720min连续降解后,乙醛的去除率和CO2生成量分别是纯UiO−66−NH2的10.5 倍和14.3 倍。同时进一步采用一步溶剂热法制备了TiO2@UiO−66系列复合材料用于甲苯和甲醛的去除[67]。通过系列表征可知,组分间紧密的界面接触及匹配的带隙结构利于载流子的快速分离。此外,UiO−66 优先选择性吸附甲苯,解吸甲苯的降解产物CO2,进而促使甲苯深度催化氧化,避免材料积炭失活。最重要的是,借助原位红外探究了甲苯的降解路径,指出甲苯经苯甲醛、苯甲酸开环降解为小分子草酸,最终降解为无害的CO2和H2O。
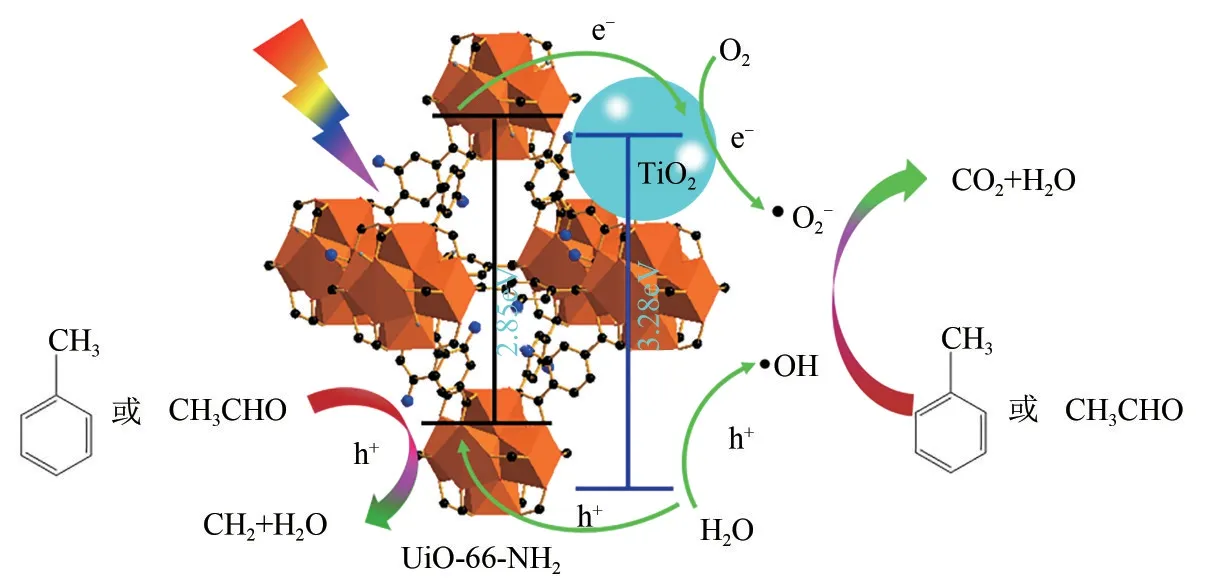
图12 TiO2−UiO−66−H2降解甲苯和乙醛机理图
由以上可知,复合材料既具有MOF 的大比表面积、多孔、半导体特性,又具有活性中心(半导体材料)优异的污染物去除效率。复合材料的大比表面积利于活性位点的分散,近而利于光激发活性位点和污染物与活性位点的接触,实现污染物的高效降解。同时复合材料继承了UiO−66 基材料的多孔特性,促使污染物快速传质的同时实现载流子快速分离并转移至活性位点,用于污染物的降解。此外,复合材料组分间紧密的接触及协同作用促使载流子转移并生成大量的活性氧物种,进而将污染彻底矿化氧化。
3 结语与展望
不论是有机染料类污染物、抗生素类污染物还是VOCs,均属于种类繁多、结构稳定且复杂、具有毒性的环境污染物。利用结构稳定、大比表面积、高孔隙率和半导体特性的UiO−66 基材料用于这类污染物的吸附或催化去除表现了可观的潜在应用性。近年来,国内外研究学者采用UiO−66 基材料用于污染物的去除进行了系统研究,并得到结论如下:通过调节材料的孔隙结构促进污染物的吸附与富集;疏水化降低了有机污染物和水分子之间的竞争吸附;大比表面积不仅利于活性位点的分散,而且利于污染物的吸附,达到污染物有效吸附且被活性位点彻底催化氧化的目的;带隙匹配的复合材料利于载流子的快速分离和转移,利于污染物的彻底催化降解。针对以上问题,尽管取得了一定的成果,但是还存在一些科学问题需要解决:一是实际废水的pH 变化极大,过高或过低的pH 破坏UiO−66基材料的结构稳定性,但目前研究者鲜有关注;二是UiO−66 基材料的e-−h+易复合,进而其光催化活性较差;三是污染物种类繁多,结构和性质差异显著,但目前主要关注单一污染物的去除,鲜少关注多组分同步高效去除。鉴于此,UiO−66 基材料在吸附和降解有机污染物的未来研究发展方向如下:①制备结构稳定的MOFs材料,利于材料的广泛应用;②制备复合材料,突破MOFs材料选择性吸附单一污染的特性,尤其是制备便于固液分离的块状材料;③将活性位点和吸附位点定向构筑,获得具有吸附催化一体化的复合材料,实现污染物的协同矿化;④建立构筑单原子活性位点限域UiO−66基材料的理念,在提高材料载流子分离的同时,增加材料的催化活性。
