植物外向整流K+通道SKOR研究进展
2023-02-28任盼盼伍国强魏明
任盼盼,伍国强,魏明
(兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
K+是植物细胞中含量最丰富的阳离子之一,约占植物干重的10%[1]。K+不仅在植物细胞伸长、酶激活、渗透调节、光合作用和韧皮部糖装载等方面起重要作用,而且还可增强植物对生物及非生物胁迫的耐受性[1-3]。一般情况下,在植物细胞中,维持正常代谢活动的K+浓度为100~200 mmol·L-1,植物通过根系从土壤中吸收K+,然后分配到不同组织部位,以满足正常生长发育需要[4]。此过程主要由定位在质膜上的K+转运蛋白或K+通道完成。目前研究较多的K+通道主要有Shaker型K+整流通道、双孔K+通道(tandem-pore K+channel,TPK)和双孔通道(two-pore channel,TPC)家族[5-6];K+转运蛋白包括高亲和性钾转运体(high-affinity K+transporter,HKT)、K+吸 收 渗 透/高 亲 和 性K+转 运 蛋 白/K+转 运 蛋 白(K+uptake permease/high-affinity K+transporter/K+transporter,KUP/HAK/KT)和阳离子质子逆向转运蛋白(cation-proton antiporter,CPA)家族[7-8]。
Shaker型K+整流通道是参与植物K+转运和分配的重要通道[9]。该通道家族属于高度保守的K+选择性电压门控通道,根据受激活的电压范围及整流特性可将其分为4个功能亚群:内向整流(K+inward rectifier,Kin)、沉默整流(K+silent rectifier,Ksilent)、弱整流(K+weak rectifier,Kweak)和外向整流(K+outward rectifier,Kout)通道[10]。在拟 南 芥(Arabidopsis thaliana)中,Kin通道 包 括AtAKT1(K+transporter 1 inA.thaliana)[11]、AtAKT5、AtSPIK(shaker pollen inward K+channel)[12]、AtKAT1(K+channel inA.thaliana1)[13-14]和AtAKT2/3[15],它们介导K+跨细胞膜吸收,其主要特点是在负电压(-80~-100 mV)下打开门控。Kweak通道AtAKT2可介导K+吸收和外排[16],也可与Kin通道亚基组装成具有双向整流特性的异构体通道[17]。Ksilent通道成员AtKAT3(又称AtKC1)本身并不会形成功能性的同质型四聚体通道,但其与Kin亚基具有很强的异聚化亲和性[18],可作为负向电压调控元件与AKT1组装,AtKC1-AKT1异构体激活所需要的电压比AtAKT1更低[19-20]。相比之下,以AtSKOR(stelar K+outward rectifier)[21]和AtGORK(guard cell K+outward rectifier)[22]为代表的Kout通道被膜去极化打开,可使K+由胞内排至胞外。与Kin通道不同的是,Kout通道不仅对电压敏感,而且对胞内和木质部汁液K+浓度敏感性也很强[23-24]。大量研究表明,SKOR在维持植物根部和地上部K+稳态平衡中扮演重要角色,已成为目前植物逆境生理学研究的热点之一,备受学术界的关注。本研究对SKOR的发现、结构、分类、表达调控及其逆境响应等方面的研究成果加以综述,并对其未来研究方向进行展望,为其在农作物遗传改良中的应用提供一定依据。
1 SKOR发现、结构与分类
1.1 SKOR发现
Wegner等[25]采用膜片钳技术在大麦(Hordeum vulgare)根的离体组织中首次证实外向整流K+通道活性,称之为KORC(K+-selective outward rectifying conductance)。Roberts等[26]在玉米(Zea mays)根中柱鞘细胞及皮层中也发现了介导K+从中柱细胞外排到木质部汁液中的外向整流K+通道。Gaymard等[21]在拟南芥中克隆到第一个高等植物的外向整流K+通道基因AtSKOR,发现其在根中柱组织中特异性表达。随后,相继在小花碱茅(Puccinellia tenuiflora)[27]、水稻(Oryza sativa)[28]、霸王(Zygophyllum xanthoxylum)[29]、枸杞(Lycium barbarum)[30]、甜瓜(Cucumis melo)[31]等物种中鉴定到SKOR基因(表1)。研究发现,大多数物种SKOR基因家族仅有1个成员,不同物种SKOR基因编码氨基酸数目变化较大,为632~1032 aa(表1)。
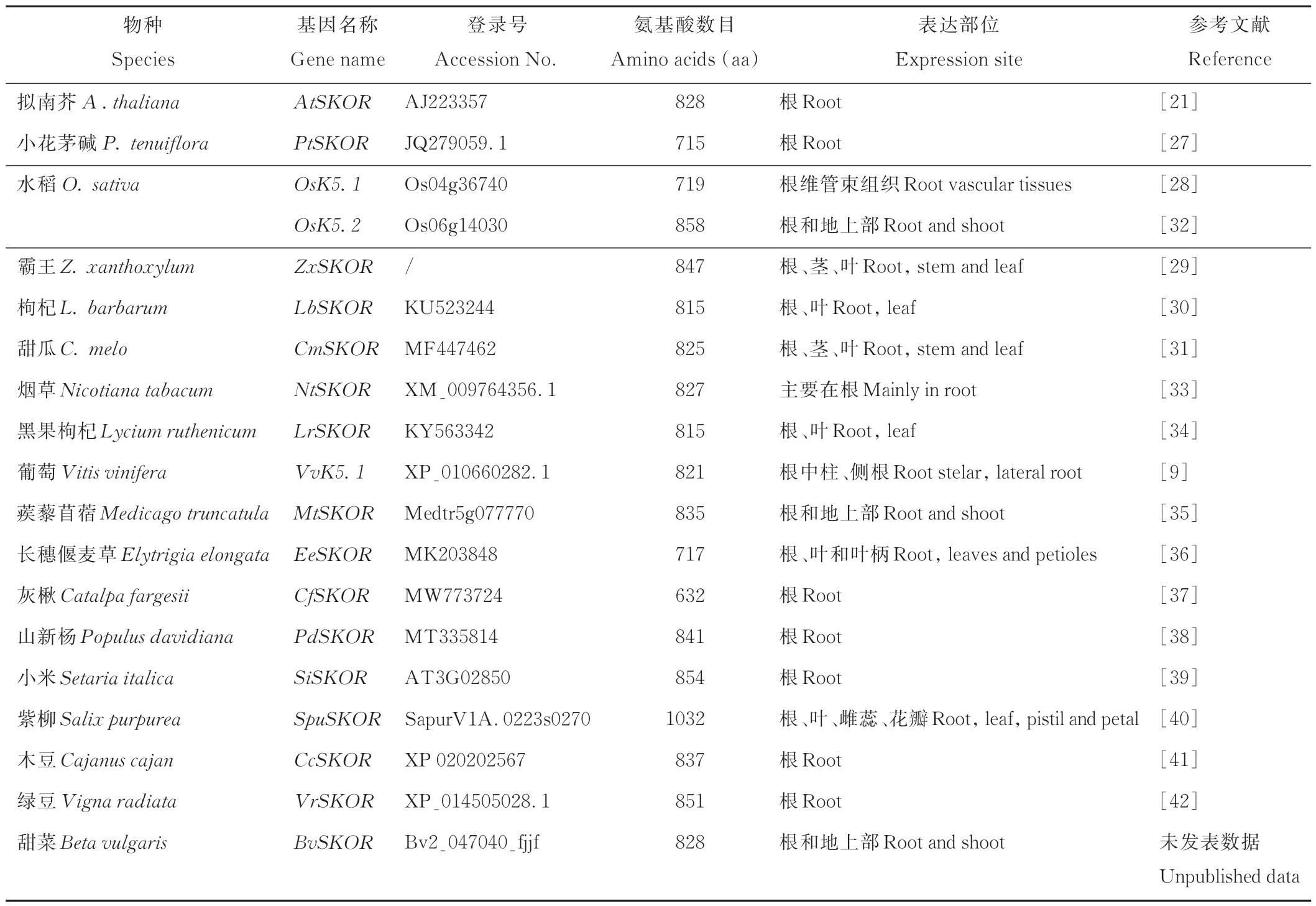
表1 不同植物SKOR基因Table 1 The SKOR genes in different plants
1.2 SKOR结构
SKOR为代表的Kout通道与Kin通道(如KAT1)具有很高的氨基酸序列相似性和基本相同的结构特征[43-44]。SKOR与KAT1结构最大的区别在于P环和S6,从而导致其门控特性不同[23,45]。Kout通道(SKOR和GORK)的S6具有高度保守的氨基酸基序(Asp-Met-Ile/Val-Leu-Gly),而Kin通道和Kweak通道(KAT1、KAT2、AKT1、AKT2和SPIK)的保守基序则为Asn-Leu-Gly-Leu-Thr[23]。
SKOR是由4个α-亚基组装而成的多聚体蛋白,它们结合在一起形成通道的渗透途径[46]。每个亚基由6个跨膜α-螺旋组成,命名为S1~S6,短的N-端和较长的C-端都位于膜内侧[47](图1)。前4个α-螺旋位于中心离子传导孔的外围构成电压传感器结构域(voltage sensor domain,VSD),其中S4富含带正电荷的氨基酸残基Arg或Lys,这些氨基酸位于膜的电场中,响应去极化将螺旋向外移动[48],形成VSD的激活状态,待细胞膜的电位恢复后复位而使通道关闭[49]。跨膜孔本身由S5和S6螺旋排列,并倾斜形成倒置的“圆锥”形,使得靠近内膜表面的通道变窄[48]。S5和S6之间部分“折入”成孔(pore loop),包含高度保守的序列TxGYGD(Thr-x-Gly-Tyr-Gly-Asp),构成渗透途径最窄的部分,S5-P-S6共同构成孔域(pore domain,PD),控制离子通过并决定通道的离子选择特性[50]。S4~S5间一段短的氨基酸序列作为选择性过滤器(selectivity filter,SF)连接并耦合VSD和PD[51-52],S4通过电压传感器选择性过滤器门(VS-SF)耦合控制跨膜通道的打开或关闭[53]。

图1 SKOR跨膜结构及组装方式模型图Fig.1 Transmembrane structure and assembly method of SKOR[48,54,57]
SKOR的C末端包含调控位点和对通道组装重要的区域,被认为对蛋白质的稳定性、四聚体组装和调节蛋白结合有重要的作用[24]。C-端含有一个保守的环核苷酸结合域(cyclic nucleotide binding domain,cNBD)、锚蛋白anky结构域以及富含疏水酸性残基的远端KHA结构域[54-57]。其中,anky结构域是蛋白质-蛋白质互作的位点,也是蛋白激酶如CIPKs(CBL-interacting protein kinases)的结合部位[55]。
1.3 SKOR分类
Kout通道的起源可以追溯到藻类[50,58-59]。在一些晚期分叉的链柄藻类(如Spiroloea muscicola)中Kout通道与Kin/Kweak/Ksilent通道已有区分,此时已经具备与AtSKOR相似的特征,如外向整流和细胞外K+浓度的感应等[44,59],此后SKOR在进化中高度保守。前人对SKOR家族的系统发育进行分析,发现单子叶植物与双子叶植物SKOR进化关系较远,而同一科或相近科物种SKOR氨基酸序列有较高的相似性,进化关系较近[29,37,40]。为深入探究不同物种间SKOR进化关系,本研究采用MEGA X软件对70个物种SKOR基因编码的氨基酸序列进行多重比对,并通过邻接(neighbor-joining,NJ)法构建系统发育树(图2)。根据氨基酸序列相似性将SKOR分为3个簇,Ⅰ簇有13个成员,Ⅱ簇有26个成员,Ⅲ簇有31个成员。单子叶植物如乌拉尔图小麦(Triticum urartu)、大麦、玉米、水稻等都归类于第Ⅲ簇,而双子叶植物在Ⅰ、Ⅱ、Ⅲ簇中均有分布。甜菜BvSKOR属于第Ⅱ簇,与空心莲子草(Alternanthera philoxeroides)ApSKOR相似度高达85.65%,进化关系最近。
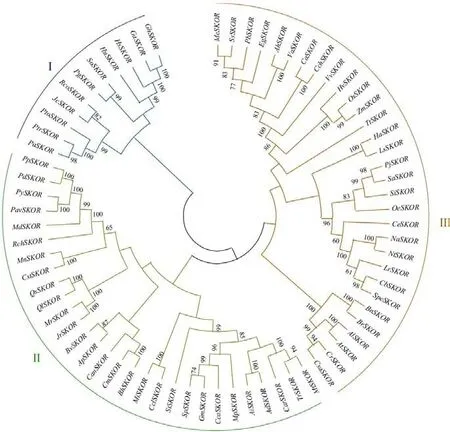
图2 不同物种SKOR系统发育分析Fig.2 Phylogenetic analysis of SKOR in different species
2 SKOR生物学功能
2.1 SKOR介导胞质K+外流
K+作为植物细胞中的主要阳离子,维持一定K+水平是植物细胞进行正常生理生化过程的先决条件[60]。细胞膜上的各种转运蛋白和通道蛋白控制着植物细胞K+流入和流出,从而调节胞内K+稳态平衡[61]。SKOR定位于细胞膜,是一种高K+选择性的外向整流型K+通道,在离子跨膜运输和胞内外离子平衡调节中起着重要作用。K+进入孔道后被剥离水化壳,与通道GYGD基序的羰基氧原子配位(图1)。P环一次只能结合一个K+,下一个离子进入后会将前一个K+挤出配位,使该K+被排出细胞[49]。由于PD中心孔的大小与K+的水合空间非常匹配,较大的离子(如Ca2+)无法渗透到孔中,而较小的离子(如Na+)即使进入,也会因羰基氧化合物彼此间隔太远而无法完成脱水[49],综上构成SKOR对K+的选择性。SKOR门控依赖于外界K+浓度(external K+concentration,[K+]ext)[23],高[K+]ext的情况下,胞外K+与PD相互作用,使通道中的K+更难被释放[62],因此必须进一步将膜电压驱动到更正,只有当K+净流量的驱动力指向胞外时通道才会打开。SKOR通道一旦开放,无论外部K+浓度如何都只可以外流K+,其流量与膜内外电压差和细胞内K+浓度呈正相关[21,24],即胞内K+浓度越高,膜两侧K+浓度差越大,流量越大。K+外流在一些情况下是必要的,如在细胞周期中,K+外流和细胞膨胀度降低是G2期进入M期的先决条件,所以分裂间期可以观察到SKOR基因表达的增加和通道活性的增强[63]。另外,在盐胁迫下,K+的进出和重新分配在很大程度上可以平衡Na+引起的细胞内外离子失衡[64],维持细胞稳态,减轻盐胁迫造成的伤害。
2.2 SKOR介导木质部K+装载
SKOR是K+从植物根部向地上部长距离运输的一个关键通道,Gaymard等[21]研究发现,atskor突变体植株木质部汁液中K+浓度以及地上部K+含量比野生型降低了约50%,由此推断AtSKOR参与K+由根向地上部的运输,且在此过程中发挥重要作用。SKOR在中柱鞘细胞和木质部薄壁组织细胞中优先表达,促进K+装载到木质部汁液[21],随后K+在蒸腾拉力作用下随汁液运输至地上部[65]。根细胞中K+浓度越高,SKOR通道越活跃,更多的K+被装载到木质部,随木质部汁液流输送到地上部器官;相反,根系积累的K+不够充分时,则地上部K+供应也会受到限制[66]。此外,K+吸收和转运是一个有机统一的整体,K+转运系统的运转对K+的吸收也有一定的反馈调节作用。atskor突变体K+净吸收率显著低于野生型植株,根中AtHAK5和AtAKT1表达水平显著降低[67],表明K+向地上部的运输减少,从而使根系K+吸收能力降低。这些结果表明,SKOR在植物K+长距离运输及根部和地上部K+分配中起重要作用。
3 SKOR调控机制
3.1 SKOR受活性氧调控
几乎所有逆境如高盐、干旱、缺氧、冰冻、病原体、重金属、紫外线等,都会使植物产生活性氧(reactive oxygen species,ROS)[68],如:氧自由基(radicals,O2-)、单线态氧(singlet oxygen,1O2)、超氧阴离子自由基(superoxide radical,·O2-)、超氧化物(chemistry of superoxide)、羟基自由基(hydroxyl radical,·OH)、过氧化氢(hydrogen peroxide,H2O2)、过渡金属(transition metals)等[69]。大量研究表明,ROS的产生会导致细胞生化途径发生改变,激活SKOR、GORK等通道[70],并诱导其编码基因的表达,致使大量的K+流出。Demidchik等[71-72]研究发现,抗坏血酸(ascorbic acid,AA)、Cu2+和H2O2等混合物处理拟南芥、豌豆(Pisum sativum)、玉米和小麦(Triticum aestivum)导致根部出现大量K+外流,电流对K+通道阻滞剂TEA+(tetraethylammonium)敏感,说明ROS诱导的K+外流是Kout通道(SKOR和GORK)介导的。Garcia-Mata等[73]的研究将能迅速增强SKOR的电流并延长电流时间的通道激活剂明确为H2O2。SKOR对H2O2的敏感位点为Cys,即S3 α-螺旋的Cys168及其空间上相邻的Cys228和Cys234被H2O2氧化形成亚磺酸,这一反应可能使SKOR构象发生改变,从而增强对K+的通透性[73-74]。氧化应激诱导的K+外流增加可能触发细胞能量重新分配,降低需耗能的生物合成,抑制植株生长,利用释放的能量来抵御胁迫造成的伤害,以增加植物在不利环境下的存活概率[75]。
3.2 SKOR受pH调 控
Lacombe等[76]在非洲爪蟾卵母细胞中表达AtSKOR发现其电流受到pH调节,当注射酸性溶液使细胞内部pH从7.4降至7.2时,SKOR的电流则下降约80%。进一步研究发现,pH变化未显著影响SKOR单通道活性,但可以改变激活的SKOR通道数量。酸性阳离子与SKOR通道S4跨膜片段相互作用,使通道处于不可被K+激活的休眠状态,随着内部酸化休眠通道的数量增加,从而使SKOR介导的K+外流减少[76]。pH通过调控激活的SKOR通道的数量来影响其功能。
3.3 SKOR受脱落酸调控
脱落酸(abscisic acid,ABA)是最重要的胁迫反应激素之一,广泛存在于高等植物的各组织器官中,在盐胁迫下参与渗透调节、离子平衡和ROS清除等,在抵御盐胁迫中发挥着不可替代的作用[77]。ABA重要的功能就是调控根中K+的转运。Roberts[78]和Wolf等[79]的研究表明,ABA对玉米ZmSKOR的活性具有潜在的调节作用,可通过降低其活性而减少经木质部的K+转运。SKOR的C端Ankyrin结构域含有保守残基,类似于吡拉巴汀抗性1/类吡咯蛋白/ABA受体的调节成分(pyrabactin resistance 1/PYR-like proteins/regulatory components of ABA receptors,PYR/PYL/RCARs)的ABA结合位点[80],可能有助于其与ABA相互作用。此外,大量研究表明,SKOR的表达受到ABA调节。Gaymard等[21]最早发现AtSKOR的表达丰度在ABA处理下显著降低,随着更多的SKOR基因被发掘,外源ABA处理降低黑果枸杞LrSKOR[81]、水稻OsSKOR[82]、灰楸CfSKOR[83]表达水平的现象相继被报道。ABA可降低木质部SKOR表达水平,同时诱导韧皮部AKT2表达[84]。这种双重效应一方面会抑制K+向地上部运输,另一方面则促进K+通过韧皮部向根回流,有助于在缺水和盐胁迫下保持根中K+稳态平衡。
3.4 SKOR受硫化氢调控
硫化氢(hydrogen sulfide,H2S)是一种具有调节功能的气体信号分子,通过维持Na+/K+稳态平衡,改善光合作用和抗氧化系统等参与植物对各种非生物胁迫的响应[85-86]。研究表明,H2S可以通过防止K+流失来增强植株耐盐性。H2S一方面调控质膜Na+/H+逆向转运蛋白、H+-ATPase等促进Na+排出并维持H+梯度[87],保持细胞膜电位,限制去极化激活的SKOR活性[88];另一方面通过调控盐胁迫下根系K+通道相关基因的表达从而维持K+水平的相对稳定。与NaCl单独处理相比,NaHS预处理后再进行NaCl处理,使得平邑甜茶(Malus hupehensis)MhSKOR表达量降低,MhAKT1表达量增加,K+外流速率与K+含量下降幅度也明显减缓[89-90],在紫花苜蓿(Medicago sativa)中也发现了类似的现象[91]。NaCl处理黄瓜(Cucumis sativus)后,CsSOS1和CsSKOR在叶中的转录水平显著降低,而在根中有所增加,添加NaHS则逆转了这种趋势[92]。另外,H2S产生的关键酶L-半胱氨酸脱硫酶(L-cysteine desulfhydrase,LCD)的功能缺失会导致拟南芥AtAKT1、AtAKT2、AtKC1和AtKAT1等基因的表达水平明显上调,AtGORK和AtSKOR表达水平则显著下调[93]。这些结果表明,SKOR的K+整流功能受到H2S间接调控。
4 SKOR对非生物逆境胁迫的响应
4.1 SKOR对盐胁迫的响应
在盐胁迫下,过多的Na+会与K+竞争质膜上的摄取位点,从而抑制K+吸收;另外,其与K+竞争细胞质中关键代谢酶的结合位点,紊乱植物组织的新陈代谢[1]。因此,维持K+稳态和高K+/Na+的K+转运蛋白和K+通道在植物耐盐性中起着重要作用[94]。大量研究表明,SKOR参与植物对盐胁迫的响应并在一定程度上影响着植物的耐盐性。低浓度NaCl处理使长穗偃麦草EeSKOR[95]、甜菜BvSKOR[96]、梨(Pyrus betulaefolia)PbSKOR[97]、平邑甜茶MhSKOR[98]的表达水平在短期内显著上调,黑果枸杞根中LrSKOR表达量先降低而24 h后升高[99]。随着NaCl浓度的增加,甜瓜CmSKOR[31]、长穗偃麦草EeSKOR[96]的表达水平先增加后略有下降,峰值出现在150 mmol·L-1处。盐胁迫后多年生黑麦草(Lolium perenne)耐盐品种“Catalina”中AKTI和SKOR表达量均显著高于盐敏感品种“Inspire”[100],推测耐盐品种可能通过AKT1和SKOR共同维持植株根部和地上部K+含量来抵御盐胁迫。在拟南芥中CmSKOR过量表达后,转基因植株在NaCl处理下生长更加健壮,表现出较大的PSII最大光化学效率(Fv/Fm)、较高的生物量以及K+含量[31],比野生型具有更强的耐盐能力。相对地,水稻osk5.2突变体植株木质部汁液中K+浓度较野生型植株显著下降,而Na+浓度则变化不大,K+/Na+和野生型植株之间差异随着盐处理时间的延长而增大[101]。这些结果表明,SKOR可以通过维持植物体内较高的K+/Na+来增强植物耐盐性。也有证据显示,参与K+韧皮部再循环的AKT2/3在盐胁迫下被诱导[102-103],SKOR和AKT2/3的上调能够促进K+在维管组织中的高速循环,从而使K+在根和地上部之间不断地重新分配,以减轻Na+对地上部幼嫩组织的毒害。
4.2 SKOR对渗透胁迫的响应
渗透胁迫会影响植物光合作用和正常新陈代谢,从而抑制植物生长,甚至导致死亡[104]。植物在长期的进化过程中,逐渐形成了各种各样的适应策略,以应对渗透胁迫[64]。RNA-seq结果表明,K+转运相关基因在渗透胁迫反应过程中表达也受到调控,在胁迫初期SKOR表达量升高,以更好地调节K+在根和叶之间分配[29]。聚乙二醇(polyethylene glycol,PEG)处理后,烟草NtSKOR[33]和绿豆VrSKOR[42]表达量在短期内剧烈升高后有小幅下降,霸王根和茎中ZxSKOR被显著诱导[29],可见SKOR能积极响应胁迫,促进K+在渗透胁迫下的积累与动态平衡。这些结果表明,SKOR可能在植物渗透胁迫响应中起着重要作用。
4.3 SKOR对K+饥饿的响应
在K+亏缺条件下,植物的光合作用显著下降,生长迅速减缓,生殖受阻[6]。在低K+胁迫下,亚麻(Linum usitatissimum)LuSKOR[105]、甘薯(Ipomoea batatas)IbSKOR1/2/3[106]表达量持续下降,地上部出现叶片失绿等典型的缺K+症状。K+摄取不足通过影响SKOR基因的表达,进而影响K+信号的传导及K+运输,从而影响植株的表型。高玉龙等[107]研究发现,低K+(10 μmol·L-1)处理烟草后,NtSKOR表达量在24 h内先上升后下降,结合低K+胁迫引起吲哚乙酸(indoleacetic acid,IAA)和茉莉酸(jasmonic acid,JA)等激素的变化,推测K+饥饿时,NtSKOR表达模式受到植物激素调控[107-108]。用KCl补给K+饥饿处理后的霸王,ZxSKOR在不同浓度KCl处理中的转录水平都有所增加,且随着外源K+浓度的升高其表达量呈不断增加趋势,表明ZxSKOR受KCl显著诱导[29],以保证在缺K+之后SKOR恢复向木质部装载K+的功能。这些结果表明,SKOR响应低K+胁迫调整自身表达,调节K+在根和地上部之间转运和整株的分配为植株抵御K+饥饿环境做贡献。
4.4 SKOR对营养亏缺的响应
植物摄取不同养分的信号通路是相互关联的,一种营养元素的亏缺可能会导致其他营养元素摄取的降低。几乎所有的营养缺乏处理均可显著降低K+的吸收以及向地上部转运能力,N、P和S亏缺均可降低番茄(Lycopersicon esculentum)和拟南芥中SKOR转录水平[109]。这就暗示了植物对不同养分摄取的过程中涉及转录调控的信号之间可能存在串扰。对不同养分获取进行协调调控的一个典型例子是N和K,这两种营养元素转运之间的密切关系最早在“Dijkshoorn-Ben Zioni模型”中被描述[110];该模型表明,NO3-在木质部中以K+作为对抗离子从根部运输到地上部。Drechsler等[111]研究发现,NO3-缺乏抑制了AKT1和SKOR基因的表达。该项研究进一步支持了木质部中K+和NO3-转运之间的相互联系。硝酸盐转运体1.1(nitrate transporter 1.1,NRT1.1)和NRT1.5功能缺失后,K+从根部向地上部的运输能力减弱,SKOR表达受到抑制[58,112]。深入解析养分亏缺下K+吸收和转运的调控机制,对于提高作物养分利用效率具有重要意义。
5 展望
高盐、干旱、养分失衡等是抑制植物生长、限制作物产量的常见胁迫条件,大多数作物在整个生长过程中都会经历一种或多种非生物胁迫,因而研究植物的胁迫响应和胁迫耐受性对于促进生产具有重要意义。在过去的10余年中,有关逆境胁迫条件下细胞维持K+稳态平衡机制成为植物逆境生理学研究热点之一。SKOR编码一类外向整流K+通道蛋白,负责将根吸收的K+装载到木质部,是参与植物体内K+转运的主要通道蛋白之一,其在植物正常生长发育和胁迫响应中扮演着重要角色。目前对模式植物拟南芥AtSKOR的研究较多,其结构、功能研究得较清楚;然而,对其他物种SKOR的报道相对较少,其生物学功能、表达调控机制、逆境胁迫响应等方面的研究才刚刚起步,将具有抗逆潜力的SKOR基因应用于作物遗传改良还有很长的路要走。
因此,今后对SKOR的研究可从以下3方面着手:1)挖掘和鉴定其他作物SKOR基因,通过过量表达、RNA干扰、基因敲除等方法揭示其在不同类型植物K+/Na+平衡调控和抗逆中的功能。2)利用基因组学、蛋白质组学、基因编辑等技术手段探索SKOR响应逆境胁迫的信号通路,解析SKOR在植物抗逆性中的作用机制,为农作物抗逆性遗传改良提供基因资源和理论依据。3)采用基因工程技术,将盐生植物或嗜盐作物SKOR转入经济作物或粮食作物中,从而提高作物对K+的利用效率,增强植物的抗逆性。
