亚急性瘤胃酸中毒耐受性不同的奶牛瘤胃上皮形态及功能差异研究
2023-02-28张涛牟英玉亓王盼张继友毛胜勇
张涛,牟英玉,亓王盼,张继友,毛胜勇
(南京农业大学消化道微生物研究室,反刍动物与营养饲料工程中心,动物科技学院,江苏 南京 210095)
我国是一个优质牧草资源十分匮乏的国家,奶牛生产中,为提高奶牛产奶量,养殖者常给奶牛饲喂高谷物日粮以提高产奶量。然而,奶牛摄入过多的易发酵碳水化合物易导致瘤胃微生物发酵速率加快,产生大量挥发性脂肪酸(volatile fatty acid,VFA),导致瘤胃内环境酸碱平衡被破坏,引起瘤胃pH急剧下降[1],继而诱发亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)等瘤胃疾病[2]。研究发现,SARA可引起瘤胃代谢紊乱,诱发皱胃移位、瘤胃炎、乳房炎及蹄叶炎等[3-5],给奶牛养殖造成了巨大的经济损失。生产中发现,尽管通过营养配方调整、添加瘤胃缓冲剂或微生物制剂可降低SARA的发生率,但奶牛场中仍然存在一定程度SARA的发生率,这一现象显示,SARA的发生除受日粮结构的影响外,还与其他因素有关。此外,近年来研究发现,即便在相同日粮条件下,奶牛发生SARA的严重程度也不一致[6-8],造成营养配方调整方案实施困难,部分易感个体出现严重的酸中毒现象。这些结果说明,奶牛个体间对SARA的易感性存在差异,这种个体差异的存在可能是导致当前营养调控手段不能完全控制奶牛发生SARA的根本原因。因此,明确SARA耐受不同奶牛的瘤胃生理特征,有利于筛选SARA耐受性强的奶牛进行饲养,进而降低牛群患SARA的风险,减少蹄叶炎、真胃移位等营养代谢病的发生,从而推进奶牛分群饲养及健康养殖的发展。
众所周知,SARA的发生主要与瘤胃pH过低有关,而瘤胃pH主要受瘤胃内VFA生成和移除速率的影响[9-10]。因此,瘤胃内VFA生成和移除速率差异极有可能是造成SARA耐受性不同的关键因素。在瘤胃中,VFA的移除主要通过瘤胃上皮对VFA吸收来实现,而瘤胃上皮对VFA的吸收主要与瘤胃上皮形态和功能有关。然而,目前关于不同SARA易感奶牛的瘤胃上皮形态及其与VFA吸收相关的功能基因表达差异的研究鲜有报道。由此,本研究拟在相同日粮条件下,以瘤胃pH为基准,筛选出对SARA耐受性不同的奶牛,结合伊红染色(hematoxylin-eosin staining,HE)切片及实时定量PCR等技术手段,比较研究两组奶牛瘤胃上皮组织形态及其功能基因表达差异,以揭示奶牛SARA耐受性与其瘤胃上皮形态与功能基因表达的潜在关系。
1 材料与方法
1.1 试验设计及动物饲养管理
本试验于2019年2月在江苏泰州天资牧业有限公司开展,选用12头体重相近且装有永久性瘤胃瘘管的泌乳中期荷斯坦奶牛[2~3胎,泌乳天数为(114±22)d],栓系饲喂,自由采食和饮水。试验期为35 d,前14 d为日粮适应期,后21 d为试验期,奶牛试验期提供精粗比为4∶6的混合饲粮,饲粮配方及营养水平在张涛等[11]的研究中已详细描述。分别于每天8:00和19:00饲喂,剩料量控制在饲喂量的5%~10%,并于饲喂前挤奶。
1.2 样品采集
在试验期第20和21天晨饲后的0、2、4、6、8、12 h测定瘤胃pH,并于0、4、8、12 h测定瘤胃VFA浓度,随后基于瘤胃pH变化,将奶牛进行分组。在第21天晨饲前,采集人员佩戴一次性灭菌长臂手套,通过瘤胃瘘管触及瘤胃腹囊乳头根部,用手指捏断瘤胃乳头根部,迅速放置培养皿中用冰磷酸盐缓冲溶液(phospate buffered saline,PBS)清洗3次后,挑选完整上皮乳头置于4%多聚甲醛溶液中,并置于4 °C保存,用于瘤胃上皮乳头组织形态学分析;取剩余部分乳头剪碎,于液氮中保存,用于RNA提取。
1.3 样品测定
1.3.1 瘤胃上皮组织形态测定 每头奶牛选取3个完整的瘤胃上皮乳头进行脱水、漂洗,并包埋于石蜡中。每个蜡块不连续切5块厚6 μm的组织,进行HE染色,最后封片。在40倍物镜下对瘤胃上皮的各层厚度进行测量,每张切片选取5个不同区域,每头动物共有15个重复。瘤胃上皮各层厚度的测量具体步骤参照Steele等[12]的研究方法。
1.3.2 瘤胃上皮乳头RNA提取及实时定量PCR分析 瘤胃上皮乳头RNA提取采用TRIzo(lTakara生物,日本)方法,提取的RNA浓度使用NanoDrop 1000分光光度计(Nyxor Biotech,法国)测定。RNA吸光值在1.8~2.1,说明所提取的RNA纯度合格,之后用1.4%的琼脂糖甲醛凝胶电泳验证RNA样品的完整性。RNA经检测合格后,将每个样品的RNA浓度调整至500 ng·μL-1,并使用反转录试剂盒(Takara生物,日本)合成cDNA。根据GenBank上牛的核酸序列,应用Primer 5.0(Whitehead Institute,美国)软件进行相应的定量引物设计。引物序列如表1所示,所有引物由上海擎科生物科技有限公司合成。使用ABI 7500定量PCR仪(Thermo,新加坡)对目的基因及内参基因进行定量。反应程序如下:95 °C 30 s预变性,95 °C 5 s,60 °C(目的基因)34 s,重复40个循环。使用20 μL反应体系,所有样品设3个重复,目的基因相对表达量以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参进行校正,数据分析采用2-△△Ct方法[13]。
1.4 数据处理
采用Excel(2019)初步整理数据后,采用SPSS 26.0软件中单因素重复测量模型分析瘤胃pH数据,时间点作为重复。瘤胃上皮乳头组织形态学及其功能基因表达数据使用SPSS软件中独立样本T检验分析,P<0.05表示差异显著。
2 结果与分析
根据测得的瘤胃pH,本试验将瘤胃pH平均值最高(pH=6.11,n=4)和最低(pH=5.76,n=4)的奶牛分为耐受组(tolerant,TOL)和易感组(susceptible,SUS),具体数据详见Zhang等[14]的研究。
2.1 SARA易感与耐受奶牛瘤胃上皮形态比较
HE染色切片结果如图1所示,测量结果显示,与TOL组奶牛比较,SUS组奶牛的瘤胃上皮乳头的棘突层和基底层厚度(P=0.001)及总厚度(P=0.001)显著增厚,两组瘤胃上皮乳头的角质层(P=0.568)、颗粒层(P=0.360)厚度无显著性差异(表2)。
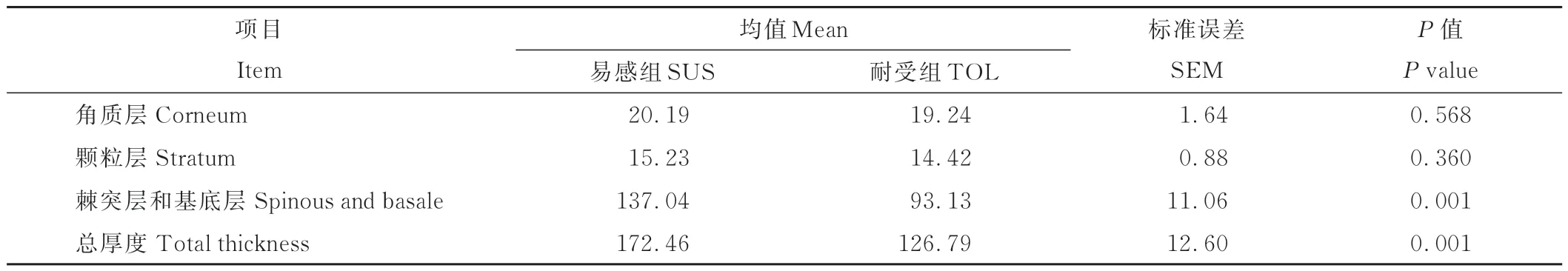
表2 SUS和TOL组奶牛瘤胃上皮厚度变化Table 2 The changes in rumen epithelial thickness between the SUS(susceptible)and TOL(tolerant)groups(μm)

图1 瘤胃上皮乳头光学显微镜图Fig.1 Light micrograph of rumen epithelial papillae
2.2 SARA易感与耐受奶牛瘤胃上皮细胞中与pH调节及氢离子转运相关的基因表达量比较
为探究瘤胃上皮对VFA的吸收能力与SARA耐受性之间的潜在关系,本研究对SARA耐受性不同的奶牛瘤胃上皮细胞的VFA吸收相关基因表达量进行了定量分析。如图2A所示,SUS组奶牛瘤胃上皮细胞中参与瘤胃pH调节的vH+ATPase和Na+/K+ATPase基因及Na+/H+交换蛋白NHE1、NHE2和NHE3表达量显著高于TOL组(P<0.01)。如图2B所示,与TOL组比较,SUS组瘤胃上皮细胞与短链脂肪酸转运相关的蛋白基因PAT1、MCT4和DRA的表达量显著下降(P<0.01)。
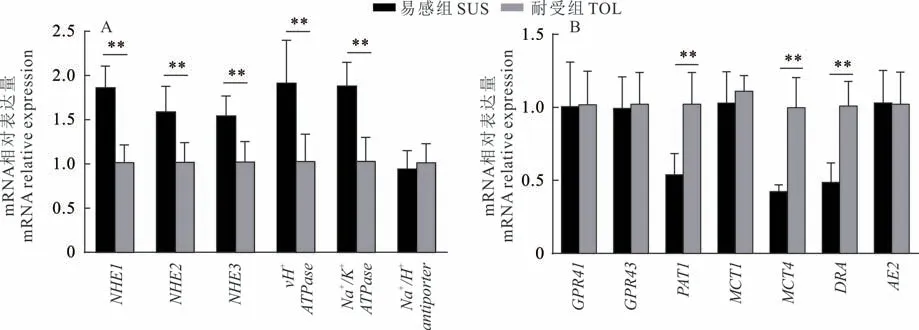
图2 瘤胃上皮细胞参与离子交换及VFA吸收相关基因相对表达量Fig.2 The relative expression levels of ion exchange and VFA absorption-related gene in rumen epithelial cells
2.3 SARA易感与耐受奶牛瘤胃上皮细胞中与VFA转运及代谢相关的基因表达量比较
瘤胃VFA经瘤胃上皮后,部分在瘤胃上皮细胞内代谢,为瘤胃上皮细胞提供能量。因此,本研究检测了瘤胃上皮细胞有关VFA代谢的相关基因表达量。结果如图3A显示,SUS组丙酰基辅酶A羧化酶(Propionyl-CoA carboxylase)和丙酮酸脱氢酶1(PDHA1)的mRNA表达量显著高于TOL组,而乳酸脱氢酶a(LDH a)的基因表达量显著降低(P<0.01)。瘤胃上皮细胞中调控胆固醇及酮体合成的基因定量结果显示(图3B),与TOL组比较,SUS组奶牛瘤胃上皮细胞中的SREBP1和SREBP2表达量显著升高(P<0.05),而HMGCL-2表达量显著下降(P<0.01)。
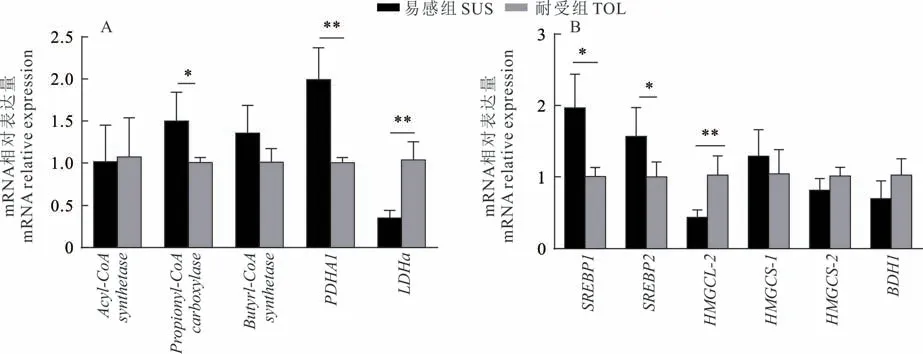
图3 瘤胃上皮细胞参与VFA代谢相关基因的相对表达量Fig.3 The relative expression levels of VFA metabolism genes in rumen epithelial cells
2.4 SARA易感与耐受奶牛瘤胃上皮细胞中与增殖和凋亡相关的基因表达量比较
此前结果发现,两组奶牛瘤胃上皮厚度差异显著,暗示其瘤胃上皮细胞增殖和凋亡进程存在变化。因此,本研究对控制瘤胃上皮细胞增殖和凋亡的基因表达量进行定量,结果显示,SUS组CDK2、CDK6和Cyclin D1表达量极显著高于TOL组(P<0.01,图4A),且控制细胞凋亡的Bad(P<0.05)和Caspase-9(P<0.01)的表达量显著升高(图4B),该结果表明易感奶牛瘤胃上皮细胞的细胞周期进程更短。

图4 调控瘤胃上皮细胞增殖和凋亡的基因相对表达量Fig.4 The relative expression levels of cell proliferation and apoptosis genes in rumen epithelial
2.5 瘤胃发酵参数与瘤胃上皮细胞功能基因表达量的关联分析
为探究瘤胃发酵参数与瘤胃上皮细胞功能间的内在联系,本试验将瘤胃发酵参数[14]与参与调节瘤胃VFA吸收与代谢的相关差异基因进行关联分析(基于Superman方法计算)。根据阈值|r|>0.6,P<0.05为筛选标准,以确定瘤胃发酵参数与上皮细胞差异表达基因的相关性。如图5所示,瘤胃pH与钠氢离子交换蛋白NHE1和NHE2表达量呈显著负相关(P<0.05),瘤胃丙酸、丁酸、戊酸及TVFA浓度与NHE1表达量显著正相关;PAT1、MCT4和DRA表达量与丙酸浓度显著负相关,而与瘤胃pH显著正相关。
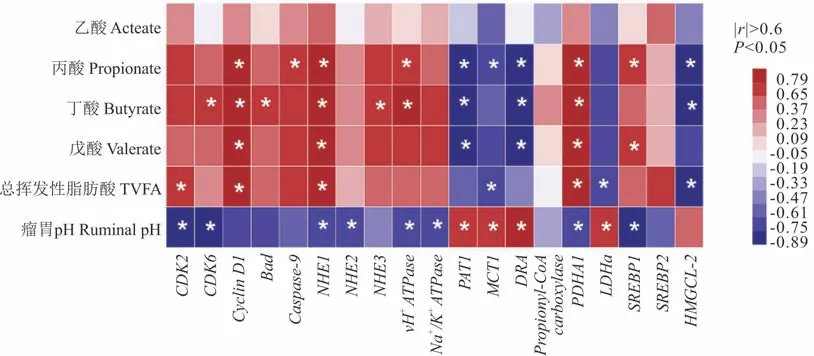
图5 瘤胃发酵参数与瘤胃上皮功能基因相对表达量的相关性Fig.5 Correlation between rumen fermentation parameters and relative expression of epithelial functional genes
3 讨论
长期饲喂高精料日粮可引起奶牛瘤胃内VFA浓度升高,使瘤胃pH长期处于较低水平,进而引发一系列营养代谢疾病如瘤胃炎等[15-16]。生产实践中发现,在饲喂相同高精料日粮条件下,奶牛个体间发生SARA的严重程度不一致[8-17]。本试验采用相同日粮饲喂,发现12头奶牛的平均瘤胃pH出现明显的差异,部分奶牛的瘤胃平均pH值明显要低于另一些奶牛,且部分奶牛的瘤胃pH值已达到SARA的标准,该结果与以往有关SARA易感性的研究结果一致[18-19],表明奶牛个体间SARA耐受程度不同的现象普遍存在。前期研究结果表明,SUS组奶牛的瘤胃TVFA、丙酸、丁酸及戊酸浓度显著高于TOL组,并揭示了部分瘤胃微生物与SARA耐受性差异的潜在关联[14],但瘤胃内VFA的积累不仅取决于微生物的发酵速率,同时与瘤胃上皮对VFA的吸收代谢息息相关。因此在该研究中,对两组奶牛瘤胃上皮形态及其对VFA的吸收代谢进行了深入研究。
瘤胃上皮乳头棘突层和基底层含有丰富的细胞器,是VFA吸收和代谢的主要场所[20]。本研究中,SUS组奶牛瘤胃上皮棘突层和基底层的厚度明显要比TOL组奶牛厚,该结果表明,两组奶牛瘤胃上皮细胞对VFA的吸收代谢能力可能存在差异。由此,本试验进而研究了两组奶牛瘤胃上皮细胞调控VFA吸收与代谢相关基因的表达。众所周知,瘤胃对VFA的吸收机制主要包括被动扩散、阴离子交换及质子耦合等,其中脂溶性VFA可直接通过瘤胃壁之间的间隙进入血液,而大部分游离的脂肪酸通过阴离子交换及质子耦合途径吸收[21-22]。DRA与PAT1是主要的VFA-/H+交换载体,而MCT4是VFA-/H+共转运载体,对瘤胃内VFA-吸收起关键作用[21-23]。SUS组奶牛瘤胃上皮细胞中参与挥发性脂肪酸酸根离子吸收的DRA、PAT1和MCT4的相对表达量明显较低,表明其对瘤胃内游离脂肪酸酸根离子的吸收作用较弱。在瘤胃中,非游离态的VFA主要通过被动扩散进入瘤胃上皮细胞,并迅速解离成VFA-和H+,H+浓度的升高可引起细胞内pH值下降,从而激活细胞膜上的NHE家族基因,将H+运输至细胞外以维持细胞内稳态[24-25]。SUS组瘤胃上皮细胞中NHE1、NHE2、NHE3和Na+/K+ATPase等基因表达量上调,表明其有利于胞内H+外排,进而导致瘤胃中pH下降。关联分析结果也证实了这一推测,NHE家族基因表达量与瘤胃pH呈显著负相关,而DRA、PAT1和MCT4基因则与瘤胃pH呈显著正相关。由此,以上的结果表明,两组奶牛的瘤胃上皮细胞对VFA的吸收模式存在差异,主要表现在SARA易感奶牛的瘤胃上皮对瘤胃中游离的脂肪酸酸根离子的吸收减缓,而对瘤胃内非游离VFA的吸收增加。
瘤胃内VFA被瘤胃上皮细胞吸收后,大部分VFA在瘤胃上皮细胞内被代谢,仅少部分直接进入血液,且VFA的代谢速率会影响其吸收速率。本试验进一步探究了两组奶牛瘤胃上皮细胞中调控VFA代谢的相关基因表达差异。研究表明,瘤胃中75%的丙酸和95%的丁酸经瘤胃上皮细胞代谢[26],其中丁酸主要由瘤胃上皮细胞中的酰基辅酶A合成酶家族加入辅酶A酯生成乙酰辅酶A,最终合成酮体和胆固醇[27-28]。本研究发现,SUS组奶牛瘤胃上皮细胞中丙酸代谢途径中的Propionyl-CoA carboxylase和PDHA1基因表达量明显较高,证明SUS组奶牛瘤胃上皮丙酸代谢更为活跃,且SUS组瘤胃内丙酸和丁酸浓度升高亦可促进瘤胃上皮代谢。然而,SUS组的SREBP1和SREBP2表达量却高于TOL组,说明SUS组中SREBP通路被激活,但激活该通路的主要因子仍不清楚,需进一步研究。此外,本研究发现,SUS组奶牛瘤胃上皮细胞中促进细胞增殖(CDK2,CDK6和Cyclin D1)和凋亡(Bad,Caspase-9)的基因表达量明显较高,结果说明SUS组奶牛瘤胃上皮细胞周期进程加快,这也可能是导致这些奶牛瘤胃上皮层总厚度增加的原因之一。
4 结论
综上所述,本研究表明,SUS组奶牛瘤胃上皮细胞调控游离脂肪酸吸收的DRA、PAT1和MCT4基因表达量下调,而调节非游离脂肪酸吸收的NHE家族基因表达量增加,结果导致奶牛瘤胃内游离脂肪酸的累积,瘤胃pH下降,这也是不同奶牛对SARA耐受性存在个体差异的根本原因之一。此外,SUS组奶牛瘤胃上皮细胞参与调控细胞增殖与凋亡的基因表达量显著增高,说明SUS组奶牛的瘤胃上皮细胞周期进程加快,导致瘤胃上皮层总厚度增厚。
