曲马多对坐骨神经痛大鼠脊髓c-jun、c-fos表达及星形胶质细胞活化的影响
2023-02-28胡滨王大斌郑洁
胡滨 王大斌 郑洁
(1泸州市人民医院疼痛科,四川 泸州 646000;2西南医科大学附属中医医院麻醉科)
坐骨神经痛为坐骨神经循行及分布区域持续性、阵发性疼痛的一种神经病理性疼痛(NP),由椎间盘突出、腰椎退行性病变引起〔1〕。坐骨神经痛发病率较高,是临床研究的热点之一〔2〕。研究发现,星形胶质细胞活化与NP关系密切,而抑制星形胶质细胞活化并阻断其级联反应是临床疼痛治疗和镇痛药物研发的关键〔3〕。研究证实,Jun原癌基因(c-jun)与Fos原癌基因(c-fos)可组成二聚体复合物-活化蛋白(AP)-1〔4〕,而AP-1不仅可通过调节星形胶质细胞活化标志物胶质纤维酸性蛋白(GFAP)表达,促进星形胶质细胞活化增生〔5〕,还可通过调控细胞生存、凋亡、炎症等通路相关基因表达,参与多种NP发生过程〔6〕。故探究c-jun/c-fos通路的调控作用可能有利于阐明星形胶质细胞参与坐骨神经痛发生过程的分子机制。曲马多又名反胺苯环醇,为一种中等强度的中枢镇痛药,其耐药性和成瘾性较小,可广泛应用于各种原因引起的急慢性中重度疼痛〔7〕,但曲马多缓解患者疼痛症状的分子生物学机制还不甚明确,且曲马多对坐骨神经痛患者的改善作用报道较少。本研究推测曲马多可能通过调控c-jun/c-fos通路蛋白表达抑制星形胶质细胞活化,进而缓解坐骨神经痛疼痛症状,并建立大鼠坐骨神经痛模型验证上述推测。
1 材料及方法
1.1实验动物 健康清洁级SD雄性大鼠,体重200~220 g,购自广东省医学实验动物中心〔SCXK(粤)2018-0002〕。本研究经医院动物伦理委员会审核批准〔IACUC-01(20160917)〕。大鼠于泸州市人民医院动物房中饲养。
1.2主要试剂及仪器 曲马多(规格:1 mg,性状:干粉,天津阿斯尔生物,货号:M9-34);前列腺素(PG)E2酶联免疫吸附试验(ELISA)试剂盒(货号:R31545,上海圻明生物科技有限公司);苏木素-伊红(HE)染色试剂盒(上海联迈生物,货号:LMO105);P物质(SP)ELISA试剂盒(货号:CSB-E08361r,上海振誉生物科技有限公司);兔抗胶质纤维酸性蛋白(GFAP)、c-fos、c-jun、激活子蛋白(AP)-1、白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、一氧化氮合酶(iNOS)抗体及山羊抗环氧化酶(COX)-2抗体(货号:分别为ab7260、ab134122、ab32385、ab230273、ab215288、ab200478、ab136918、ab23672,购自美国Abcam);蛋白电泳仪、半干转膜仪(型号1659001、Trans-Blot SD,美国Bio-Rad)等。
1.3模型构建与药物干预 坐骨神经痛模型构建方法如参照文献〔8〕所述:大鼠置于无菌操作台中,腹腔注射30 mg/kg戊巴比妥钠麻醉大鼠,在距尾根部1 cm处切下鼠尾,缝合伤口,切开鼠尾椎间盘,取0.5 mg胶冻样髓核备用。将大鼠置于俯卧位固定于手术台上,无菌条件下行背正中切口,于L5棘突旁5 mm处切开肌肉层,暴露L5~6间孔外神经,将0.5 mg髓核浆涂抹黏于此神经上,诱发神经炎性反应,逐层缝合肌肉、筋膜,用青霉素3万U术野肌内注射并缝合皮肤后正常饲养。术后3 d,若观察到大鼠出现活动频繁、激惹行为增加且热刺激反应潜伏期(PWL)及机械痛敏阈值(PWT)检测结果异常,则为造模成功。将成功造模的大鼠随机分为曲马多低(10 mg/kg)、中(20 mg/kg)、高(30 mg/kg)剂量组、阳性对照组(吲哚美辛,7.5 mg/kg)和模型组,每组10只;另取10只大鼠作为假手术组,除制备髓核、暴露L5~6间孔外神经不黏附髓核后,剩余操作与模型组一致。术后第3天,曲马多各剂量组及吲哚美辛阳性对照组按10 ml/kg的容积灌胃给药,以生理盐水溶解稀释成1.00、2.00、3.00 mg/ml曲马多溶液和0.75 mg/ml吲哚美辛溶液,其剂量参照文献〔9,10〕设置;模型组和假手术组给予等容积生理盐水灌胃,1次/d,连续14 d。
1.4一般行为观察、PWT及PWL检测 各组大鼠均于末次给药后24 h,观察大鼠活动状况后,参照文献〔10〕采用触觉测痛仪及热辐射刺激仪测定各组大鼠PWT及PWL值。
1.5标本采取及血清疼痛标志物PGE2、SP水平检测 将各组大鼠麻醉,取腹主动脉血3 ml,3 000 r/min离心10 min,根据PGE2、SP ELISA试剂盒说明检测上清液PGE2、SP水平。断头处死大鼠,迅速解剖出手术同侧的L5段脊髓,于距L5脊髓髓核植入处前后约1.5 cm处割断脊髓,取出约3 cm的脊髓组织,剪取0.5 cm冻存,其余组织立即于多聚甲醛(4%)固定24 h后备用。
1.6各组脊髓HE染色及星形胶质细胞活化标志物GFAP免疫组化法检测 将1.4固定的脊髓组织制备成5 μm厚的石蜡切片。依据HE试剂盒说明书对部分切片进行染色、脱水、透明、封片,光学显微镜下观察脊髓组织病理变化。取剩余部分切片,脱蜡、水化及抗原修复后,与一抗抗体(GFAP,1∶500)室温孵育过夜;添加羊抗兔二抗(1∶1 000),室温下孵育2 h,加二氨基联苯胺(DAB)显色剂,苏木精溶液复染,然后透明、封片。在400倍光镜下随机取5个视野,应用Image Pro Plus5.0系统进行半定量分析,结果表示为5个视野阳性表达的平均光密度值。
1.7Western印迹测定脊髓组织c-jun、c-fos、AP-1、TNF-α、IL-1β、iNOS、COX-2蛋白水平 将1.4中冻存的脊髓组织进行匀浆,离心后,取上清液,提取并测定蛋白浓度。取50 μg蛋白进行电泳,转膜后用脱脂奶粉(5%)于37℃封闭2 h,加入c-fos(1∶1 000)、c-jun(1∶1 000)、AP-1(1∶1 000)、TNF-α(1∶1 000)、IL-1β(1∶1 000)、iNOS(1∶1 000)、COX-2(1∶1 000)、β-actin(1∶2 000)一抗,4℃孵育过夜;加入羊抗兔或羊抗鼠二抗溶液(1∶1 000),室温孵育2 h,增强化学发光法显色后拍照,最后用Image-J软件分析蛋白表达。
1.8统计学分析 采用SPSS22.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1曲马多影响一般行为 假手术组活动正常;模型组饮食量及活动量降低,出现易激惹行为;曲马多低、中、高剂量组及阳性对照组易激惹行为减少。
2.2曲马多影响PWT、PWL 模型组与假手术组相比,PWT、PWL显著降低(P<0.05)。曲马多低、中、高剂量组及阳性对照组与模型组相比,PWT、PWL显著升高(P<0.05);曲马多高剂量组与阳性对照组相比,PWT、PWL差异无统计学意义(P>0.05)。见表1。
2.3曲马多对血清疼痛指标的影响 与假手术组相比,模型组血清PGE2、SP水平显著升高(P<0.05)。曲马多低、中、高剂量组及阳性对照组与模型组相比,血清PGE2、SP水平显著降低(P<0.05);曲马多高剂量组与阳性对照组相比,PGE2、SP水平差异无统计学差异(P>0.05)。见表1。
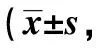
表1 各组PWT、PWL、PGE2、SP、GFAP平均光密度值比较分,n=10)
2.4曲马多对脊髓组织病理形态的影响 假手术组脊髓组织结构正常,神经纤维整齐排列。模型组大鼠神经纤维排列紊乱,轴突及髓鞘崩解,空泡变性较多。曲马多低、中、高剂量组及阳性对照组大鼠可见神经纤维逐渐连续,轴突生长良好,且随着曲马多剂量升高上述损伤情况改善明显。见图1。

图1 各组脊髓组织病理形态(HE染色,×200)
2.5曲马多对脊髓组织GFAP表达的影响 图2中棕色表示GFAP阳性表达,即活化星形胶质细胞。与假手术相比,模型组脊髓内GFAP表达水平显著升高(P<0.05);曲马多低、中、高剂量组及阳性对照组与模型组相比,GFAP表达水平降低(P<0.05),阳性对照组与曲马多高剂量组相比,GFAP表达变化差异无统计学意义(P>0.05)。见表1、图2。
2.6曲马多对脊髓组织c-fos、c-jun、AP-1、iNOS、COX-2蛋白表达的影响 与假手术组相比,模型组脊髓组织c-fos、c-jun、AP-1、iNOS、COX-2蛋白表达显著升高(P<0.05);与模型组相比,曲马多组脊髓组织c-fos、c-jun、AP-1、iNOS、COX-2蛋白表达均降低(P<0.05);阳性对照组与曲马多高剂量组相比,c-fos、c-jun、AP-1、iNOS、COX-2蛋白表达差异无统计学意义(P>0.05)。见表2、图3。
2.7曲马多影响脊髓内炎症因子蛋白表达 模型组与假手术组相比,TNF-α、IL-1β蛋白表达显著升高(P<0.05);曲马多组与模型组相比,脊髓内TNF-α、IL-1β蛋白表达均显著降低(P<0.05);阳性对照组与曲马多高剂量组相比,TNF-α、IL-1β蛋白表达差异无统计学意义(P>0.05)。见表2、图4。
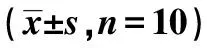
表2 各组脊髓组织c-fos、c-jun、AP-1、iNOS、COX-2、TNF-α及IL-1β蛋白表达水平

1~6:假手术组、模型组、曲马多低剂量组、曲马多中剂量组、曲马多高剂量组、阳性对照组;图4同图3 各组脊髓组织c-fos、c-jun、AP-1、iNOS、 COX-2蛋白表达

图4 各组脊髓组织TNF-α、IL-1β蛋白表达
3 讨论
坐骨神经痛常见致病因素为腰椎间盘突出,且髓核突出并冲破椎间盘纤维环束缚,引起邻近神经根炎性免疫刺激,是腰椎间盘突出是坐骨神经痛疼痛发生的主要机制之一〔11〕。于大鼠椎间孔外口植入髓核可模拟人体椎间盘突出引起的坐骨神经痛,且创伤小、操作简单、大鼠机械痛敏稳定〔8〕。本研究结果提示大鼠出现疼痛症状,表明造模成功。研究证实炎症是引起神经损伤和神经疼痛的重要原因〔2〕。罗强等〔12〕发现血清PGE2水平不仅能刺激椎间盘组织产生炎症反应,还能增加组织对各种致痛因子的敏感度并刺激组织释放SP等致痛因子,导致机体感觉神经末梢产生并传导疼痛。本研究提示,模型组大鼠出现炎症因子、疼痛因子升高及脊髓损伤现象。曲马多为新型阿片非麻醉性镇痛药,其镇痛效果显著,成瘾性及不良反应较小,已被临床应用于治疗多种疼痛〔7〕。王宇飞等〔13〕发现曲马多联合普瑞巴林治疗老年带状疱疹后神经痛效果较好。本研究发现,曲马多可缓解坐骨神经痛大鼠疼痛症状,改善神经炎性损伤,以高剂量最优,但其改善坐骨神经痛大鼠疼痛症状的具体分子机制还不明确。
镇痛机制主要涉及抑制炎症通路激活及星形胶质细胞活化、促进神经受损修复等,其中星形胶质细胞活化与神经疼痛机制的关系逐渐受到临床研究的重视〔14〕。GFAP可作为星形胶质细胞激活的重要标记物〔15〕。赵亮等〔16〕发现坐骨神经痛模型大鼠中存在星形胶质细胞活化即GFAP表达的升高。本研究提示,坐骨神经痛大鼠脊髓组织星形胶质细胞活化增加。近来研究发现“应激性传感器”c-fos可快速对外界刺激作出反应,并通过亮氨酸拉链与c-jun结合成AP-1转录因子〔17〕,AP-1不仅可调节GFAP表达〔5〕,还可诱导炎症因子释放并促进神经炎性损伤〔18〕。另外,星形胶质细胞中c-fos蛋白也可诱导TNF-α、IL-1β、iNOS和COX-2等炎症和免疫反应相关物质大量表达〔19〕,其中COX-2可上调PGE2表达参与神经炎性疼痛;NOS可促进NO弥散至细胞内和细胞外引起痛觉过敏。另有研究显示,IL-1β拮抗剂和COX-2抑制剂可减少疼痛标志物SP合成〔20〕。韩磊等〔8〕发现坐骨神经痛模型大鼠背根神经节内iNOS及COX-2表达增高,提示坐骨神经痛疼痛症状可能与iNOS/COX-2/PGE2/SP高表达有关。本研究推测神经元受到病理刺激后,c-fos迅速感应外界刺激,一方面与c-jun结合,形成AP-1转录因子,促进星形胶质细胞活化并诱导TNF-α、IL-1β炎症因子释放而促进神经炎症损伤,另一方面诱导iNOS和COX-2表达并调控疼痛物质PGE2或SP的释放,使机体感觉神经末梢产生并传导疼痛,这可能是c-fos/c-jun参与星形胶质细胞活化、炎症损伤、疼痛传导的主要机制。本研究提示,曲马多可降低c-fos/c-jun通路相关蛋白表达,可能与减轻疼痛、神经炎症损伤及星形胶质细胞活化有关,表明曲马多可能通过抑制c-fos/c-jun通路激活,抑制星形胶质细胞活化,缓解坐骨神经痛模型大鼠神经炎症损伤及疼痛症状。
综上,坐骨神经痛可通过抑制c-fos/c-jun通路激活,抑制星形胶质细胞活化,缓解坐骨神经痛模型大鼠神经炎症损伤及疼痛症状,为临床治疗坐骨神经痛和阐明曲马多发挥镇痛的可能生物学机制提供一定参考。但c-fos/c-jun通路靶向关系及分子调控作用与星形胶质细胞活化的机制较复杂,可能涉及其他机制共同作用,有待后续研究。
