下丘脑室旁核微量注射谷氨酸对心力衰竭大鼠心功能的影响及机制
2023-02-28李晶刘羽承郭雨欣张波赵津璋辛恬贾琳琳于海波
李晶 刘羽承 郭雨欣 张波 赵津璋,3 辛恬 贾琳琳 于海波
(佳木斯大学基础医学院 1生理教研室,黑龙江 佳木斯 154000;2微生态-免疫调节网络与相关疾病重点实验室;3佳木斯市中心医院;4佳木斯大学附属第一医院)
中枢神经系统(CNS)内的神经体液因素是心力衰竭(HF)进程中重要的病理机制,如肾素-血管紧张素-醛固酮系统(RAAS)、多种炎性因子的过度表达、氧化应激反应、神经递质功能失调等〔1〕。各种神经体液因子的过度激活及相关神经体液因素间的相互作用可进一步加重钠水潴留和交感神经兴奋性导致心功能恶化并形成恶性循环〔2〕。下丘脑室旁核(PVN)是调节体液平衡和心血管活动的重要核团,可整合多层次神经体液信号,是研究HF中枢机制的主要靶点。前期研究证实 miR-132和谷氨酸(Glu)在HF大鼠下丘脑PVN表达上调〔3〕,为进一步明确miR-132和Glu在HF大鼠下丘脑PVN的作用机制,本实验通过向HF大鼠下丘脑PVN微量注射Glu,灌流3 d后观察其对心功能、HF标志物血浆利钠肽(BNP)、心肌损伤标志物肌酸激酶同工酶(CK-MB)和下丘脑PVN miR-132表达的影响。
1 材料与方法
1.1模型制造 清洁级(SPF)成年雄性SD大鼠,动物许可号SCXK(黑)2019-001,购于哈尔滨医科大学实验动物中心。实验动物置于标准环境下饲养,自由饮食、水,适应环境后3 d随机分组为:假手术组(Sham)+人工脑脊液(ACSF)组、HF+ACSF组及HF+Glu组。腹腔注射10%水合氯醛(40 mg/kg),麻醉完成后实验动物四肢连接心电记录电极,BL-420生物信号系统描记心电图(ECG),开胸结扎左冠状动脉前降支上部复制HF疾病动物模型,结扎动脉后出现肉眼可见的心室壁舒缩活动减弱、心电ST段出现抬高判定动脉结扎成功。Sham组只进行开胸处理,不结扎血管。逐层缝合关闭胸腔,术后青霉素8万U肌肉注射连续3 d。各组实验动物结扎动脉4 w后均检测心功能,检测指标中的左室舒张末压力(LVEDP)≥15 mmHg认为HF动物模型复制成功〔4〕。
1.2侧脑室插管 实验动物麻醉状态下进行侧脑室插管,应用脑立体定位仪参照大鼠解剖图谱及许艳艳等〔5〕的方法操作。HF+Glu组大鼠通过微量注射泵侧脑室注入Glu浓度为200 μmol/L的ACSF 0.2 μl,其余两组侧脑室微灌注等量的ACSF,各组实验动物皆连续微量灌注3 d。
1.3主要药品和试剂 L-Glu(G1251-500G)购自Sigma公司,BNP和CK-MB试剂盒购自碧云天生物科技公司。
1.4心功能检测 完成Glu侧脑室灌注3 d后,应用BL-420生物信号系统和Aplio50东芝四维彩超由专业技师和临床医师在动物麻醉状态下完成心功能检测,操作步骤参考Cumberland等〔6〕的方法。
1.5标本收集 实验动物清醒状态下用肝素预先浸泡的细玻璃管刺入内眦静脉取血,离心后低温冰箱保存备用;保证实验动物在麻醉状态下断头处死,快速打开胸腔、小心剪开心包膜游离心脏,冷生理盐水冲洗,吸干水分后称重,分离左心室心肌组织称重后浸于固定液中保存用于组织学观察;断头处死动物后快速取脑,参考大鼠解剖图谱及王仁俊等〔7〕的方法确定下丘脑PVN位置,在冰块上尽快取出PVN组织,低温冰箱冷冻保存备用。
1.6BNP和CK-MB含量检测 血浆BNP水平检测应用酶联免疫吸附试验(ELISA),操作步骤按照试剂盒说明书进行;血浆CK-MB含量检测应用生化分析仪,操作步骤参考试剂盒说明书。
1.7miR-132在下丘脑PVN的表达 用RT-PCR技术检测各组大鼠下丘脑PVN miR-132的表达。下丘脑PVN组织切约100 mg薄片,裂解后离心静置,遵循随机选取的原则取10个样本,从每个样本中提取出2 μl液体,常规步骤检测miR-132的表达,具体操作参考杨波等〔8〕的方法。
1.8计算心脏重量指数(HW/BW)和左心室重量指数(LVW/BW) 大鼠HW/BW为大鼠心脏重量和体重的比值,LVW/BW为左心室和体重的比值,是可用来评价心肌肥厚的指标。
1.9组织学观察 经4%多聚甲醛固定的心脏组织标本用石蜡包埋切片,经烤片、脱蜡至水、苏木素-伊红(HE)染色、脱水封片等常规步骤后光学显微镜下镜检。
1.10统计学分析 采用SPSS19.0软件行t检验。
2 结 果
2.1心功能和HW/BW、LVW/BW检测结果 HF+Glu组和HF+ACSF组显示出恶化的心功能和心肌肥厚,除心率(HR)外,HW/BW、LVW/BW、LVEDP、左室收缩压(LVSP)、射血分数(EF)与Sham+ACSF组相比差异显著(P<0.05);HF+Glu组HR与HF+ACSF组相比有显著差异,其余检测指标与HF+ACSF组相比较差异无显著意义(P>0.05)。见表1。
2.2血浆BNP和CK-MB含量检测 HF+Glu组和HF+ACSF组血浆BNP和CK-MB含量较Sham+ACSF组明显上调(P<0.05);HF+Glu组血浆BNP和CK-MB含量较HF+ACSF组有所增加,但差异无统计学意义(P>0.05)。 见表2。
表1 各组心功能与HW/BW和LVW/BW检测结果
表2 各组血浆BNP和CK-MB含量比较
2.3miR-132在下丘脑PVN的表达 与Sham+ACSF组(0.32±0.02)相比,HF+ACSF组、HF+Glu组下丘脑miR-132表达明显升高(0.83±0.06、0.94±0.05,P<0.05);与HF+ACSF组比较,HF+Glu组miR-132的表达虽有升高,但差异无统计学意义(P>0.05)。见图1。
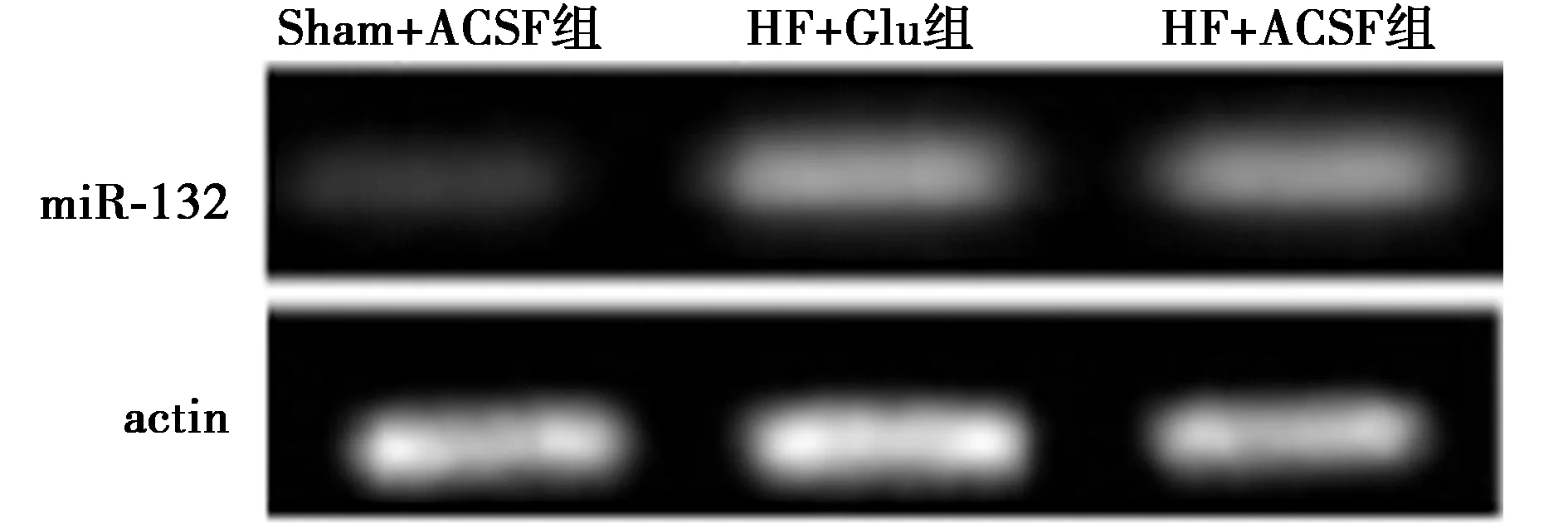
图1 miR-132在3组下丘脑PVN中的表达
2.4光镜下观察各组大鼠心肌结构 Sham+ACSF组大鼠心肌结构未见异常;HF大鼠出现心肌纤维变窄小,有纤维断裂、空泡样变性及脂肪变性出现;HF+Glu组和HF+ACSF组大鼠心肌结构出现的病理改变程度无显著差异。见图2。
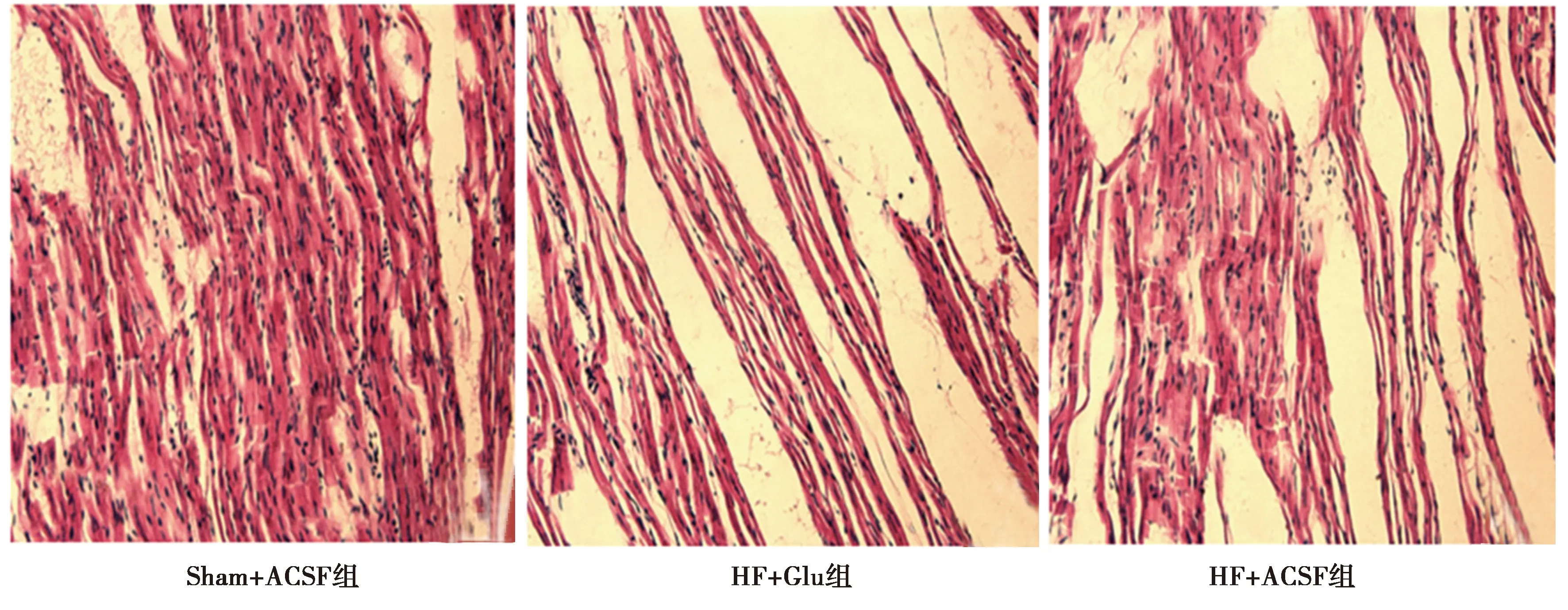
图2 光镜下3组心脏组织学结构(×400)
3 讨 论
miR-132是一种进化保守、具有组织特异性的非编码RNA,近年研究证实应激状态下miR-132在心脏组织中表达增多,可参与由血管紧张素(Ang)Ⅱ诱发的高血压和心肌肥厚、可通过多条信号通路参与HF基因水平的异常调控〔9〕。CDR132L是首个miR-132类抑制剂,在相关动物和人体临床研究中,CDR132L显示出可缓解HF、甚至逆转的良好药效性,为此miR-132作为治疗HF的潜在靶点而备受关注〔10,11〕。miR-132也在神经组织中高表达,参与调节CNS的发育和功能,与多种疾病关系密切。Walgrave等〔12〕证实miR-132是小鼠和人类成年神经发生的有效调节剂,阿尔茨海默病(AD)的病理改变可下调miR-132水平,而在一定范围内上调miR-132表达可促进齿状回神经细胞的增殖和分化,挽救AD小鼠的神经发生和记忆缺陷,miR-132还可靶向作用胆碱酯酶调节大脑的免疫炎症反应及维持脑血管完整性等〔13,14〕。尽管miR-132在CNS中作用广泛,但是否参与HF中枢机制尚不明确。
如前所述下丘脑PVN是调节体液和心血管活动稳态的重要核团,Glu是该核团里重要的兴奋性神经递质。与主要的抑制性神经递质γ-氨基丁酸(GABA)不同,PVN内的Glu来源广泛,既可来自下丘脑前核、海马等其他核团,也可来自自身大量的Glu能神经元的释放。miR-132与Glu的关系密切,如在海马区miR-132对突触可塑性的调控可通过激活相关的信号通路增加Glu受体阳性棘突的数量和提高微小兴奋性突触后电流频率调节神经元活动来实现;而miR-132的表达也受Glu受体的状态的影响〔15,16〕。此外有研究证实,在神经疾病的不同阶段,miR-132可在多种转录因子作用下向不同方向发挥调节作用〔17〕。
本研究提示,下丘脑PVN Glu可通过影响miR-132的表达加速心功能损害和HF进程。还观察到与HF+ACSF组相比较,HF动物下丘脑PVN微灌注Glu可进一步加剧心功能损伤和上调血浆BNP、CK-MB含量,但差异没有统计学意义,这可能是受Glu灌注时间和剂量的影响,受实验动物实时状态和HF动物模型死亡率的影响,本实验对Glu的灌流只持续了3 d,今后应进一步加强对HF动物模型方法的改进和下丘脑PVN Glu灌流剂量的摸索。
