细菌脂多糖对猪圆环病毒2型在PK-15细胞中复制的影响
2023-02-27张歆明郑钦生刘献辉张鹏飞王爽云张乐宜刘燕玲宋长绪
张歆明,徐 舸,郑钦生,刘献辉,张鹏飞,王爽云,张乐宜,刘燕玲,宋长绪*
(1.华南农业大学国家生猪种业工程技术研究中心,广东广州 510000;2.岭南现代农业科学与技术广东省实验室,广东广州 510000;3.华南农业大学食品学院,广东广州 510000)
猪圆环病毒2型(Porcine circovirus 2,PCV2)是一种小的无襄膜的单链环状DNA病毒[1]。主要引起“猪圆环病毒相关疾病”(Porcine circovirus-associated diseases,PCVAD),该病的主要临床症状表现为仔猪断奶后多系统衰竭综合征(Post weaning multisystemic wasting syndrome,PMWS)、猪皮炎与肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)和繁殖障碍相关疾病,虽然针对PCV2的多种疫苗已经被广泛使用,但是由于其复杂的免疫逃逸机制和变异株的不断产生,致使病毒很难被有效的防控,对全世界养猪业都造成严重的影响。PCV2经常与许多致病菌和病毒共感染,而且与单独感染相比,共感染表现出更加严重临床症状。有研究表明,PCV2单独攻毒时是很难出现典型的病理症状,但是在与其他病原体如猪繁殖与呼吸综合征病毒(PRRSV)[2]、猪细小病毒(PPV)[3]、猪肺炎支原体(Mycoplasmal hyopneumonia)[4],以及其他致病细菌混合感染或使用免疫刺激因子都会诱导严重的PMWS,这表明免疫刺激辅助因素对PCV2致病性是至关重要的[5]。
细菌脂多糖(lipoolysaccharide,LPS)存在于革兰氏阴性菌的外膜,一般在细菌死亡后脱落下来发挥毒性作用,是免疫系统最有效的诱导因子之一[6]。其与细胞复杂的“模式识别受体”级联识别,主要与Toll样受体4 (TLR4)-MD2复合物结合,由LPS结合蛋白(LBP)和CD14共同催化,激活多种细胞内信号通路[7]。有报道称LPS激活NF-κB信号通路,诱导白细胞介素(IL)-1、IL-2、IL-8,干扰素(IFN)-β和肿瘤坏死因子(TNF)-α[8]的产生。而NF-κB调节多种基因参与免疫和急性期炎症反应和细胞生存。NF-κB信号通路的激活以及IFN-β的产生均可以促进PCV2的复制[9-11]。还有研究表明IL-2过表达后也可以促进PCV2的复制[12]。因此,刺激猪免疫系统会诱导干扰素和白介素产生可能是导致PCV2在体内复制增加的关键,而理论上LPS可能是通过激活NF-κB信号通路,致使免疫系统激活,促进IFN-β产生导致PCV2复制的增加。然而,我们研究发现LPS对PCV2复制的影响具有双重效果。
本文研究LPS对PCV2复制的影响,发现 LPS的确可以显著激活NF-κB信号通路,促进IFN-β和IL-2的表达,从而促进PCV2的复制,值得注意的是,研究发现LPS处理前期是抑制PCV2复制的,深入研究表明LPS抑制PCV2的吸附,阻止PCV2进入细胞,而后期随着IFN-β的产生,病毒滴度又显著升高。
1 材料与方法
1.1 材料
1.1.1 病毒和细胞 PCV2病毒,PK-15细胞,华南农业大学国家生猪种业工程技术研究中心猪病防控实验室保存。
1.1.2 试剂 LPS(大肠埃希氏菌),上海阿拉丁生化科技股份有限公司产品;LPS(沙门氏菌),上海善然生物科技有限公司产品;干扰素β,武汉云克隆科技股份有限公司产品;高糖DMEM培养基,胎牛血清,赛默飞世尔科技(中国)有限公司产品;双荧光报告基因试剂盒,上海碧云天生物技术有限公司产品;CCK-8细胞增殖及毒性检测试剂盒,MCE公司产品;病毒总核酸快速抽提试剂盒,广州美基生物科技有限公司产品;SteadyPure通用型RNA提取试剂盒,Evo M-MLV反转录试剂预混液,湖南艾科瑞生物工程有限公司;;Eastep®qPCR Master Mix(2X),普洛麦格(北京)生物技术有限公司产品。
1.1.3 主要仪器 荧光定量PCR检测仪,美国应用生物系统公司产品;细胞培养箱,赛默飞世尔科技(中国)有限公司产品;高速冷冻离心机,德国艾本德公司产品。
1.2 方法
1.2.1 引物设计与合成 从GenBank数据库中下载各基因序列,并用Primer 5生物软件设计,在生工生物工程(上海)股份有限公司合成。引物序列和GenBank序列号见表1。

表1 引物序列
1.2.2 PK-15细胞培养 从液氮中取出冻存的PK-15细胞,37℃迅速水浴回温,离心丢弃冻存液,加入100 g/L FBS高糖DMEM培养基,置于37℃、体积分数为5% CO2培养箱进行培养,待细胞长满后进行传代。细胞传代,首先弃瓶内的培养基,用已灭菌的PBS缓冲液清洗细胞3次,加入2.5 g/L胰酶进行消化,待细胞脱落后按照1∶3比例传代,多余细胞可进行后续细胞试验。
1.2.3 PCV2病毒接种 待细胞长至80%~90%时进行PCV2病毒接种,用20 g/L FBS高糖DMEM培养基稀释病毒(MOI=1的病毒感染剂量),将病毒液完全均匀覆盖细胞表面,放入37℃、体积分数为5% CO2培养箱进行孵育1 h,随后用PBS缓冲液润洗3次,换成新鲜20 g/L FBS高糖DMEM培养基维持液继续培养。
1.2.4 LPS对PK-15细胞活力试验 用CCK-8试剂盒进行LPS细胞毒力检测,操作方法严格按照产品说明书进行,将细胞铺到96孔板中,待细胞长至90%时,使用不同浓度的LPS(50、100、200、500、1 000、2 000 ng/mL)进行刺激,孵育24 h后,加入CCK-8试剂,37℃孵育1 h,用酶标仪在450 nm测定吸光度,对结果进行分析。
1.2.5 病毒吸附和内化试验 将长至90%的细胞放入4℃预冷30 min,丢弃原有培养基,进行接毒,放入4℃环境中2 h,用提前预冷的PBS培养基进行润洗3遍,清除未吸附的病毒粒子,使用病毒核酸提取试剂盒提取核酸,实时荧光定量PCR检测吸附结果。用不同处理对病毒吸附影响试验,处理1:用500 ng/mL的LPS在37℃孵育细胞1 h后,PBS润洗3遍后进行吸附试验;处理2:用50 ng/mL的LPS与PCV2病毒孵育1 h后,加入细胞中4℃孵育1 h;处理3:用500 ng/mL的LPS与PCV2病毒孵育1 h后,加入细胞中4℃孵育1 h,用实时荧光定量PCR检测病毒拷贝数,分析试验结果。
1.2.6 双荧光报告基因检测 构建靶向NF-κB和IFN-β基因的启动子基因序列连接到pGL3-basic质粒荧光素酶表达质粒上,成功得到pGL3-basic-NF-κB和pGL3-basic-IFN-β质粒,待PK-15细胞密度在60%时,将转录因子表达质粒与报告基因质粒共转染细胞内,24 h后用500 ng/mL LPS刺激细胞,收集12 h、24 h和48 h的细胞样品,加入裂解液冰浴5 min,充分离心去细胞上清液备用,配制萤火虫荧光素酶反应工作液和海肾荧光素酶反应液,各取100 μL先后加入到20 μL细胞裂解液中,充分振荡混匀,反应5 min后,分别在560 nm和465 nm波长采集荧光信号,分析试验结果。
1.2.7 实时荧光定量PCR检测 将待测细胞培养液吸出,PBS缓冲液润洗2遍,加入适量的细胞裂解液,随后按照动物细胞RNA提取试剂盒操作步骤进行操作,提取细胞RNA,使用Evo M-MLV反转录试剂盒进行反转录(10 μL的体系:5× Evo M-MLVRT Master Mix 2 μL,总RNA 500 ng,无核酸酶水加至10 μL,37℃ 15 min,85℃ 5 s),反转录产物作为定量检测模板,配制定量体系,总体系20 μL(Eastep®qPCR Master Mix 2× 10 μL,DNA模板2 μL,上游引物0.4 μL,下游引物0.4 μL,无核酸酶水7.2 μL,95℃ 2 min,40个循环,95℃ 15 s,60℃ 50 s),放入定量PCR仪中进行扩增,分析结果。
2 结果
2.1 LPS在对PCV2在PK-15细胞复制的影响
LPS对PK-15细胞毒性试验结果见图1,仅在2 000 ng/mL时沙门氏菌来源的LPS出现细胞毒性,其他浓度均无明显的细胞毒性。随后用安全浓度为500 ng/mL的来源于大肠埃希氏菌和沙门氏菌的LPS处理细胞,验证不同时间对PCV2复制情况的影响(图2),从PCV2的Cap基因的相对表达量来看,接毒后12 h,LPS均显著抑制了PCV2的复制,而24 h和48 h又显著促进了PCV2的复制,经3次重复,结果一致。

图1 LPS对PK-15细胞活性的影响
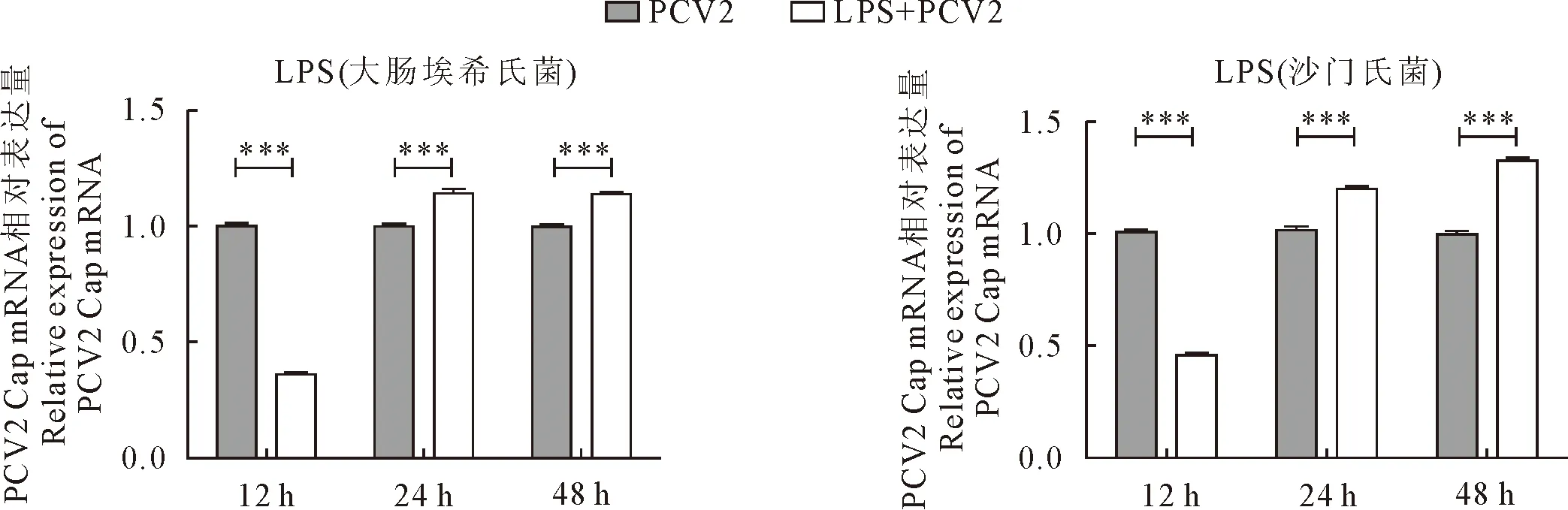
图2 不同时间点LPS对PCV2在PK-15细胞复制的影响
2.2 LPS抑制PCV2病毒的吸附
PCV2从侵入细胞到复制出新的子代病毒,至少需要18 h[13],在12 h抑制PCV2复制可通过抑制第1代PCV2病毒的吸附和内化来实现。本研究吸附试验表明(图3),LPS可以抑制PCV2病毒的吸附和内化。影响PCV2吸附存在两种可能,一是LPS直接与PCV2病毒粒子相互作用,抑制其与受体结合;或者LPS竞争PCV2的细胞受体发挥作用,为验证LPS的作用,设计不同处理方式(图4),与PCV2正常孵育细胞相比,用500 ng/mL LPS孵育细胞后接毒组未出现明显差异,而LPS与PCV2孵育后接毒明显抑制病毒的吸附,并且随着浓度的增加,抑制效果更加明显。表明LPS可能直接与PCV2病毒有相互作用,抑制病毒与细胞受体相互作用。

图3 LPS对 PCV2吸附的影响
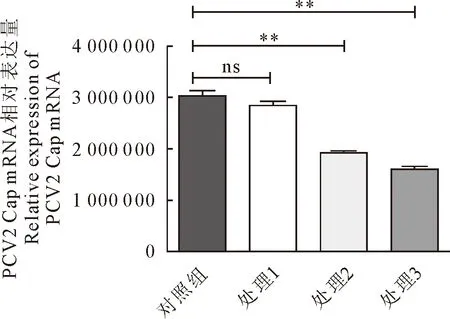
1.对照组;2.处理1;3.处理2;4.处理3
2.3 PCV2 Cap蛋白与LPS分子对接
用Pymol软件进行分子对接,从Uniprot数据库中查询PCV2蛋白序列,从PubChem数据库中下载LPS分子结构,用Pymol软件进行预测绘制两者相互作用图。选取亲和力较高的结果进行对接,提示两者存在相互作用的可能,并且具有多处结合位点(图5)。

图5 LPS与PCV2的Cap蛋白分子对接图
2.4 LPS促进TLR4的表达以及 NF-κB和IFN-β基因的转录
LPS是通过TLR4识别后,激活NF-κB信号通路,促进IFN-β产生。LPS刺激PK-15细胞后显著促进TLR4的mRNA的表达,而PCV2感染并不影响其表达量的变化(图6)。双荧光报告基因试验显示(图7),与对照组相比,在LPS刺激和病毒感染后12 h和24 h,NF-κB转录水平明显增加,在48 h促进效果不明显;同时IFN-β转录水平在各个时间点均有明显提高,所以LPS可以激活NF-κB和 IFN-β基因的转录,表明PCV2和LPS均能激活NF-κB信号通路,促进IFN-β的转录。

图6 LPS促进TLR4的mRNA表达

图7 LPS刺激与PCV2感染促进NF-κB,IFN-β基因转录
2.5 IFN-β促进PCV2 的复制
为了进一步验证LPS后期促进PCV2的复制与IFN-β产生相关,用猪源的500 ng/mL IFN-β加入接毒后的PK-15细胞培养液中,结果表明,与对照组相比,PCV2的复制情况在12 h没有明显差异,24 h后逐渐显现IFN-β促进PCV2复制,在48 h促进效果达到2.5倍之多(图8)。

图8 IFN-β处理PK-15细胞促进PCV2的复制
3 讨论
PCV2病毒是目前基因组最小的病毒之一[14],同时也是进化最成功的病毒之一,能充分利用自身遗传序列,推测至少编码11个开放型阅读框(ORFs),其中只有4个用于蛋白质的表达,分别为Cap蛋白、Rep蛋白、ORF3蛋白和ORF4蛋白,这些蛋白在满足自身增殖功能的同时,还可以逃避宿主的先天性免疫反应[15]。PCV2被认为是免疫抑制病原体,感染后会增加感染其他病原的风险[16]。有研究称PCV2与革兰氏阴性菌等共同感染可能是促进PCV2复制的重要因素,至少部分地促进了PMWS的全面发展[2]。临床上PCV2常与副猪嗜血杆菌、大肠埃希氏菌和沙门氏菌混合感染,并且表现出更加严重的症状,这其中很大程度上在于LPS引起的免疫系统的激活有关[17]。尤其是促进了IFN-β和IL-2的表达,可以显著促进PCV2的复制,深入研究PCV2病毒可以发现,该病毒有许多异于其他病毒的地方,NF-κB信号通路激活是宿主用于清除致病微生物的利刃,但是可以被PCV2所利用,当该通路受到抑制时,反而抑制了病毒的复制。而且具有抗病毒作用的干扰素(IFNα,IFN-β,IFN-γ)及白介素(IL-2)却可以促进病毒的复制[11,18]。
LPS作为免疫激活剂,可以激活TLR4-NF-κB信号通路从而促进IFN-β产生促进PCV2在PK-15的复制,然而,在本文中发现LPS本身可能与PCV2蛋白Cap存在相互作用,抑制PCV2被受体识别,从而达到抑制病毒吸附的效果。而且LPS与PCV2的Cap蛋白有多处结合位点,为了排除偶然性,用了来自不同细菌的LPS进行试验,重复3次,均发现在12 h,明显抑制PCV2的病毒滴度,这与后期的促进现象看似矛盾,却也可以合理的解释:在加入LPS前期,LPS与部分PCV2病毒粒子相互作用,抑制了部分病毒的吸附作用,而未相互作用的LPS与病毒粒子被相应受体识别,PCV2完成吸附和内化,释放核酸进行后续的复制,而LPS可以促进TLR4的表达,并且通过TLR4激活NF-κB等相关信号通路,致使细胞释放多种炎性因子,其中包括IFN-β和IL-2等,可以促进PCV2的复制,随着LPS浓度逐渐降低和失效,后期促进效果明显。另外,LPS与PCV2的核衣壳蛋白Cap在结构功能预测存在多处结合位点,具体机制还需进一步验证,这一现象也为研发PCV2抗病毒药物提供思路。
本文揭示了LPS对PCV2复制的影响,提示LPS自身存在抑制PCV2病毒吸附的功能,这将为开发抗PCV2病毒药物提供参考。LPS会激活TLR4-NF-κB-IFN-β信号通路,促进多种炎性因子的表达,促进PCV2的复制,提示PCV2与细菌或其他病毒共感染可能会促进病毒的复制,放大免疫反应,进一步加重临床症状;在构建PCV2发病模型时,加入LPS作为免疫刺激剂时,要注意引入的顺序和时间。
