谷子抽穗期突变体jt1242-14b的遗传分析和定位
2023-02-27王春芳祁东梅史慎奎张温典智慧刁现民
王春芳,祁东梅,史慎奎,张温典,智慧,刁现民
(1.河北民族师范学院 生物与食品科学学院,河北 承德 067000;2.中国农业科学院 作物科学研究所,北京 100081)
谷子(Setariaitalica),古称稷或粟,是一年生草本作物,原产于中国,是中国重要的粮食作物之一,在旱作农业可持续发展中具有不可替代的作用[1].谷子耐旱节水性强,被认为是应对未来干旱环境和气候变暖的战略储备作物.谷子作为二倍体自花授粉作物,基因组较小,操作方便,繁殖周期短,遗传相对简单,现已具备了较高质量的参考基因组序列[2],且谷子SSR遗传连锁图谱的发表[3],为谷子的遗传分析奠定了良好基础.
近年来,谷子农艺性状遗传的基础研究进展迅速,实现了多种遗传连锁图谱的构建和高质量基因组序列的公布[4-5].谷子的抽穗期也很受关注,国内外多家单位利用RIL群体分析等方法,对谷子部分抽穗期相关的QTLs进行了定位发掘[6-7].谷子其他性状的控制基因克隆也已取得了一定的进展,这为谷子遗传的发展提供了良好的理论和实践支持.目前,水稻中,抽穗期基因Hd7m[8]、EHD8[9]、DTH6[10]陆续被定位和克隆;小麦中,抽穗期基因TaHdM605[11]也已完成定位、克隆和功能分析;高粱中,已经完成了多个抽穗期基因QTL的分析[12];谷子中,已完成雄性不育基因SiMS1的定位[13]、棍棒穗性状的鉴定[14]、Si-SP1小穗突变基因的功能分析[15]、穗部突变体sidts1的鉴定[16]以及谷子穗发育调控基因SiAUX1和LP1的图位克隆与功能分析[17],但是关于谷子早抽穗基因的研究报道很少.
本研究利用化学诱变剂甲基磺酸乙酯(ethyl methyl suffocate,EMS)诱变谷子参考基因组品种豫谷1号,筛选获得能够稳定遗传的细秆早抽穗突变体并将其命名为jt1242-14b,用jt1242-14b与SSR41杂交得到F1,F1代植株自交获得F2,构建F2遗传分析群体,利用BSA[18]图位克隆与SSR分子标记技术,对该群体进行突变基因的初定位.本研究为早抽穗基因的挖掘、分子育种及功能基因分析提供理论依据.
1 材料与方法
1.1 实验材料
本研究中所用谷子品种豫谷1号和SSR41均来自北京中国农业科学院作物科学研究所.豫谷1号为目前已经测序完成有参考基因组的品种,而在构建基因定位群体中,SSR41被认为是与之匹配的理想基因型.SSR41与豫谷1号具有相似的植株高度和营养生长阶段的表型,这使得杂交后代突变体的表型更容易被观察和鉴定,并且SSR41在抽穗期和花期与豫谷1号几乎相同,因此二者可同时播种.
通过化学诱变剂EMS诱变豫谷1号,在其后代中观察得到细秆早抽穗突变体,杂合植株将其命名为jt1242-14b,jt1242-14b自交稳定遗传后与SSR41杂交,得到F1代杂合植株,F1代自交得到914株F2群体,F2群体筛选性状为细秆早抽穗的个体,将其作为基因定位群体,单株收集其成熟期叶片作为实验材料.用于基因定位的植株群体和农艺性状调查的植株均种植于北京中国农业科学院.
1.2 突变体农艺性状调查
在谷子抽穗期和成熟期,分别对豫谷1号和jt1242-14b进行农艺性状的调查,主要观察记录叶期、株高、茎粗、茎长、旗叶长、旗叶宽、茎节数、穗长、穗粗以及码数,并对相应的农艺性状进行统计及方差分析.
1.3 叶片总DNA的提取及PCR扩增
对F2遗传群体中的隐性单株进行编号,取叶片进行DNA的提取.本实验采用CTAB法[19]提取样品DNA,然后进行PCR扩增.PCR体系为20 μL,包括2×PCR缓冲液10 μL,2.5 mmol/L的dNTPs 1.6 μL,10 mmol/L的上下游引物2 μL,1 U DNA聚合酶,基因组DNA约50 ng,dd H2O补齐至20 μL.反应程序为95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 2 min,16 ℃ 2 min.
1.4 父母本中分子标记多态性的筛选
参照实验室已有的[15]能够覆盖谷子全基因组的260对SSR标记引物,首先以父本SSR41、母本jt1242-14b、F2突变体单株DNA混池、F1杂合植株的DNA模板进行PCR扩增,PCR产物用聚丙烯酰胺凝胶电泳和银染显色技术检测条带分离情况.当父本和母本的条带单一、清晰,并且存在多态性时,该SSR标记引物可用于后续初定位实验;若父本和母本的条带不存在多态性,则该SSR标记引物不可用.记录并统计可用于筛选父母本多态性的分子标记.
1.5 用SSR标记进行基因初定位
采用基因分离分组分析法(BSA)对目的基因进行初定位[20].首先选取F2群体中30株突变体单株叶片的DNA构建混池,然后以SSR41(显性父本)、jt1242-14b(隐性母本)、F2突变体单株DNA混池以及F1杂合植株的DNA为模板,用上一步已筛选出的父母本间有多态性的SSR分子标记,再进行PCR扩增,筛选与目的基因紧密连锁的SSR分子标记.当筛选的SSR分子标记在混池样品中只扩增出母本条带,父本带明显变弱近乎消失时,说明该标记与目的基因紧密连锁,此时可以确定控制突变性状的目的基因所在的染色体的大概位置,该SSR分子标记再用于后续基因的精细定位.
1.6 突变基因的精细定位
用上一步筛选出的与突变基因紧密连锁的SSR分子标记,进一步分析F2群体中的突变体单株,即利用PCR技术结合该标记对父本、母本、F2突变体单株DNA混池、F1杂合植株和F2中隐性单株进行基因扩增,聚丙烯酰胺凝胶电泳和银染显色检测扩增产物,分析条带中的单株交换株趋势,统计结果并记录数据.
2 结果与分析
2.1 jt1242-14b突变体形态特征及主要农艺性状统计
对豫谷1号和jt1242-14b在苗期进行表型观察:二者在苗期表型无明显差异,F2植株中正常型与突变型分别是679株和235株,用理论分离比3∶1进行卡方检验(χ2=0.004,P>0.05),结果显示正常型和突变型的比例(2.89∶1)符合3∶1的数量分离比例,说明该突变性状受隐性单基因控制.在抽穗期进行表型观察:豫谷1号抽穗时间为当年8月3号,而jt1242-14b的抽穗时间为同年7月11号,jt1242-14b抽穗时间较豫谷1号提早24天,差异极显著(图1a-b);与豫谷1号相比,jt1242-14b植株高度降低,约为豫谷1号的51.58%,茎节节数变少,茎秆变细、变长(图2a-d);jt1242-14b旗叶的长度和宽度都明显变短(图2e-f).对穗部性状进行观察:豫谷1号穗长约为22.1 cm,而jt1242-14b的穗长约为6.9 cm,jt1242-14b穗长约为豫谷1号的31.22%;豫谷1号穗粗约为27.0 mm,jt1242-14b穗粗约为8.0 mm,jt1242-14b的穗粗约为豫谷1号的29.63%(图2g-h);此外,jt1242-14b的穗码紧实,穗码数量变少,约为豫谷1号码数的51.22%(图2i).对两者的农艺性状进行t检验,突变体与豫谷1号间的性状差异均已达到显著水平(图2).
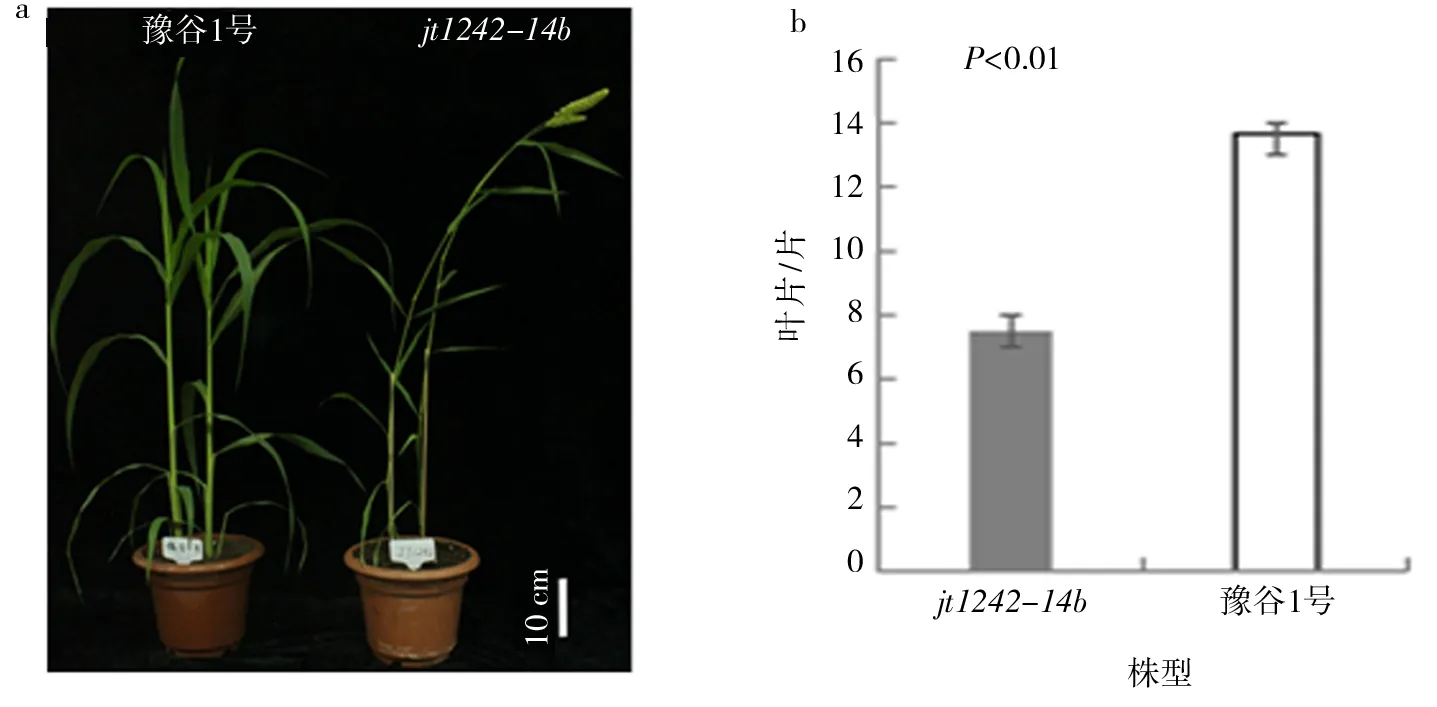
图1 豫谷1号和突变体jt1242-14b抽穗期表型比较

a.株高; b.茎粗; c.茎长; d.节数; e.旗叶长; f.旗叶宽; g.穗长; h.穗粗; i.码数
2.2 父母本间多态性标记的筛选结果
为了筛选出可用于基因定位的SSR分子标记,利用实验室中可覆盖谷子全基因组的260对SSR分子标记引物,首先以父本SSR41、母本jt1242-14b、F2突变体单株DNA混池、F1杂合植株的DNA为模板进行PCR扩增,PCR产物用聚丙烯酰胺凝胶电泳,检测父本SSR41与母本jt1242-14b之间的条带是否存在多态性.对父母本条带之间存在多态性的SSR分子标记进行统计,共筛选出SSR分子标记81对,这些标记遍布9条染色体,在各染色体上的分布数量分别是7、14、7、6、3、15、5、9、15.
2.3 突变基因定位分析
首先,用筛选出来的81个父、母本间多态性好的SSR分子标记分析突变基因位于哪条染色体,以F2代群体中60株隐性单株的DNA为模板,进行PCR扩增.电泳检测结果中,依据母本扩增带强、父本扩增带很弱或几乎没有的标准,筛选出2个与目标基因连锁的分子标记,分别是In4746(图3a)和In9-11(图3b).结合BSA法进行分析,得到目标基因位于第9染色体上.然后,应用Primer 3软件,在In4746和In9-11标记附近又设计了12个分子标记,继续进行F2代群体中60株隐性单株的PCR检测,结果显示,In9-154(图3c)、In9-102(图3d)和In9-87(图3e)也是与目标基因紧密连锁的分子标记.最终统计结果如表1所示:在标记In4746检测中,交换株数量最少,在其上下游随着物理距离的加大,分子标记检测出的交换株数量逐渐增多,说明jt1242-14b的突变基因距离In4746标记最近.
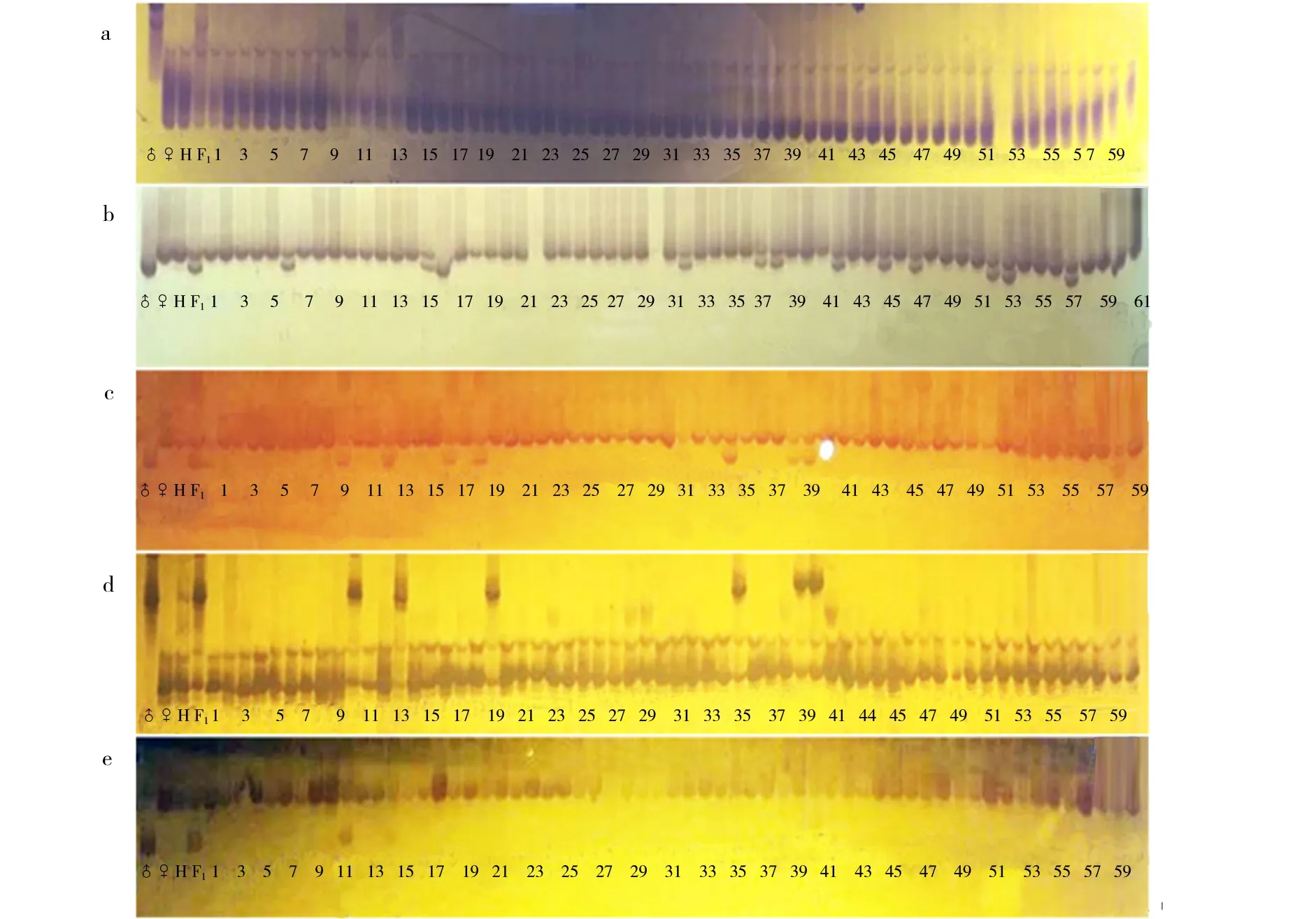
a-e.标记In4746、In9-11、In9-154、In9-102、In9-87在部分突变体植株中的分离带型.♂.SSR41;♀.jt1242-14b;H.F2突变体单株DNA混池;F1.jt1242-14b×SSR41的F1
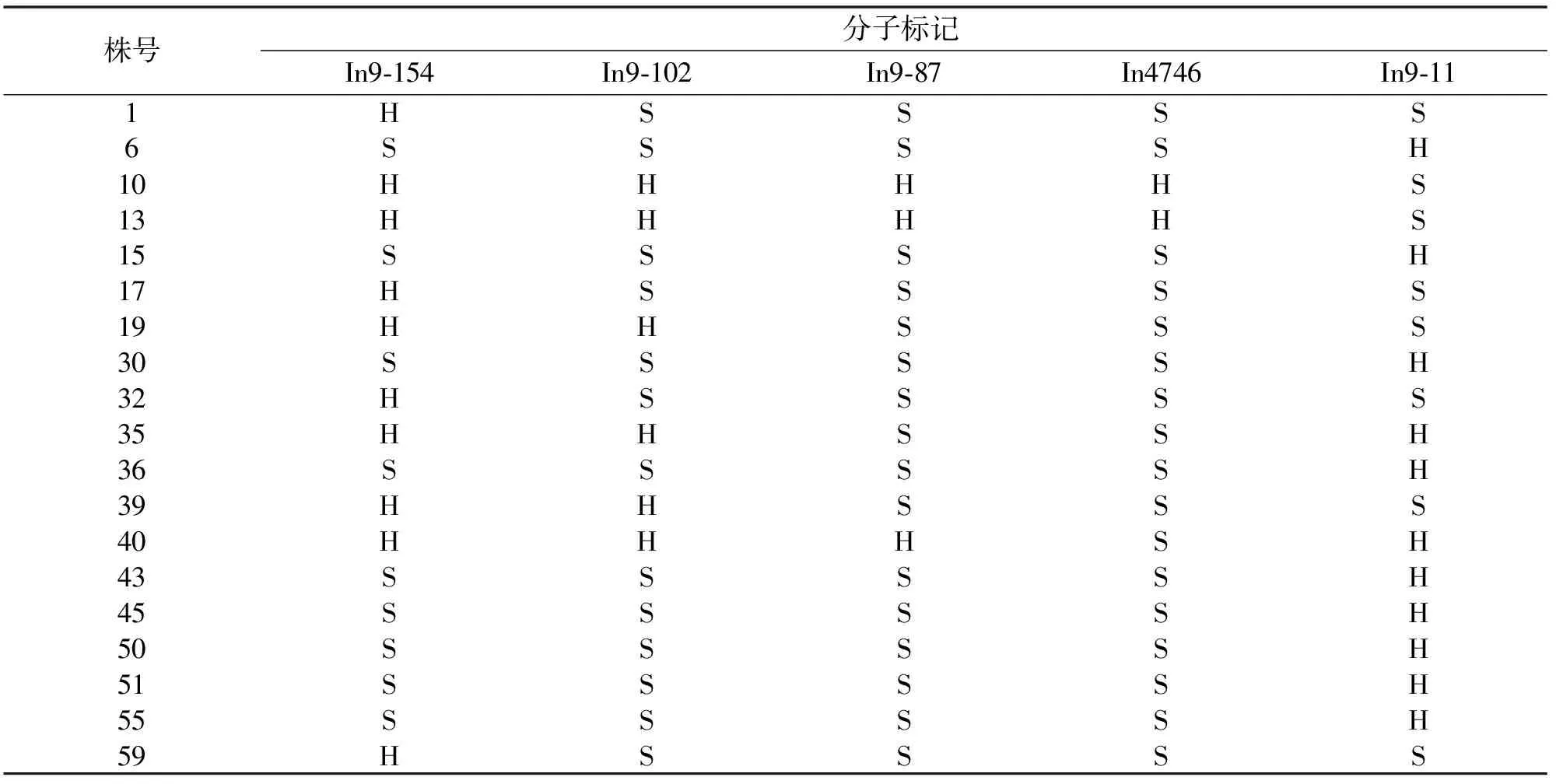
表1 利用分子标记检测重组交换事件
2.4 候选基因及测序的分析
为筛查突变的目的基因,首先对9号染色体上4 447 kb的候选区间内所含的基因进行分析,发现该区域内包含谷子PHYB基因,且有文献报道PHYB基因的突变体有早抽穗的表型[19].因此,本文首先对该基因进行测序,测序结果显示,突变体的基因组序列与豫谷1号相比,在该基因的第5个外显子上发生了一个碱基缺失(图4),使得该基因在错误编码了4个氨基酸后提前终止,因此初步确定突变的目的基因是PHYB基因.

T1242.豫谷1号DNA序列;70814765.突变体1号;70814766.突变体2号
3 讨论
本研究中谷子早抽穗突变体是通过豫谷1号经EMS诱变而来,为单基因隐性遗传.本研究通过BSA基因定位法,将谷子细秆早抽穗基因定位在第9染色体上分子标记In4746、In9-11之间的4 447 kb物理距离之内.经测序分析,该突变基因是由PHYB突变而来.作为光敏色素的PHYB基因,在感知昼夜长短和光的强弱后,通过产生昼夜节律及激发信号转导途径来控制植物开花进程[21],因此,该基因与谷子的抽穗期密切相关.
目前,很多水稻、小麦抽穗期基因[8-11]先后被定位和克隆.高粱方面,已完成对抽穗期部分基因的QTL分析[12].相关研究表明,不同植物中均存在与抽穗相关的同源基因[4],特别是禾本科植物的抽穗期基因同源性很高,水稻、玉米、高粱中关于光敏色素对花期的调控报道显示,长日照条件下PHYB基因抑制开花[21-23],而PHYA和PHYC共同促进开花[24],在对谷子抽穗期研究上,光敏色素基因PHYA、PHYB和PHYC受光周期调控[25]以及穗发育调控基因的图位克隆与功能分析[16]已有报道,但对于早抽穗基因的分子机理和调控途径还不清晰.虽然拟南芥和水稻中的开花诱导模型可以为谷子抽穗期分子机制研究提供重要的线索,但并不能完全解释禾本科模式作物谷子抽穗开花诱导的机理.
谷子抽穗期长短与地方品种的系统发育分化有关,但光周期如何调控谷子抽穗开花,目前研究的还比较少,多数研究集中于表型分析及基因定位,本研究中筛选获得的谷子突变体jt1242-14b,具有稳定遗传特性.同豫谷1号相比,该突变体秆部明显变细,叶变窄、变短,抽穗期明显提前.遗传分析表明,该突变体受隐性单基因控制,通过构建914株F2遗传分析群体进行定位分析和测序比对,基本明确该突变基因由PHYB突变而来,这与其他物种中PHYB在长日照下抑制开花的表型一致[21,23-24],这可为今后植物的光周期调控提供理论依据.
贾小平等[26-27]分析了春谷、夏谷的光温反应特性,结果表明光温条件对春谷和夏谷的影响是全方位的,并发现了2个与光周期敏感的SSR分子标记.通过研究谷子SiCCT基因和SiHd3a基因的表达特点,推测SiCCT基因通过参与光周期和温度互作调控机制来调节谷子抽穗期;并发现长日照条件下谷子SiHd3a基因与水稻Hd3a基因表达存在差异,产生这种差异的原因可能是谷子SiHd3a基因在长日照条件下对谷子开花调控并不发挥作用,谷子中可能存在着另一个成花素基因专门负责长日照条件下促进抽穗开花.在本研究中,利用群体中提供的F2隐性突变中的60个单株,采用BSA法及SSR分子标记技术等,将突变基因(细秆早抽穗基因)定位在第9染色体上标记In4746和In9-11之间.考虑到群体交换律低等原因,实验设计中可增加定位群体,分析交换株趋势.另外,本研究经过测序,将突变体基因确定为PHYB,但还需要探究该基因的缺失突变体表型,以进行基因功能验证,进一步完善本研究.
4 结论
通过EMS诱变豫谷1号,筛选获得了谷子早抽穗突变体jt1242-14b.突变体表现为抽穗期提前,茎秆变细,叶片变窄、变短.遗传分析表明,该突变性状受隐性单基因控制.利用BSA基因定位法,将该基因定位在第9染色体上分子标记In4746和In9-11之间的4 447 kb内.经测序验证,该突变基因很可能为PHYB.
