低浓度阿奇霉素对猪链球菌2型蛋白表达、荚膜多糖与药物敏感性的影响
2023-02-27杨艳北刘婉萍陶艾妮冯育林
杨艳北,许 晶,刘婉萍,陶艾妮,冯育林,孙 勇,王 闯,刘 建
(1.江西中医药大学博士后流动站/正邦集团有限公司博士后工作站,南昌 330000;2.南昌师范学院生物技术研究院/江西省地方鸡种遗传改良重点实验室,南昌 330000;3.南昌师范学院生命科学学院,南昌 330000; 4.江西正邦养殖有限公司,南昌 330000)
阿奇霉素属于人用大环内酯类抗生素,被农业农村部列为畜禽禁用兽药。目前,阿奇霉素违规用于畜禽养殖,虽然国家明令禁止,但是养殖户仍将阿奇霉素等人用抗生素添加于饲料中或通过其他途径使用,导致人用抗生素被滥用于畜禽,已成为威胁畜禽产品安全的新隐患[1]。阿奇霉素的滥用,致使养猪环境中出现大量残留,导致猪链球菌2型与低浓度阿奇霉素有机会长期共存,猪链球菌2型改变自身状态以应对阿奇霉素的选择压力[2]。环境中残留的低浓度抗生素会改变细菌的栖息环境,对细菌的生存构成严重威胁,极易产生耐药菌株[3-4]。
荚膜多糖是猪链球菌2型的主要毒力因子,位于细胞表面,能让猪链球菌2型逃避免疫监视,促进致病性感染,具有抗吞噬、黏附和定植等多种生理功能。荚膜多糖在猪链球菌2型生长、繁殖和应对不良环境过程中起着关键作用,受cps基因调控。猪链球菌2型cps基因由cpsA~cpsV共22个基因组成,主要发挥糖链长度的调节、糖基的聚合、多糖的运输和特化修饰等重要生物学功能[5-6]。
细菌对抗生素的外排作用是细菌多重耐药的重要机制。细菌外排泵是存在于细胞膜上的,具有外排功能的膜转运蛋白,能够将进入胞内的抗菌药物泵出胞外,使菌体内药物浓度降低而导致耐药,ABC转运蛋白属于细菌多重耐药的主动外排泵[7-9]。ABC转运蛋白通过ATP结合和水解推动药物自由排出。ABC转运蛋白作用的底物种类较多,除抗生素外,还包括氨基酸、糖类、离子和多糖类化合物等[10-13]。
本研究用低浓度阿奇霉素处理猪链球菌2型,利用蛋白质组学iTRAQ技术,筛选关键差异表达蛋白,测定猪链球菌2型的荚膜多糖含量和药物敏感性,为进一步研究环境中低浓度抗生素对微生物的影响奠定基础。
1 材料与方法
1.1 材料
猪链球菌2型ATCC700794购自美国模式培养物保藏中心(ATCC)。Todd-Hewitt肉汤(THB)培养基购自海博生物科技有限公司。阿奇霉素(ABT070-5 g)购自金克隆(北京)生物技术有限公司。
1.2 阿奇霉素对猪链球菌2型最小抑菌浓度(MIC)的测定
MIC的测定,以大肠埃希菌ATCC 25922和金黄色葡萄球菌ATCC 25923作为质控菌,严格按照美国临床检验标准委员会(CLSI)推荐的微量肉汤稀释法进行,待猪链球菌2型增至108cfu·mL-1后,稀释为105~106cfu·mL-1,接种于含不同药物浓度的96孔板中,37 ℃恒温培养24 h,观察结果。药敏结果判定标准参照 CLSI-VET01S[14]。
1.3 蛋白质组学iTRAQ技术筛选关键差异表达蛋白
试验分组:猪链球菌2型在含有1/4 MIC阿奇霉素的THB中,37 ℃培养72 h后,8 000 r·min-1离心10 min,用离心管收集菌体,用生理盐水冲洗3次,于-80 ℃冰箱中备用,作为处理组。以无阿奇霉素处理的猪链球菌2型作为对照组。iTRAQ 试验方法参照文献[15]进行,方法如下。
将上述样品裂解,超声破碎,取上清,Bicinchoninic Acid Assay法测定蛋白浓度。样品进行 SDS-PAGE电泳,考马斯亮蓝染色。样品酶解后,OD280 nm肽段定量。样品按照 AB 公司试剂盒:iTRAQ Reagent-8plex Multiplex Kit (AB SCIEX)说明书进行标记。将试验标记后的肽段混合,进行SCX预分级。样品采用纳升流速HPLC液相系统Easy nLC进行分离。样品经毛细管高效液相色谱分离后,用Q-Exactive质谱仪(Thermo Finnigan)进行质谱分析。质谱原始数据进行查库鉴定及定量分析。在蛋白质定量过程中,要求每个蛋白至少包含2个唯一肽段。当差异倍数>1.1且P<0.05时,认为该蛋白差异显著。利用Proteome Discoverer软件对鉴定的差异表达蛋白进行GO分类注释,包括分子功能、细胞组分和生物过程。
1.4 荚膜多糖含量测定
试验分组:猪链球菌2型在含有1/4 MIC阿奇霉素的 5 L THB液体培养基中,37 ℃培养72 h后,离心收集菌体,作为处理组。在相同环境下培养5 L猪链球菌2型,并离心收集菌体,作为对照组(无阿奇霉素)。荚膜多糖提取及测定方法参照文献[16]进行,方法如下,略有改动。
荚膜多糖提取:离心获得的菌体,分别在生理盐水中冲洗、离心,悬浮于含有溶菌酶的100 mL甘氨酸缓冲液(甘氨酸0.1 mol·L-1,溶菌酶1 mg·mL-1,pH 9.2),37 ℃作用6 h,离心取上清。取50 mL上清,加入终浓度为100 μg·mL-1蛋白酶K,55 ℃作用2 h,然后加入脱氧核糖核酸酶和核糖核酸酶,37 ℃作用1 h,然后加入蛋白酶K,并在上清中加入终浓度为0.1 mol·L-1的CaCl2,搅拌1 h,再加入终浓度为25%的无水乙醇,4 ℃放置2 h,离心除去上清液中沉淀出来的核酸,之后加入终浓度为80%无水乙醇,4 ℃放置过夜沉淀,得到处理组和对照组荚膜多糖。
采用硫酸-苯酚法测定荚膜多糖含量:取处理组和对照组荚膜多糖,分别配成5.0 mg·mL-1溶液。取2 mL上述溶液,依次加入1.0 mL 6%的苯酚和5.0 mL浓硫酸,静止10 min,摇匀,室温放置20 min。测定上述溶液中OD490 nm吸光度,用于反映处理组和对照组荚膜多糖含量。
1.5 药物敏感性
以1/4 MIC 阿奇霉素作为诱导药物,人工诱导猪链球菌2型。将100 μL猪链球菌2型,在含有1/4 MIC阿奇霉素的10 mL THB液体培养基中,37 ℃培养16~24 h,将其作为下一代诱导的母菌,一共盲传诱导15代(诱导菌株)。将诱导菌株在不含阿奇霉素的液体培养基中盲传10代,即为第25代菌株(恢复菌株)。依次取第5、10、15和25代的菌株,测定其对大环内酯类抗生素(红霉素、阿奇霉素、泰乐菌素)、氨基糖苷类抗生素(卡那霉素、链霉素、安普霉素、庆大霉素)、喹诺酮类抗生素(诺氟沙星、环丙沙星、氧氟沙星)的MIC。无阿奇霉素处理的猪链球菌2型作为对照组。MIC的测定参照“本研究方法1.2”进行。
2 结 果
2.1 阿奇霉素对猪链球菌2型MIC的测定
阿奇霉素对猪链球菌2型ATCC 700794的MIC 是0.007 812 5 mg·L-1,根据美国 CLSI 判定标准,阿奇霉素的敏感折点为 0.5 mg·L-1,因此猪链球菌2型 ATCC 700794 对阿奇霉素敏感(非耐药菌株)。
2.2 蛋白质组学iTRAQ技术筛选关键差异表达蛋白
2.2.1 蛋白样品定量结果 样品经裂解后,BCA法测定蛋白浓度。处理组蛋白质浓度为2.94 μg·μL-1,对照组蛋白质浓度为2.31 μg·μL-1。样品浓度符合后续试验要求。
2.2.2 SDS-PAGE电泳 蛋白样品经 SDS-PAGE 电泳分离后,如图1所示,样品条带分离清晰,较为均一,蛋白质样品符合后续试验要求。
M.蛋白质相对分子质量标准;1.处理组;2.对照组
2.2.3 酶解肽段浓度测定 酶解后肽段以OD280 nm吸收值评估其相对浓度,以相关系数OD280 nm=1.1 为 1 μg·μL-1,将吸光度值换算为蛋白质浓度。处理组酶解肽段浓度为2.15 μg·μL-1,对照组酶解肽段浓度为1.98 μg·μL-1。
2.2.4 蛋白质鉴定结果 SCX分级并脱盐后的10个样品经质谱分析及Mascot查库,结果合并后,以Peptide FDR≤0.01筛选过滤。结果显示,唯一肽段为15 919个,蛋白质组为1 565个。
2.2.5 定量分析结果 本研究分为两组,一组为处理组(1/4 MIC阿奇霉素),二组为对照组(无阿奇霉素)。定量时分别以每组的对照组为内参,各组蛋白质的比值均采取各通道标签与内参的比值。本研究中共鉴定到的蛋白质组为1 565个,其中,各通道标记标签皆有定量信息的蛋白质有1 501个。
2.2.6 生物信息学分析 本研究中共鉴定到1 501个蛋白质,按照差异倍数>1.1且P<0.05进行筛选,共得到差异表达蛋白174个,差异表达蛋白占总鉴定蛋白的11.6%。大多数鉴定出的差异表达蛋白具有催化活性,参与代谢过程,属于膜蛋白(图2)。低浓度阿奇霉素将全面影响猪链球菌2型催化活性和代谢过程。膜蛋白对于猪链球菌2型适应阿奇霉素的选择压力具有重要作用。总之,猪链球菌2型通过改变自身蛋白质组的表达量,以适应阿奇霉素的选择压力。
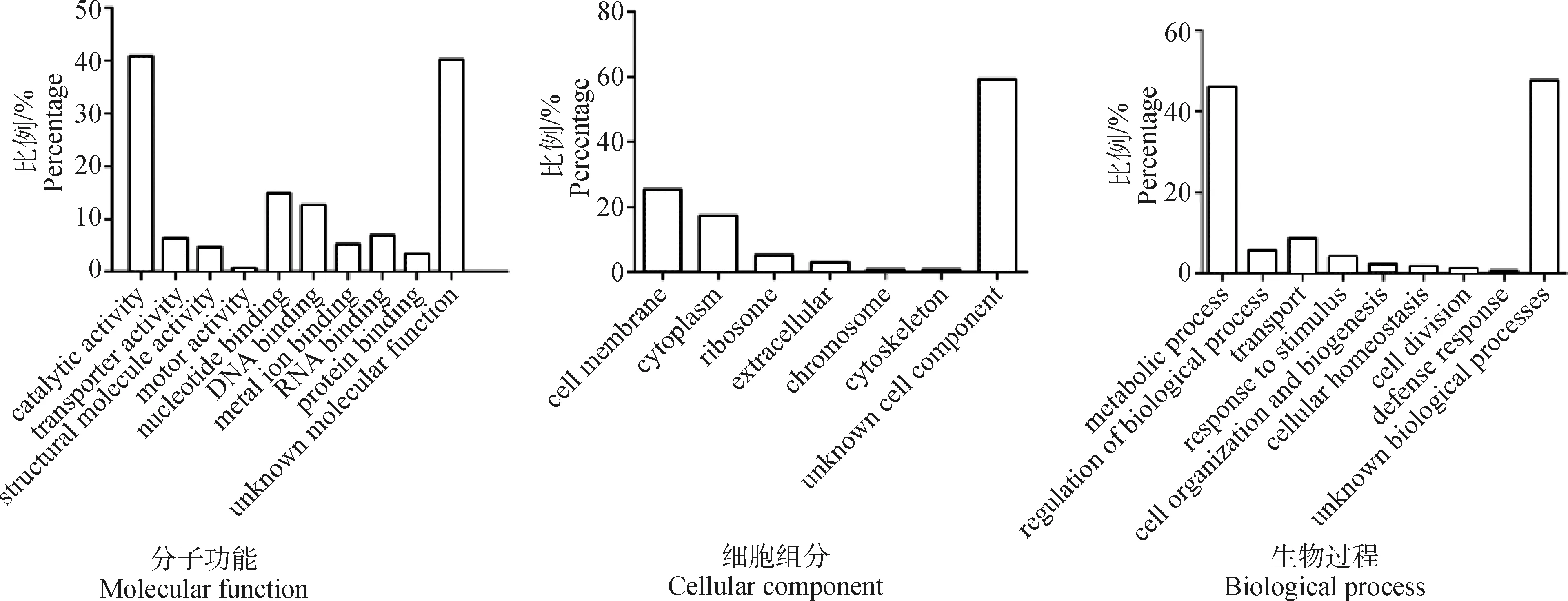
图2 低浓度阿奇霉素处理后的猪链球菌2型差异表达蛋白GO分析
2.2.7 关键差异表达蛋白的iTRAQ鉴定 利用同位素标记相对和绝对定量(iTRAQ)技术,本研究分析处理组(1/4 MIC阿奇霉素)和对照组(无阿奇霉素)的关键差异表达蛋白,如表1所示。3个荚膜多糖蛋白(M1VJJ3、G8DTL7、M1VE09)上调表达。8个荚膜多糖蛋白(K0FG35、M1VRI8、M1VK55、M1VE47、E9 NQ13、M1VRH4、M1VRG0、E9 NQ29)下调表达。9个ABC转运蛋白(R4 NLJ6、A4VW83、G5L0Q7、A4 W271、G7S3 W1、G7SAB5、A4VTM2、G7S5E3、G7SD52)上调表达。1个50S核糖体蛋白(A4 W1B7)上调表达。4个50S核糖体蛋白(G5L0U4、A4VYQ7、G7S1 W2、A4VSF4)下调表达。4个30S核糖体蛋白(A4 W3Q2、A4VYR6、A4 W3 W8、R4 NLK5)下调表达。1个核糖体RNA甲基转移酶(G7SM56)上调表达。1个核糖体RNA甲基转移酶(A4 W3H4)下调表达。1个DNA回旋酶(R4 NVK5)上调表达。1个DNA聚合酶IV(G5KZN4)下调表达。

表1 低浓度阿奇霉素处理后的猪链球菌2型关键差异表达蛋白
2.3 荚膜多糖含量测定
采用硫酸-苯酚法测定处理组(1/4 MIC 阿奇霉素)和对照组(无阿奇霉素)荚膜多糖含量,以OD490 nm吸光度反映荚膜多糖含量。结果显示,1/4 MIC 阿奇霉素处理的猪链球菌2型荚膜多糖含量与对照组相比,不具有统计学差异(P>0.05),荚膜多糖含量未发生大幅度变化(图3)。
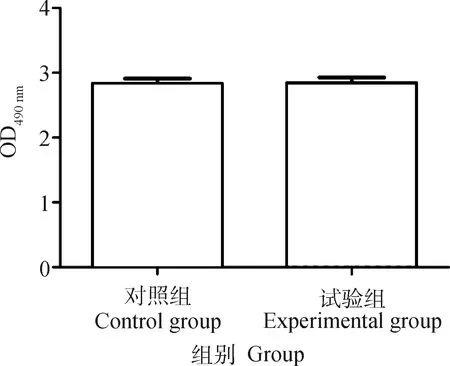
图3 低浓度阿奇霉素处理后的猪链球菌2型荚膜多糖含量测定
2.4 药物敏感性
采用微量肉汤稀释法测定诱导菌株(第 5、10、15 代)以及恢复菌株(第25代)对大环内酯类抗生素、氨基糖苷类抗生素、喹诺酮类抗生素的 MIC。根据美国 CLSI 判定标准,结果显示,猪链球菌2型ATCC 700794对红霉素、阿奇霉素、泰乐菌素、氧氟沙星敏感,对环丙沙星、诺氟沙星、卡那霉素、链霉素、安普霉素、庆大霉素耐药。诱导菌株对大环内酯类抗生素(红霉素、阿奇霉素、泰乐菌素)、部分氨基糖苷类抗生素(卡那霉素、链霉素)、部分喹诺酮类抗生素(诺氟沙星)的药物敏感性与对照组相比差异显著(P<0.05)。诱导菌株对部分抗生素的敏感性降低。诱导菌株恢复正常培养后,诱导菌株的药物敏感性与对照组相比差异不显著(P>0.05)。诱导菌株对抗生素的敏感性迅速恢复到原始菌株状态(图4)。
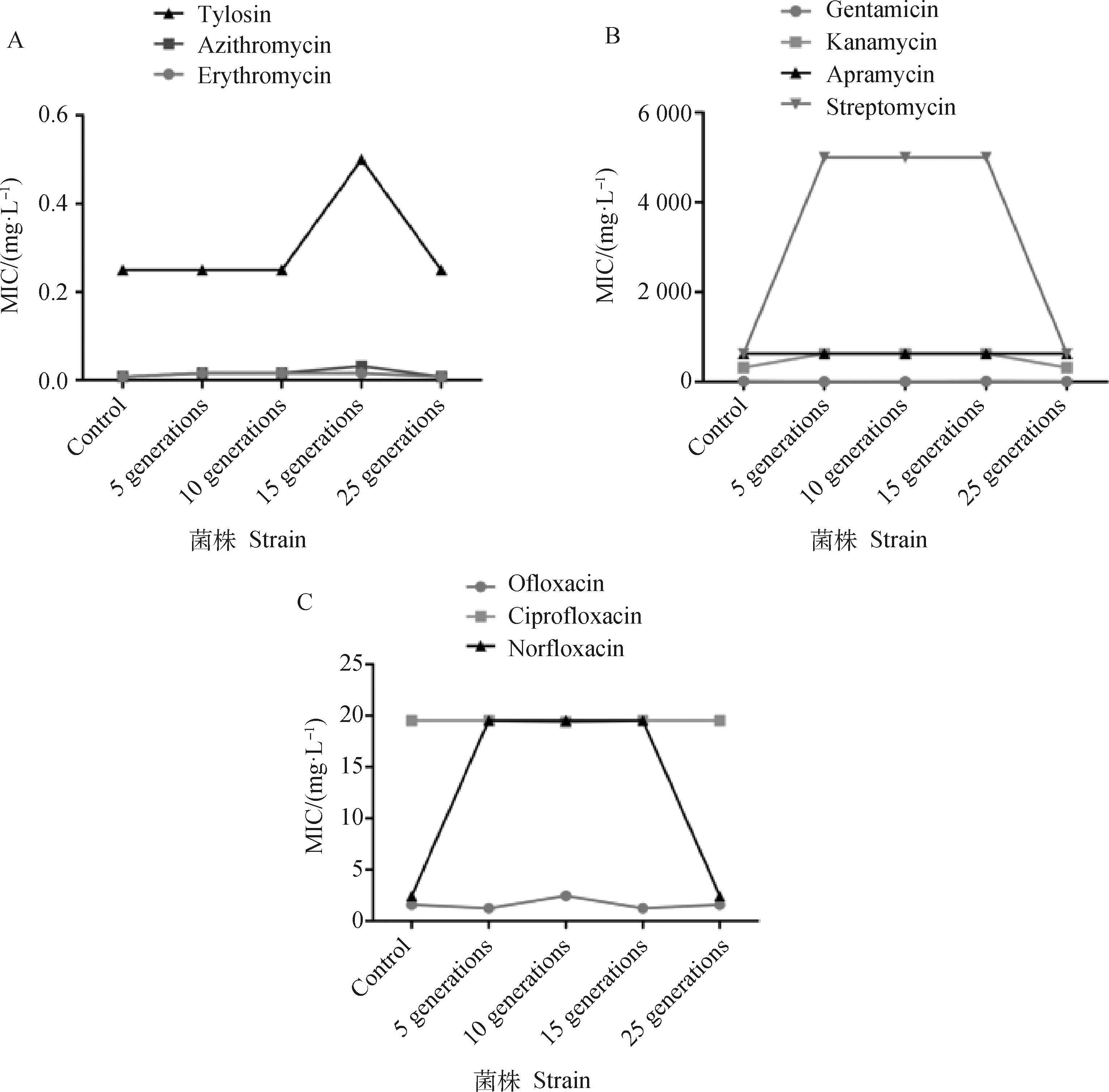
图4 猪链球菌2型对大环内酯类(A)、氨基糖苷类(B)、喹诺酮类(C)抗生素的药物敏感性
3 讨 论
猪链球菌2型为应对阿奇霉素的选择压力,3个荚膜多糖蛋白(基因名:cps6J、cps1/2H、cps30N)上调表达,8个荚膜多糖蛋白(基因名:cpsR、cps28Q、cps28H、cps33F、cps16F、cps26L、cps22M、cps16U)下调表达,阿奇霉素处理后的猪链球菌2型荚膜多糖含量未发生大幅度变化。cpsF基因编码鼠李糖转移酶,功能是催化和添加鼠李糖。cpsH基因编码半乳糖基转移酶,参与半乳糖的合成。cpsJ基因编码N-乙酰氨基葡萄糖转移酶,该酶参与合成N-乙酰葡萄糖胺寡聚物。cpsK基因编码β-1,4-半乳糖基转移酶,该酶将半乳糖苷基团转移到葡萄糖或N-乙酰氨基葡萄糖上。cpsN基因编码唾液酸转移酶,参与唾液酸寡糖合成。cpsQ基因编码尿苷二磷酸-N-乙酰葡糖胺-2-异构酶,该酶是唾液酸合成的起始限速酶。cpsR基因编码乙酰转移酶,该酶将唾液酸生成O-乙酰化的单磷酸胞苷-N-乙酰神经氨酸。cpsL基因、cpsM基因、cpsU基因编码产物尚不清楚,功能也尚不清楚[17-24]。猪链球菌2型为适应阿奇霉素的选择压力,影响荚膜多糖蛋白的表达,从而提高其在环境中的生存能力。
猪链球菌2型为应对阿奇霉素的选择压力,9个ABC转运蛋白上调表达,推测这些ABC转运蛋白涉及到细菌多重耐药的主动外排功能。9个ABC转运蛋白上调表达,可能导致猪链球菌2型对多种抗生素的敏感性下降,其中,ABC型多药转运系统ATP酶(A4VW83)已被证实是细菌多重耐药的主动外排泵,属于细菌的一种防御机制[25]。ABC超家族ATP结合盒转运体(G7SD52)上调表达约5.6倍,上调表达量最为显著,推测该蛋白对于猪链球菌2型外排阿奇霉素起着关键作用。猪链球菌2型为适应阿奇霉素的选择压力,大量表达多重耐药的主动外排泵(ABC转运蛋白)。ABC转运蛋白对于猪链球菌2型适应阿奇霉素的选择压力具有重要作用。用低浓度阿奇霉素处理猪链球菌2型,发现其对多种抗生素的敏感性下降,存活下来的菌株,恢复正常培养后,药物敏感性恢复。与低浓度阿奇霉素共存时,猪链球菌2型的生理适应性,例如开启外排泵系统,足以应对阿奇霉素的选择压力,消除阿奇霉素后,容易恢复药物敏感性。外排作用虽然只是赋予了细菌低水平的耐药,但为染色体突变导致的高水平耐药提供了宝贵的时间。
猪链球菌2型为应对阿奇霉素的选择压力,1个50S核糖体蛋白(A4 W1B7)上调表达,4个50S核糖体蛋白(G5L0U4、A4VYQ7、G7S1 W2、A4VSF4)下调表达,4个30S核糖体蛋白(A4 W3Q2、A4VYR6、A4 W3 W8、R4 NLK5)下调表达,1个核糖体RNA甲基转移酶(G7SM56)上调表达,1个核糖体RNA甲基转移酶(A4 W3H4)下调表达。猪链球菌2型为适应阿奇霉素的选择压力,改变核糖体蛋白表达量,从而提高其在环境中的生存能力。
4 结 论
蛋白质组学试验显示,低浓度阿奇霉素将全面影响猪链球菌2型催化活性和代谢过程。膜蛋白,例如药物外排泵蛋白,对于猪链球菌2型适应阿奇霉素的选择压力具有重要作用。总之,猪链球菌2型通过改变自身蛋白质组的表达量,以适应阿奇霉素的选择压力。与低浓度阿奇霉素共存时,猪链球菌2型开启外排泵系统,会增加细菌产生多重耐药的风险。
